J45 Астма, МКБ-10
- J45.0 Астма с преобладанием аллергического компонента
- J45.1 Неаллергическая астма
- J45.8 Смешанная астма
- J45.9 Астма неуточненная
Отредактировано: 11.09.2025
Бронхиальная астма
Определение
Бронхиальная астма (БА) – гетерогенное заболевание, характеризующееся хроническим воспалением дыхательных путей (ДП) и наличием респираторных симптомов, таких как свистящие хрипы, одышка, заложенность в груди и кашель. Клинические проявления отличаются по времени и интенсивности и появляются при обструкции дыхательных путей [1].
Классификация
Классификация БА по степени тяжести при впервые выявленном заболевании проводится на основании клинической картины. При этом для того, чтобы определить более тяжелую степень заболевания, достаточно наличие одного из критериев тяжести соответствующей группы [2].
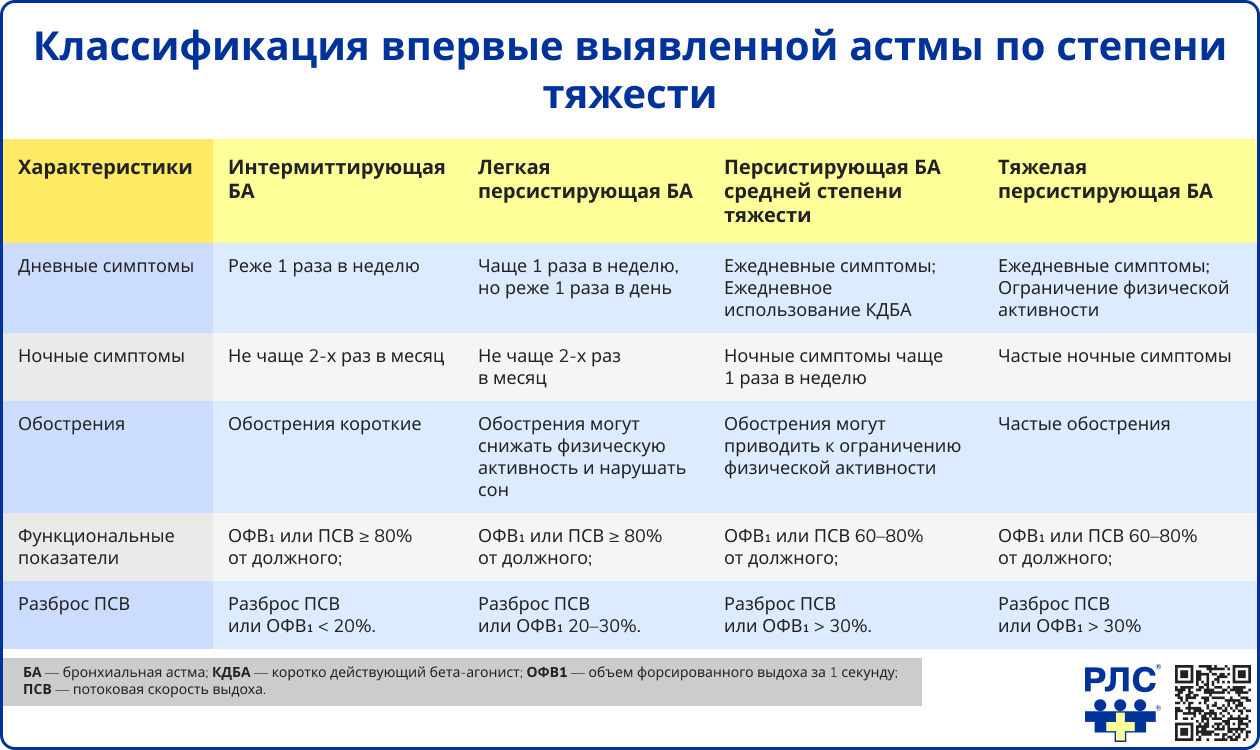
Определение степени тяжести заболевания у лиц, уже получающих лечение по поводу БА, проводится ретроспективно, на основании эффективности терапии и степени контроля симптомов [2].
_1.png)
Выделяют ряд фенотипов БА, подразделяющих заболевание на основании особенностей патогенеза у разных групп пациентов. Такое деление позволяет более эффективно использовать таргетную терапию и персонифицированные методы профилактики [2].
- Аллергическая БА: начинается, как правило, в детском возрасте и на фоне других аллергических заболеваний (атопический дерматит, аллергический ринит, пищевая аллергия), либо при отягощенном аллергоанамнезе у родственников. Аллергический фенотип характеризуется наличием эозинофильного воспаления и хорошим ответом на терапию ингаляционными кортикостероидами (ИКС).
- Неаллергическая БА: чаще встречается у взрослых и не связана с наличием сопутствующей аллергопатологии. Воспаление ДП при этом типе может быть эозинофильным, нейтрофильным, смешанным или малогранулоцитарным, в зависимости от чего ряд пациентов может не отвечать терапию ИКС.
- БА с поздним дебютом: развивается во взрослом возрасте, как правило, у женщин и отличается относительной резистентностью к терапии кортикостероидами.
- БА с фиксированной обструкцией ДП: этот фенотип развивается у лиц с длительно текущей астмой в анамнезе, вероятно, из-за ремоделирования стенки бронхов.
- БА у пациентов с ожирением: сочетание у пациента БА и ожирения нередко ассоциировано с более выраженными респираторными симптомами, которые не связаны с наличием эозинофильного воспаления.
Также отдельно выделяют трудную для лечения БА – форму заболевания, которая не контролируется терапией 4 или 5 ступеней по GINA или требующую только такое лечение для обеспечения контроля симптомов и минимизации риска обострений. В ряде случаев эта форма астмы обусловлена модифицируемыми факторами (плохая приверженность пациента лечению, неправильная техника ингаляции, сопутствующие заболевания и т.д.). Если же при устранении этих факторов не удается достичь контроля над заболеванием, говорят о наличии у пациента тяжелой БА (ТБА).
Примеры формулировки диагноза:
Бронхиальная астма аллергическая форма, средней степени тяжести, контролируемое течение. Аллергический ринит круглогодичный, легкое течение. Сенсибилизация к аллергенам клещей домашней пыли.
Бронхиальная астма неаллергическая форма, тяжелое течение; обострение, тяжелое; астматический статус, компенсированная стадия. Ожирение II ст.
Этиология
Астма – гетерогенное заболевание, обусловленное как особенностями самого организма, так и внешними воздействиями. К предрасполагающим факторам развития БА относят [2]:
1. Внутренние факторы:
- генетическая предрасположенность к атопии и гиперреактивности дыхательных путей,
- пол (мужской для детского возраста и женский – для взрослых и подростков),
- ожирение.
2. Факторы окружающей среды:
- экспозиция аллергенов (особенно, бытовых и респираторных),
- вирусные инфекции,
- профессиональные вредности,
- аэрополлютанты (диоксиды серы и азота, продукты сгорания дизельного топлива, табачный дым и др.),
- особенности диеты: избыточное потребление продуктов высокой степени переработки, сниженное поступление антиоксидантов (в составе фруктов и овощей) и омега-3 полиненасыщенный жирной кислоты (в составе жирных сортов рыбы).
Патогенез
_1.png)
Источник: Russell R. J., Brightling C. Pathogenesis of asthma: implications for precision medicine //Clinical Science. – 2017. – Т. 131. – №. 14. – С. 1723-1735.
Т2-воспаление
T2-опосредованное эозинофильное воспаление, обусловленное поляризацией Т-хелперов 2-го типа (Th2) под действием транскрипционного фактора GATA3, является доминирующим воспалительным профилем во всем спектре иммунопатогенеза астмы. Помимо эозинофилии крови и тканей, у таких пациентов также отмечается высокий уровень Т2-цитокинов (ИЛ-4, ИЛ-5 и ИЛ-13) [3, 4], которые играют важную роль в регуляции эозинофильного воспаления.
Т2- воспаление чаще всего ассоциируется с атопией, а аллергическая астма встречается в большинстве случаев астмы у детей и примерно в половине у взрослых. Отличительной чертой атопических и аллергических заболеваний является повышенный уровень IgE в сыворотке крови, однако это повышение не является хорошим прогностическим фактором развития у пациента астмы в дальнейшем и маркером преобладания Т2-компонента в структуре БА при ее наличии [5]. Более надежным маркером Т2-опосредованного заболевания служит эозинофилия мокроты [6], однако воспалительный профиль в ряде случаев может меняться с течением времени [4]. Было выявлено, что у пациентов с персистирующим Т2-воспалением и значительной эозинофилией мокроты выше риск развития обострений и потери контроля над симптомами заболевания [7].
Как было отмечено выше, эозинофилы занимают центральное место в Т2-воспалении, и их функция регулируется при участии множества цитокинов и эффекторных клеток. Некоторые из них представляют из себя потенциальные терапевтические мишени:
- OX40 и его лиганд (OX40L), а также тимический стромальный лимфопоэтин (ТСЛП) являются ранними стимуляторами Т2-опосредованных воспалительных процессов. Они способствуют развитию как врожденного, так и адаптивного иммунного ответа, а активность ТСЛП и OX40L повышается в ответ на вдыхание аллергенов [8]. После воздействия аллергена ТСЛП, поступающий из эпителия ДП, непосредственно стимулирует активность тучных клеток и запускает созревание незрелых дендритных клеток (ДК). Зрелые ДК вырабатывают OX40L и мигрируют в лимфатические узлы, где стимулируют дифференцировку наивных CD4+ T-клеток в воспалительные Th2-клетки. Ингибирование OX40L потенциально может модифицировать течение бронхиальной астмы и предотвратить развитие заболевания в раннем возрасте за счет прерывания процесса сенсибилизации. Несмотря на то что при использовании анти-OX40L терапии у взрослых с установленной астмой снижается уровень IgE в сыворотке крови и эозинофилов в мокроте, аллерген-индуцированная реакция ДП не изменяется, предположительно из-за уже завершившегося процесса сенсибилизации [9].
- ТСЛП участвует как в процессе сенсибилизации, так и в персистировании Т2-воспаления, поэтому анти-ТСЛП моноклональные антитела представляются перспективными терапевтическими агентами, способными снижать уровень эозинофилов в крови и мокроте, уменьшать фракцию оксида азота в выдыхаемом воздухе (FeNO), а также улучшать показатели функции легких после воздействия аллергена [10].
- Эозинофилы развиваются в костном мозге из плюрипотентных стволовых CD34+ клеток-предшественников, которые дифференцируются в зрелые клетки под воздействием гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), ИЛ-3 (на ранних стадиях) и ИЛ-5 (на более поздних) [11]. Было показано, что CD34+ клетки с рецепторами для IL-3 и IL-5 присутствуют в большом количестве в костном мозге людей с астмой в ответ на воздействие аллергена [12], что свидетельствует об острофазовом ответе костного мозга на аллергенную экспозицию. Продолжающееся воздействие ИЛ-5 стимулирует выход зрелых эозинофилов из костного мозга в циркулирующую кровь. После активации, опосредованной ИЛ-3, ИЛ-5 и ГМ-КСФ, эозинофилы под воздействием ИЛ-4 и ИЛ-5 мигрируют в ткани [13]. Причем сначала происходит прикрепление клеток к сосудистому эндотелию и взаимодействие между интегринами на поверхности эозинофилов и рецепторами адгезии на поверхности сосудистого эндотелия (такими как P-селектин/лиганд-1 P-селектина гликопротеина (PSGL-1) и лиганд VCAM-1) [14]. Повышение экспрессии P-селектина и VCAM-1 также происходит под действием ИЛ-4 и ИЛ-13, что еще раз подчеркивает критическую роль цитокинов ИЛ-4, ИЛ-5 и ИЛ-13 на разных этапах развития Т2-воспаления [15]. После адгезии к сосудистому эндотелию эозинофилы рекрутируются в слизистую оболочку легких под влиянием эотаксинов (CCL11, CCL24 и CCL26) – специальных факторов миграции, взаимодействующих с рецептором CCR3 на поверхности клетки. В легочной ткани выживаемость эозинофилов продлевается благодаря ИЛ-5 и ГМ-КСФ, вырабатываемых на местном уровне [16].
- Сам эозинофил регулирует несколько аспектов воспалительного ответа при БА. Специфические основные белки, выделяемые эозинофилами в легочной ткани, вызывают повреждение бронхиального эпителия: эозинофильный катионный белок (ECP), эозинофильный нейротоксин (EDN), эозинофильная пероксидаза (EPO/EPX), основной белок (MBP). Вместе с базофилами, тучными клетками, макрофагами и миелоидными ДК эозинофилы также продуцируют цистеиниловые лейкотриены, провоцирующие бронхоконстрикцию, особенно у чувствительных к аспирину пациентов [16, 17].
- Была выявлена ассоциация простаноидного рецептора DP2, или CRTH2 (chemoattractant receptor-homologous molecule expressed on Th2 cells), агонистом которого является вырабатываемый активированными тучными клетками простагландин D2 (ПГD2), с аллергическими заболеваниями. У пациентов с аллергической астмой отмечались повышенные уровни DP2+ воспалительных клеток и ПГD2. Также были выявлены увеличение синтеза ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-13 и опосредованная стимуляция миграции и повышение выживаемости эозинофилов в ответ на активацию рецептора DP2 на Th2-клетках [18].
- При отсутствии аллергической сенсибилизации эозинофильное воспаление может возникать в ответ на повреждение эпителия вдыхаемыми загрязняющими веществами и микроорганизмами. Эпителиальные «алармины» ИЛ-25, ИЛ-33 и ТСЛП обычно высвобождаются в ответ на повреждение эпителия ДП, участвуют в ранних стадиях воспалительного процесса и способствуют развитию Т2-иммунного ответа даже при отсутствии сенсибилизации или атопии. Была выявлена связь между повышением экспрессия ИЛ-25 в тканях пациентов с БА и вирусными обострениями, особенно при присоединении риновирусной инфекции. ИЛ-25 также стимулирует усиление выработки ИЛ-4, ИЛ-5 и ИЛ-13 и развитие Т2-воспалительного процесса [19].
- ИЛ-33 высвобождается из некротизированного эпителия, вероятно, в ответ на повреждение аллергенами, а также микробами и аэрополлютантами. Цитокин связывается с рецептором ST2, присутствующим у широкого спектра эффекторных клеток, и выполняет ряд функций, в том числе стимулирует врожденные лимфоидные клетки 2-го типа (ВЛК2) и Th2-клетки к повышению секреции ИЛ-4, ИЛ-5 и ИЛ-13, способствуя тем самым адгезии и выживанию эозинофилов [20]. Связывание ИЛ-33/ST2 на тучных клетках, макрофагах и базофилах также повышает секрецию воспалительных цитокинов. Кроме того, ИЛ-33 способствует созреванию CD34+ клеток в тучные клетки и стимулирует CD34+ прогениторные клетки к секреции ИЛ-5, ИЛ-6, ИЛ-13, CXCL8, CCL1 и CCL17, что приводит к усилению аллергического ответа [20].
- Повышение экспрессии ТСЛП наблюдается не только при стимуляции аллергенами, но и в ответ на механическое повреждение эпителия, вирусную инфекцию и действие провоспалительных цитокинов. ТСЛП способствует развитию T2-ответа через взаимодействие с эпителиальными ДК, но, по-видимому, он также способствует выживанию и адгезии эозинофилов [21].
- Относительно недавно была идентифицирована группа врожденных лимфоидных клеток 2-го типа (ВЛК2), ассоциированных с неатопической эозинофильной астмой и считающихся ключевыми посредниками в выработке Т2-цитокинов и других медиаторов роста, воспаления и восстановления тканей. Например, ПГD2, вырабатываемый тучными клетками, взаимодействует с ВЛК2 через рецептор CRTH2, что приводит к выработке воспалительных цитокинов [22]. Однако специфическая роль этих клеток в развитии Т2-воспаления ещё уточняется.
Неэозинофильное воспаление
Основу патогенеза астмы составляют и другие воспалительные пути, не опосредованные эозинофилами – с преобладанием Т1- и Т17-воспалительного ответа, с нейтрофильным компонентом или без него [3, 4]. У ряда пациентов может происходить переключение между Т2- и Т17-воспалительными профилями, хотя опосредованное Тh2 и Th17 клетками воспаление редко возникает одновременно [23]. Пациенты с изолированным нейтрофильным воспалением дыхательных путей чаще имеют неатопическую астму с поздним дебютом и плохо отвечают на лечение ИКС [3], хотя клинические проявления могут значительно различаться. Подавление Т2-воспаления в случае смешанного воспалительного профиля БА в ряде случаев может привести к сдвигу в сторону Т1/17-реакций – например, в результате приема кортикостероидов [23]. Персистирующее нейтрофильное воспаление, с сопутствующим Т2-компонентом или без него, может быть важным фактором развития кортикостероид-резистентной астмы. Помимо ВЛК2, участвующих в Т2-воспалении, клетки-предшественники ВЛК могут дифференцироваться по альтернативному пути в ВЛК3 – важные регуляторы Т17-воспаления, продуцирующие ИЛ-17A, ИЛ-17F, ИЛ-22, ГМ-КСФ и фактор некроза опухоли (ФНО) [22]. Среди возможных предрасполагающих факторов развития нейтрофильного воспаления ДП – бактериальная колонизация, наличие которой объясняет недостаточную эффективность антинейтрофильных препаратов и предположение о некоторой эффективности антибиотикотерапии при БА с неэозинофильным воспалительным профилем. С другой стороны, такое нарушение функции нейтрофилов у больных астмой может привести к повышенной восприимчивости к инфекциям и, как следствие, обострению заболевания [24].
Были получены данные о том, что аллергическое воспаление повышает восприимчивость к Haemophilus influenzae и способствует переходу острой инфекции в хроническое состояние или колонизацию [25]. У колонизированных H. influenzae астматиков повышается уровень ИЛ-17 с последующим привлечением дополнительных нейтрофилов в ДП. У таких пациентов терапия кортикостероидами еще больше увеличивает бактериальную нагрузку, что позволяет предположить, что традиционная схема лечения в ряде случаев может ухудшить ситуацию: нейтрофилы в изобилии присутствуют в дыхательных путях, но не функционируют должным образом [25]. Применение азитромицина в низкой дозе в течение 6 месяцев снижает частоту обострений только у лиц с неэозинофильным воспалением. Возможно, это говорит о том, что бактериальная колонизация у пациентов с T1/Т17-воспалительным профилем – существенный фактор, определяющим течение заболевания и риск обострений. Однако неясно, связано ли такое действие препарата с антибактериальными или противовоспалительными свойствами макролидов [26].
Бронхиальная гиперреактивность
Бронхиальная гиперреактивность (БГР) – это повышенная или дисфункциональная сократимость гладкой мускулатуры (ГМ) ДП, проявляющаяся в ответ на воздействие ряда прямых или косвенных стимулов и усиливающаяся при наличии как Т2-, так и не-Т2-воспаления. Это явление наблюдается даже у пациентов без явных признаков эозинофильного или неэозинофильного воспаления (например, с малогранулоцитарным воспалительным профилем мокроты, т.е. с более легкими формами заболевания и менее частыми обострениями). Таким образом, БГР может быть характерна для любого пациента с астмой, независимо от основного воспалительного профиля.
При БА наблюдается повышенная инфильтрация ГМ тучными клетками, что не характерно, например, для пациентов с эозинофильным бронхитом, при котором БГР отсутствует [27]. Степень инфильтрации также коррелирует с реактивностью бронхов, определяемой с помощью метахолиновой пробы. Тучные клетки в ГМ ДП играют специфическую роль в формировании гиперреактивности за счет выделения медиаторов (гистамина, ПГD2 и цистеиниловые лейкотриены), которые непосредственно вызывают сокращение ГМ [27]. Эти же тучные клетки также выделяют цитокины ИЛ-4 и ИЛ-13 [28].
Развитие и выживание тучных клеток зависит от фактора стволовых клеток и его рецептора KIT. Лечение ингибитором KIT иматинибом снижает БГР, количество тучных клеток и уровень триптазы (маркера активации тучных клеток) у пациентов с ТБА, что еще раз подтверждает связь между активностью тучных клеток и гиперреактивностью дыхательных путей [29]. Однако побочные эффекты иматиниба ограничивают его потенциал в качестве средства лечения астмы.
Ремоделирование дыхательных путей
Ремоделирование включает в себя структурные изменения дыхательных путей. К ним относятся:
- нарушение структуры эпителия,
- гиперплазия слизистых желез,
- утолщение подэпителиального коллагенового слоя,
- повышенное отложение подслизистого матрикса,
- гипертрофия и гиперплазия ГМ,
- инфильтрация гладкомышечного слоя тучными клетками и их дегрануляция [30].
При компьютерной томографии диагностируется утолщение стенок бронхов и бронхоэктазы, которые часто встречаются в популяции больных ТБА.
Биоптаты бронхов, взятые у пациентов с БА разной степени тяжести и у здоровых лиц, показывают, что степень эпителиальной гиперплазии и метаплазии коррелирует с тяжестью заболевания [18]. Изменения структуры и целостности эпителиального барьера приводят к цилиарной дисфункции – нарушению паттерна биения и снижению количества нормально функционирующих ресничек [31]. Дисфункция ресничек приводит к нарушению отхождения мокроты и образованию слизистых пробок, что является характерной чертой ТБА и часто встречается при обострениях астмы с летальным исходом. Повреждение эпителия также приводит к снижению барьерной функции с последующим увеличением восприимчивости к вдыхаемым патогенам, аллергенам и аэрополлютантам, при этом запускаются воспалительные каскады.
Динамические механические нагрузки на легкие, в частности на эпителий ДП, такие как дыхание (особенно глубокий вдох), кашель и бронхоконстрикция, могут вызывать значительный воспалительный стресс независимо от эозинофильного и нейтрофильного воспалительных каскадов. Механическая нагрузка и сжимающее напряжение in vitro подавляют восстановление эпителия в ответ на повреждение, увеличивают высвобождение профибротических цитокинов (трансформирующий фактор роста-β2 и эндотелин), снижают синтез простагландина E2, повышают продукцию активных форм кислорода и приводят к окислительному стрессу, что в итоге усугубляет ремоделирование ДП [32].
Клиническая картина
К характерным признакам заболевания относятся [1, 2]:
- сухие свистящие хрипы,
- одышка,
- кашель (особенно характерен для обострений БА у детей),
- чувство заложенности в груди.
Усиление симптомов наблюдается в ночное время или рано утром и может провоцироваться респираторными инфекциями, физической нагрузкой, воздействием аллергенов или неспецифических ирритантов.
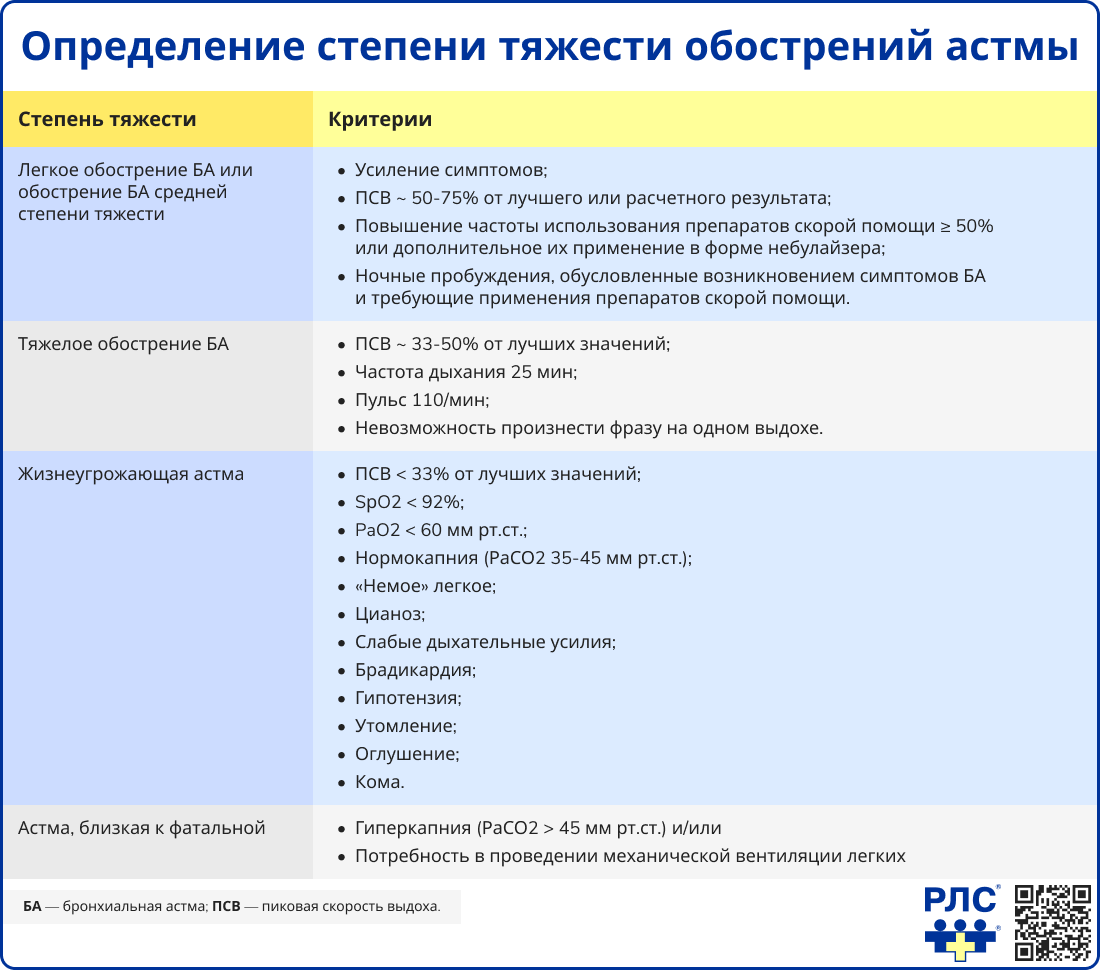
Диагностика
Диагноз ставят на основании клинической картины, результатов функциональных тестов и лабораторных исследований, а также при исключении других патологий.
Сбор анамнеза и физикальное обследование
У пациента уточняют наличие повторяющихся эпизодов затрудненного, свистящего дыхания или приступов кашля, условия их возникновения (физическая нагрузка, связь с респираторными заболеваниями, периодом пыления определенных растений или контактом с животными). Характерные симптомы у детей младше 2 лет – шумное дыхание, связанная с кашлем рвота, втяжение уступчивых мест грудной клетки, а также трудности с кормлением (вялое сосание, стонущие звуки). У ряда пациентов и их родственников могут быть атопические заболевания в анамнезе [2].
При аускультации могут выслушиваться свистящие хрипы, в ряде случаев – только во время форсированного выдоха.
Лабораторные исследования
- Общий клинический анализ крови
Используется для оценки эозинофильного воспаления, в том числе, в динамике.
- Определение IgE
Уровень общего иммуноглобулина Е (IgE) исследуется для определения наличия аллергического воспаления и оценки фенотипа астмы, а также для оценки целесообразности проведения терапии анти-IgE моноклональными антителами (омализумаб).
Уровни специфических IgE к конкретным аллергенам определяются для выявления потенциального триггера приступов заболевания. Альтернатива этому методу – постановка кожных проб с экстрактами аллергенов [33].
Инструментальные исследования
- Спирометрия
Спирометрия используется у пациентов с подозрением на БА для выявления и оценки обструкции ДП, а также для анализа эффективности терапии не позже чем через 3 месяца от ее начала.
- Бронходилатационный тест
Бронходилатационный тест проводится для определения степени обратимости обструкции ДП и считается положительным, если изменение значения объема форсированного выдоха за 1 секунду (ОФВ1) после приема бронходилататора составляет ≥12% и ≥200 мл (для детей – только ≥12%) [2].
- Бронхопровокационные тесты
Бронхопровокационные тесты используются для выявления БГР у пациентов с нормальными результатами спирометрии и отрицательным бронходилатационным тестом. В провокационном тесте с метахолином оценивается влияние ингаляций повышающихся концентраций бронхоконстриктора на ОФВ1 и определяется провокационная концентрация метахолина, вызывающая 20% падение показателя ОФВ1 (ПК20).
При подозрении на «астму физического усилия» проводится провокационный тест с физической нагрузкой. Положительный ответ – снижение ОФВ1 ≥10% [1, 2].
- Пикфлуометрия
Метод пикфлоуметрии применяется для подтверждения диагноза БА при отсутствии возможности проведения спирометрии, а также для мониторинга состояния функции легких уже после назначения терапии. При наличии у пациента типичных респираторных симптомов диагноз подтверждается при обнаружении повышенной средней суточной вариабельности пиковой скорости выдоха (ПСВ): >10% у взрослых и >13% у детей [2].
- Компьютерная бронхофонография
Компьютерная бронхофонография используется для диагностики БА у детей до 5 лет.
Другие исследования
- Уровень оксида азота в выдыхаемом воздухе (FeNO) может быть использован для обнаружения и оценки выраженности эозинофильного воспаления ДП, однако не применяется рутинно [1].
- Уровень эозинофилов в мокроте также является дополнительным маркером эозинофильного воспаления ДП.
Алгоритм диагностики
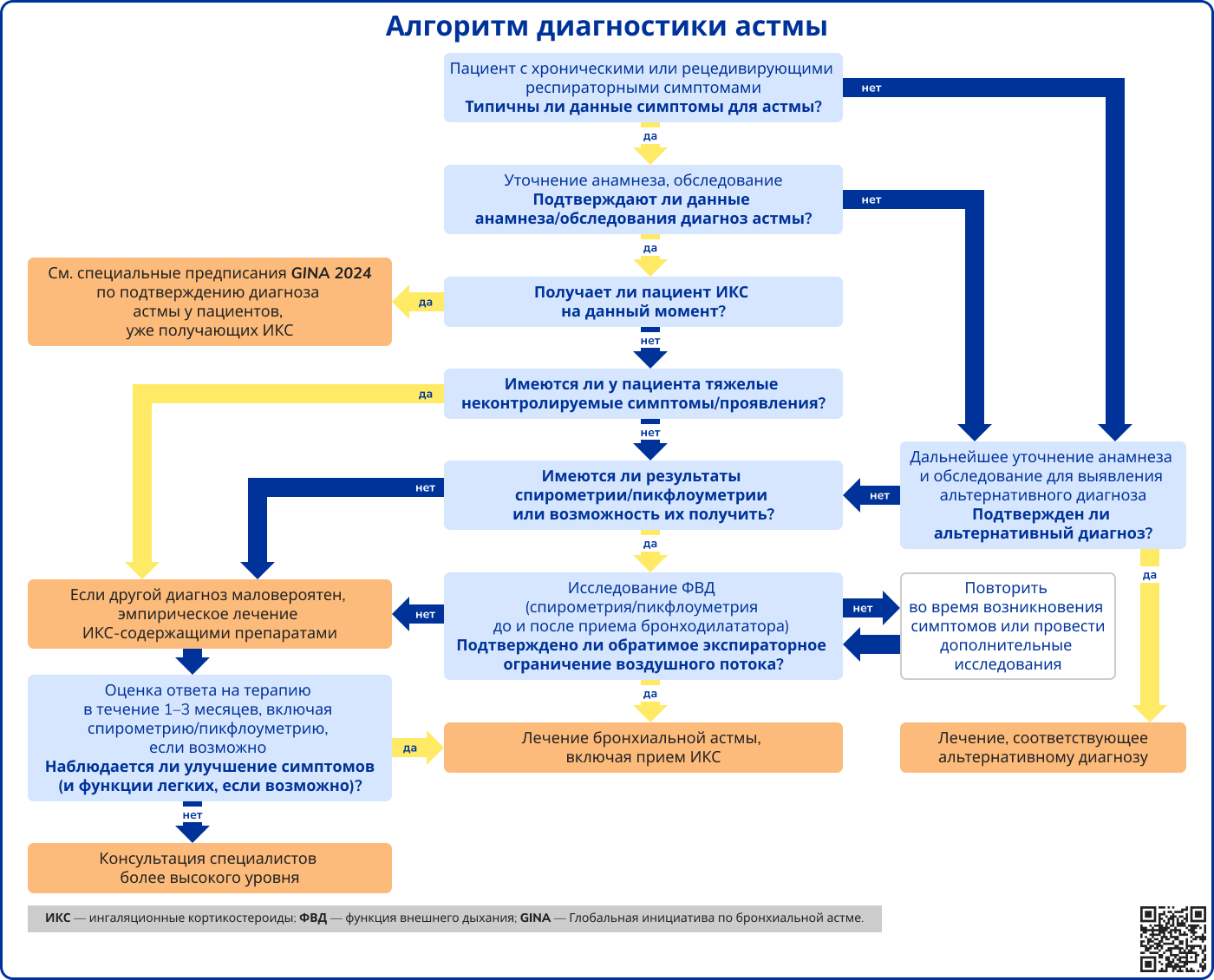
Источник: Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2024. Обновлено: май 2024. Ссылка на ресурс: https://ginasthma.org/wp-content/uploads/2024/05/GINA-2024-Strategy-Report-24_05_22_WMS.pdf
Лечение
Терапия БА преследует следующие цели [1, 2]:
- Достижение и поддержание длительного контроля симптомов;
- Снижение риска обострений, развития фиксированной обструкции ДП и развития побочных эффектов терапии.
Подходы к лечению
В настоящее время применяется ступенчатый подход к лечению заболевания, основанный на рекомендациях Глобальной инициативы по бронхиальной астме (Global Initiative for Asthma, GINA).
_1.png)
Источник: Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2024. Обновлено: май 2024. Ссылка на ресурс: https://ginasthma.org/wp-content/uploads/2024/05/GINA-2024-Strategy-Report-24_05_22_WMS.pdf
_1.png)
Источник: Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2024. Обновлено: май 2024. Ссылка на ресурс: https://ginasthma.org/wp-content/uploads/2024/05/GINA-2024-Strategy-Report-24_05_22_WMS.pdf
Основные группы лекарственных препаратов
- Ингаляционные кортикостероиды (ИКС) – используются на всех ступенях терапии и являются основой лечения заболевания, особенно при наличии Т2-воспаления.
- Длительно действующие β2-агонисты (ДДБА) – могут применяться с первых ступеней лечения, но только в комбинации с ИКС [1]. Не используются у детей младше 6 лет.
- Коротко действующие β2-агонисты (КДБА) – используются совместно с ИКС для купирования симптомов при легких формах заболевания в случае, если принято решение об отсутствии целесообразности постоянного приема ИКС [1].
- Антагонисты лейкотриеновых рецепторов – используются у пациентов с сочетанием БА и аллергического ринита, при вирус индуцированной БА и астме физического усилия.
- Генно-инженерные биологические препараты – препараты для лечения тяжелых форм заболевания, представляющие собой моноклональные антитела к определенным молекулам-мишеням: анти-IgE (омализумаб), анти-ИЛ5/5R (меполизумаб, реслизумаб, бенрализумаб), анти-ИЛ4Rα (дупилумаб), анти-ТСЛП (тезепелумаб); выбор препарата осуществляется на основании фенотипа заболевания у конкретного пациента.
- Системные кортикостероиды – наименее желательный вариант терапии тяжелых форм БА. Препараты используются в минимально возможной дозе.
У лиц старше 5 лет возможно проведение аллерген-специфической иммунотерапии – при наличии аллергической БА легкой и средней степени тяжести, особенно при ассоциации с аллергическим риноконъюнктивитом, но только при условии хорошего контроля астмы [2].
_1.png)
Список литературы
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2024. Обновлено: май 2024. Ссылка на ресурс: https://ginasthma.org/wp-content/uploads/2024/05/GINA-2024-Strategy-Report-24_05_22_WMS.pdf
- Клинические рекомендации Российского респираторного общества, Российской ассоциации аллергологов и клинических иммунологов, Союза педиатров России «Бронхиальная астма», М.: 2021
- Green R. H. et al. Analysis of induced sputum in adults with asthma: identification of subgroup with isolated sputum neutrophilia and poor response to inhaled corticosteroids //Thorax. – 2002. – Т. 57. – №. 10. – С. 875-879.
- McGrath K. W. et al. A large subgroup of mild-to-moderate asthma is persistently noneosinophilic //American journal of respiratory and critical care medicine. – 2012. – Т. 185. – №. 6. – С. 612-619.
- Lambrecht B. N., Hammad H. The immunology of asthma //Nature immunology. – 2015. – Т. 16. – №. 1. – С. 45-56.
- Pizzichini E. et al. Indices of airway inflammation in induced sputum: reproducibility and validity of cell and fluid-phase measurements //American journal of respiratory and critical care medicine. – 1996. – Т. 154. – №. 2. – С. 308-317.
- Jatakanon A., Lim S. A. M., Barnes P. J. Changes in sputum eosinophils predict loss of asthma control //American journal of respiratory and critical care medicine. – 2000. – Т. 161. – №. 1. – С. 64-72.
- Kaur D., Brightling C. OX40/OX40 ligand interactions in T-cell regulation and asthma //Chest. – 2012. – Т. 141. – №. 2. – С. 494-499.
- Gauvreau G. M. et al. OX 40L blockade and allergen‐induced airway responses in subjects with mild asthma //Clinical & Experimental Allergy. – 2014. – Т. 44. – №. 1. – С. 29-37.
- Gauvreau G. M. et al. Effects of an anti-TSLP antibody on allergen-induced asthmatic responses //New England Journal of Medicine. – 2014. – Т. 370. – №. 22. – С. 2102-2110.
- Denburg J. A. The origins of basophils and eosinophils in allergic inflammation //Journal of allergy and clinical immunology. – 1998. – Т. 102. – №. 5. – С. S74-S76.
- Sehmi R. et al. Allergen-induced increases in IL-5 receptor alpha-subunit expression on bone marrow-derived CD34+ cells from asthmatic subjects. A novel marker of progenitor cell commitment towards eosinophilic differentiation //The Journal of clinical investigation. – 1997. – Т. 100. – №. 10. – С. 2466-2475.
- Luijk B. et al. Gradual increase in priming of human eosinophils during extravasation from peripheral blood to the airways in response to allergen challenge //Journal of allergy and clinical immunology. – 2005. – Т. 115. – №. 5. – С. 997-1003.
- Symon F. A. et al. Functional and structural characterization of the eosinophil P-selectin ligand //Journal of immunology (Baltimore, Md.: 1950). – 1996. – Т. 157. – №. 4. – С. 1711-1719.
- George L., Brightling C. E. Eosinophilic airway inflammation: role in asthma and chronic obstructive pulmonary disease //Therapeutic advances in chronic disease. – 2016. – Т. 7. – №. 1. – С. 34-51.
- Brightling C. E. Eosinophils, bronchitis and asthma: pathogenesis of cough and airflow obstruction //Pulmonary pharmacology & therapeutics. – 2011. – Т. 24. – №. 3. – С. 324-327.
- Laidlaw T. M., Boyce J. A. Cysteinyl leukotriene receptors, old and new; implications for asthma //Clinical & Experimental Allergy. – 2012. – Т. 42. – №. 9. – С. 1313-1320.
- Stinson S. E., Amrani Y., Brightling C. E. D prostanoid receptor 2 (chemoattractant receptor–homologous molecule expressed on TH2 cells) protein expression in asthmatic patients and its effects on bronchial epithelial cells //Journal of Allergy and Clinical Immunology. – 2015. – Т. 135. – №. 2. – С. 395-406. e7.
- Beale J. et al. Rhinovirus-induced IL-25 in asthma exacerbation drives type 2 immunity and allergic pulmonary inflammation //Science translational medicine. – 2014. – Т. 6. – №. 256. – С. 256ra134-256ra134.
- Lloyd C. M. IL-33 family members and asthma–bridging innate and adaptive immune responses //Current opinion in immunology. – 2010. – Т. 22. – №. 6. – С. 800-806.
- Mitchell P. D., O'Byrne P. M. Biologics and the lung: TSLP and other epithelial cell-derived cytokines in asthma //Pharmacology & therapeutics. – 2017. – Т. 169. – С. 104-112.
- Artis D., Spits H. The biology of innate lymphoid cells //Nature. – 2015. – Т. 517. – №. 7534. – С. 293-301.
- Choy D. F. et al. TH2 and TH17 inflammatory pathways are reciprocally regulated in asthma //Science translational medicine. – 2015. – Т. 7. – №. 301. – С. 301ra129-301ra129.
- Baines K. J. et al. Immune responses of airway neutrophils are impaired in asthma //Experimental lung research. – 2009. – Т. 35. – №. 7. – С. 554-569.
- Essilfie A. T. et al. Combined Haemophilus influenzae respiratory infection and allergic airways disease drives chronic infection and features of neutrophilic asthma //Thorax. – 2012. – Т. 67. – №. 7. – С. 588-599.
- Brusselle G. G. et al. Azithromycin for prevention of exacerbations in severe asthma (AZISAST): a multicentre randomised double-blind placebo-controlled trial //Thorax. – 2013. – Т. 68. – №. 4. – С. 322-329.
- Brightling C. E. et al. Mast-cell infiltration of airway smooth muscle in asthma //New England Journal of Medicine. – 2002. – Т. 346. – №. 22. – С. 1699-1705.
- Brightling C. E. et al. Interleukin‐4 and‐13 expression is co‐localized to mast cells within the airway smooth muscle in asthma //Clinical & Experimental Allergy. – 2003. – Т. 33. – №. 12. – С. 1711-1716.
- Cahill K. N. et al. KIT inhibition by imatinib in patients with severe refractory asthma //New England Journal of Medicine. – 2017. – Т. 376. – №. 20. – С. 1911-1920.
- Berair R., Brightling C. E. Asthma therapy and its effect on airway remodelling //Drugs. – 2014. – Т. 74. – С. 1345-1369.
- Thomas B. et al. Ciliary dysfunction and ultrastructural abnormalities are features of severe asthma //Journal of Allergy and Clinical Immunology. – 2010. – Т. 126. – №. 4. – С. 722-729. e2.
- Manuyakorn W. Airway remodelling in asthma: role for mechanical forces //Asia Pacific Allergy. – 2014. – Т. 4. – №. 1. – С. 19-24.
- Ahlstedt S., Murray C. S. In vitro diagnosis of allergy: how to interpret IgE antibody results in clinical practice //Primary Care Respiratory Journal. – 2006. – Т. 15. – №. 4. – С. 228-236.
Чтобы проверить свои знания материала, пройдите квиз. Кликните на картинку, чтобы начать.
Описание проверено экспертом
Статьи по теме Иммунология
- Аллергический ринит
- Пищевая аллергия
- Гиперчувствительный пневмонит
- Наследственный ангиоотек
- Крапивница
- Атопический дерматит
- Анафилаксия
- Мастоцитоз
- Эозинофильный эзофагит
- Узловатая почесуха
- Системная красная волчанка
Статьи по теме Оториноларингология и пульмонология
Болезни в статье:
- L20 Атопический дерматит
- J30.1 Аллергический ринит, вызванный пыльцой растений
- L27.2 Дерматит, вызванный съеденной пищей
Фармгруппы в статье:
- Глюкокортикостероиды
- Бета-адреномиметики
- Простагландины, тромбоксаны, лейкотриены, их аналоги и антагонисты
- Иммунодепрессанты
Оцените статью:
- Бронхиальная астма
- Астма физических усилий
- Бронхиальная астма легкого течения
- Бронхиальная астма с затруднением отхождения мокроты
- Гормонозависимая форма бронхиальной астмы
- Неаллергическая бронхиальная астма
- Бронхиальная астма тяжелого течения
- Приступ бронхиальной астмы
- Бронхиальная астма физических усилий
- Ночные приступы астмы
- Астматические состояния
- Гиперсекреторная астма
- Купирование приступов удушья при бронхиальной астме
- Ночная астма
- Обострение бронхиальной астмы
- Эндогенные формы астмы
- Кашель при бронхиальной астме
- БА
- БА легкого течения
- БА с затруднением отхождения мокроты
- Гормонозависимая форма БА
- Неаллергическая БА
- БА тяжелого течения
- БА физических напряжений
- Кашель при БА
- Купирование приступов удушья при БА
- Обострение БА
- Приступ БА
Причины, симптомы и лечение тревожного расстройства
Тревога помогает человеку адаптироваться в условиях возможной опасности и быть более осторожным. Но иногда может привести к дистрессу и запустить процесс дезадаптации.
Опубликовано на сайте: 27.06.23 | Обновлено на сайте: 27.06.23
Иглоукалывание под микроскопом доказательной медицины
Узнайте, при каких заболеваниях акупунктура действительно помогает, а где ее эффект не превышает плацебо.
Опубликовано на сайте: 17.11.25 | Обновлено на сайте: 17.11.25
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
бронхиальная астма
бронхоспазм
аспириновая триада
Тяжелые формы бронхиальной астмы, бронхиальная астма, острый астматический приступ, пациенты с бронхиальной астмой, при бронхиальной астме, бронхиальная астма (если в анамнезе отмечалась повышенная чувствительность к дисульфиту), давняя бронхиальная астма, тяжелая неконтролируемая бронхиальная астма, острый приступ бронхиальной астмы, Детский возраст до 6 лет у пациентов с атопической БА, приступ бронхиальной астмы, астма, Бронхиальная астма, индуцированная приемом салицилатов и других НПВП, бронхиальной астмы, бронхиальная астма в стадии обострения, «аспириновая» астма (провоцируемая приемом АСК или др. НПВС), «аспириновая» астма, бронхиальной астмой, Больным бронхиальной астмой, бронхиальная астм в стадии обострения, бронхиальной астме, НПВП-индуцированная бронхиальная астма, бронхиальная астма, провоцируемая приемом ацетилсалициловая кислота или других НПВП, астмой, тяжелая бронхиальная астма, бронхиальная астма, индуцированная приемом ацетилсалициловой кислоты, бронхиальная астма, индуцированная приемом других нестероидных противовоспалительных средств, бронхиальная астма, индуцированная приемом салицилатов, «Аспириновая астма», приступы бронхиальной астмы, бронхиальная астма, вызванная приемом ацетилсалициловой кислоты, анальгетическая бронхиальная астма, астма, индуцированная приемом ацетилсалициловой кислоты, полное сочетание бронхиальной астмы, обострение бронхиальной астмы, сочетание бронхиальной астмы, Бронхиальная астма среднетяжелого течения, тяжелой бронхиальной астме, атопической бронхиальной астмой, «аспириновая бронхиальная астма», Бронхиальная астма, индуцированная приемом других НПВП, неполное сочетание бронхиальной астмы, бронхиальная астма (БА), бронхиальная астма, индуцированная нестероидными противовоспалительными препаратами, бронхиальную астму, бронхиальная астма (с затруднением отхождения мокроты), сочетание бронхиальной астмы,, Полное сочетание бронхиальной астмы,, неполное сочетание бронхиальной астмы,, бронхиальная астма, спровоцированная приемом ацетилсалициловой кислоты, бронхиальная астма, спровоцированная приемом салицилатов, Симптомы бронхиальной астмы, Тяжелая бронхиальная астма, плохо контролируемая фармакологическими препаратами (объем форсированного выхода за 1 с менее 70 % после проведения адекватной фармакотерапии), Тяжелая бронхиальная астма, плохо контролируемая фармакологическими препаратами (объем форсированного выхода за 1 сек менее 70 % после проведения адекватной фармакотерапии), Тяжелая бронхиальная астма, плохо контролируемая фармакологическими препаратами (объем форсированного выдоха за 1 сек менее 70 % после проведения адекватной фармакотерапии), тяжелая бронхиальная астма (объем форсированного выдоха за первую секунду (ОФВ)-менее 70 % от должного значения после проведенной адекватной фармакотерапии), Тяжелое обострение бронхиальной астмы за последние 3 месяца, неконтролируемая бронхиальная астма (ОФВ1 у детей-менее 80 % от должного значения после проведенной адекватной фармакотерапии), неконтролируемая бронхиальная астма (объем форсированного выдоха менее 70 %), тяжелая бронхиальная астма (объем форсированного выдоха менее 70 %), Тяжелая бронхиальная астма, плохо контролируемая фармакологическими препаратами (объем форсированного выдоха за 1 с менее 70 % после проведения адекватной фармакотерапии), астматический синдром, бронхиальной астмой в активной фазе, астму, развитие приступов астмы при применении препаратов с аналогичным действием, бронхиальная астма, спровоцированная приемом других нестероидных противовоспалительных препаратов, аспириновая бронхиальная астма, Эпизод тяжелого обострения бронхиальной астмы за последние 3 месяца, тяжелое некомпенсированное течение бронхиальной астмы, тяжелой бронхиальной астмой, у пациентов с бронхиальной астмой, бронхиальную астму в стадии обострения, бронхиальная астма, индуцируемая приемом других нестероидных противовоспалительных препаратов (НПВП), бронхиальная астма, индуцируемая приемом салицилатов, синдром бронхиальной астмы, приступы бронхиальной астмы, которые усиливаются при приеме ацетилсалициловой кислоты и других НПВП, тяжелая форма бронхиальной астмы (БА), обострении тяжелой бронхиальной астмы, тяжелая бронхиальная астма (объем форсированного выдоха за первую секунду (ОФВ1) у взрослых-менее 70 % от должного значения после проведенной адекватной фармакотерапии), неконтролируемая бронхиальная астма с объемом форсированного выдоха менее 70 %, тяжелая бронхиальная астма с объемом форсированного выдоха менее 70 %, астматический бронхит, Бронхиальная астма, индуцированная приемом салицилатов и НПВП, Наблюдается бронхиальная астма, Неконтролируемая бронхиальная астма (объем форсированного выдоха за первую секунду (ОФВ)-менее 70 % от должного значения после проведенной адекватной фармакотерапии), неконтролируемая бронхиальная астма (объем форсированного выдоха за первую секунду (ОФВ1) у взрослых-менее 70 % от должного значения после проведенной адекватной фармакотерапии), Тяжелое обострение бронхиальной астмы в течение последних трех месяцев, тяжелая бронхиальная астма (ОФВ1 у детей-менее 80 % от должного значения после проведенной адекватной фармакотерапии), легкие формы бронхиальной астмы, нетяжелые формы бронхиальной астмы, бронхиальной астмой тяжелого течения, обострении бронхиальной астмы, бронхиальной астме в стадии обострения, Тяжелая форма бронхиальной астмы, не поддающаяся коррекции пероральными глюкокортикостероидами, обострения бронхиальной астмы спровоцированы применением ацетилсалициловой кислоты или других НПВП, бронхиальная астма, провоцируемая применением оцетилсалициловой кислоты или другими НПВП, бронхиальная астма, индуцированная ацетилсалициловой кислотой, тяжелая неконтролируемая бронхиальная астма при отсутствии специального реанимационного оборудования, умеренные формы бронхиальной астмы, симптомы бронхиальной астмы, которые возникают при приеме ацетилсалициловой кислоты и других НПВП, наличие бронхиальной астмы, Острый бронхоспазм, бронхоспазм, Заболевания дыхательных путей, сопровождающиеся бронхоспазмом, явления бронхоспазма, заболеваниях, сопровождающихся бронхоспазмом, бронхоспастический синдром, бронхоспазму, некупирующийся бронхоспазм, сопровождающиеся бронхоспазмом, развитие бронхоспазма при применении препаратов с аналогичным действием, приступе бронхоспазма, заболевания, сопровождающиеся бронхоспазмом, полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа или околоносовых пазух и непереносимости ацетилсалициловой кислоты и других НПВП (в том числе в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего поллиноза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других нестероидных противовоспалительных препаратов (в том числе в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других нестероидных противовоспалительных препаратов (в том числе в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух, и непереносимости ацетилсалициловой кислоты или других НПВП (в т. ч. в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза слизистой оболочки носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты и других нестероидных противовоспалительных препаратов (в т. ч. в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа или околоносовых пазух и непереносимость ацетилсалициловой кислоты и других НПВП, полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа или околоносовых пазух и непереносимости ацетилсалициловой кислоты и других противовоспалительных и противоревматических препаратов (в том числе в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух, и непереносимости ацетилсалициловой кислоты или других нестероидных противовоспалительных препаратов (НПВП) (в т. ч. в анамнезе), полное или неполное сочетание бронхиальной астмы, Полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух, и непереносимости ацетилсалициловой кислоты или других НПВП (в том числе в анамнезе), полное или неполное сочетание бронхиальной астмы, ангионевротического отека, крапивницы, острого ринита, рецидивирующего полипоза носа или околоносовых пазух и непереносимости ацетилсалициловой кислоты или других НПВП (в том числе в анамнезе), полное или неполное сочетание бронхиальной астмы, ангионевротического отека, крапивницы, острого ринита, рецидивирующего полипоза носа или околоносовых пазух и переносимости ацетилсалициловой кислоты или других НПВП (в том числе в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух, и непереносимости ацетилсалициловой кислоты или других нестероидных противовоспалительных препаратов (в том числе в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего поллиноза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других НПВП (в т. ч. в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других HПBП (в том числе в анамнезе), Полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух, и непереносимости ацетилсалициловой кислоты или других НПВП (в анамнезе), полное или неполное сочетание бронхиальной астмы, ангионевротического отека, крапивницы, острого ринита, рецидивирующего полипоза носа и околоносовых пазух, и непереносимости ацетилсалициловой кислоты или других НПВП (в т. ч. в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других нестероидных противовоспалительных препаратов (в т. ч. в анамнезе), полное и неполное сочетание бронхиальной астмы, рецидивирующего полипоза слизистой оболочки носа или околоносовых пазух и непереносимости ацетилсалициловой кислоты и других НПВП (в том числе в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза или околоносовых пазух и непереносимости ацетилсалициловой кислоты и других НПВП (в том числе в анамнезе), полным или неполным сочетанием бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других нестероидных противовоспалительных препаратов, полным или неполным сочетанием бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других нестероидных противовоспалительных препаратов (в т. ч. в анамнезе), полным или неполным сочетанием бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других нестероидных противовоспалительных препаратов (в анамнезе), полное или неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа, околоносовых пазух и непереносимость ацетилсалициловой кислоты и других НПВП, наличие аспириновой триады, аспириновая триада, полное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других НПВП, неполное сочетание бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других НПВП, полное сочетание бронхиальной астмы, хронического риносинусита, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других НПВП, полное сочетание синдрома непереносимости ацетилсалициловой кислоты, неполное сочетание бронхиальной астмы, хронического риносинусита, рецидивирующего полипоза носа и околоносовых пазух и непереносимости ацетилсалициловой кислоты или других НПВП,