D84.1 Дефект в системе комплемента, МКБ-10
Отредактировано: 05.07.2024
Наследственный ангиоотек
Определение и классификация
Наследственный ангиоотек (НАО) – это редкое, генетически детерминированное жизнеугрожающее заболевание, характеризующееся повторяющимися приступами ангионевротического отека без сопутствующих кожных проявлений (крапивница, сыпь) и зуда, с наиболее частым вовлечением кожи, слизистых оболочек верхних дыхательных путей (ВДП) и желудочно-кишечного тракта (ЖКТ). Несмотря на то, что отек купируется самостоятельно за 2-5 дней, поражение гортани может привести к асфиксии [1].
НАО относится к первичным иммунодефицитам без инфекционных проявлений [2].
НАО с дефицитом С1-ИНГ:
- НАО I типа – обусловлен снижением количества и функциональной активности С1-ингибитора (С1-ИНГ) в плазме (в 85% случаев НАО) [1].
- НАО II типа – обусловлен снижением функциональной активности С1-ИНГ на фоне нормальной или повышенной концентрации С1-ИНГ в крови (в 15% случаев НАО) [1].
НАО без дефицита С1-ИНГ (НАО-нС1-ИНГ; без патологии системы комплемента):
- НАО с мутацией в гене XII фактора свертывания крови (НАО-FXII);
- НАО с мутацией в гене плазминогена (НАО-PLG);
- НАО с мутацией в гене ангиопоэтина 1 (НАО-ANGPT1);
- НАО с мутацией в гене кининогена 1 (НАО-KNG1);
- НАО с неизвестной мутацией (UNK-НАО) – устанавливается при нормальном уровне С1-ИНГ и его функциональной активности в случае типичной клинической картины в сочетании с отягощенным семейным анамнезом [1].
Этиология и патогенез
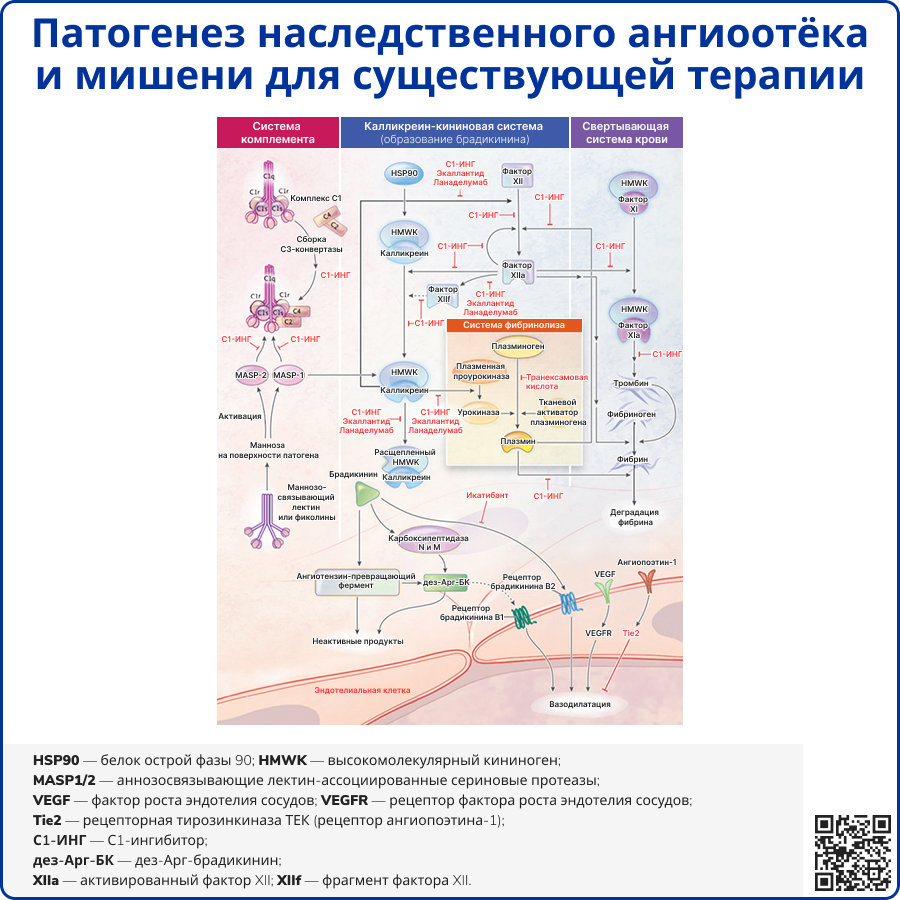
Источник: Busse P. J., Christiansen S. C. Hereditary Angioedema // N Engl J Med – 2020. – T. 382 – №. 12 – C.1136-1148.
Наиболее распространенные формы НАО возникают при дефиците или дисфункции С1-ИНГ, в основе которых лежат мутации в гене SERPING1 (Serpin Family G Member 1). К настоящему времени известно более 450 причинно-значимых мутаций. НАО наследуется по аутосомно-доминантному типу, поэтому у большинства пациентов есть члены семьи с этим заболеванием. Однако при НАО-C1-ИНГ в 20-25% случаев мутации возникают de novo, поэтому неотягощенный семейный анамнез не исключает диагноз [3, 4].
Ангиоотёк, возникающий при НАО из-за дефицита С1-ИНГ (НАО-С1-ИНГ), развивается в результате чрезмерной выработки брадикинина – медиатора, вызывающего выраженную вазодилатацию и повышающего проницаемость сосудистой стенки. При опосредованном брадикинином ангионевротическом отёке гистамин и другие медиаторы тучных клеток не принимают непосредственного участия, что объясняет отсутствие реакции на антигистаминные препараты и отличает эту форму ангиоотёка от опосредованной гистамином формы, которая наблюдается при аллергических реакциях и крапивнице [5].
Факторы, провоцирующие развитие отёка у пациентов с НАО [6]:
- механическое повреждение: травмы (длительное сдавление, ушибы), медицинские манипуляции (уколы, инвазивные методы обследования, оперативные вмешательства);
- острые инфекционные заболевания или декомпенсация сопутствующей патологии;
- менструация, беременность, лактация;
- приём эстрогенов;
- приём антагонистов рецепторов ангиотензина II, ингибиторов ангиотензин-превращающего фермента (зарубежом выделяют самостоятельную форму заболевания – ангионевротический отёк, индуцированный ингибиторами АПФ);
- эмоциональный стресс.
НАО с дефицитом или дисфункцией С1-ингибитора
- НАО I типа составляет 85% семейных случаев НАО-C1-ИНГ и характеризуется сниженным синтезом C1-ИНГ. При обследовании снижены как уровень этого белка в крови, так и его функциональная активность – показатели варьируют от полного отсутствия до <30% от нормы у большинства пациентов. Такое снижение более выражено, чем ожидается при сохранении одной неповрежденной аллели, так как заболевание почти всегда гетерозиготно. Предполагается, это связано с повышенным базовым катаболизмом или сниженной экспрессией продукта нормальной аллели [4,7].
- НАО II типа обусловлен наличием дисфункционального белка C1-ИНГ и встречается у 15% пораженных семей. При тестировании снижена функциональная активность C1-ИНГ при нормальной или повышенной концентрации белка в плазме крови. Последнее объясняется тем, что дефектный C1-ИНГ не способен образовывать комплексы с протеазами, что приводит к увеличению периода его полураспада в плазме [7].
С1-ИНГ – белок острой фазы и член суперсемейства ингибиторов сериновых протеаз (серпинов). Он ингибирует ряд этапов классического и лектинового путей активации системы комплемента, а также калликреин-кининовой и свертывающей (внутреннее звено) систем крови и системы фибринолиза [8-10]. C1-ИНГ ингибирует плазменные протеазы: C1r и C1s, маннозосвязывающие лектин-ассоциированные сериновые протеазы (MASP1 и MASP2), факторы свертывания XII (фактор Хагемана) и XI, тромбин, плазменный калликреин, плазмин и тканевой активатор плазминогена [11, 12].
Молекулярные процессы инициальной стадии ангиоотека до конца не изучены. Считается, что ведущий механизм – активация плазменного прекалликреина и фактора XII, вероятно, фосфолипидами, высвобождающимися из поврежденных клеток [13]. Белок теплового шока 90 (HSP90), образующийся во время клеточного стресса, способен усиливать активацию калликреин-кининовой системы. Активированный фактор XII (фактор XIIa) и калликреин катализируют расщепление высокомолекулярного кининогена (HMWK) с высвобождением брадикинина. В норме C1-ИНГ играет роль ограничителя выработки брадикинина, ингибируя калликреин и фактор XIIа [14,15]. Сообщалось, что плазменный прекалликреин способен медленно катализировать расщепление HMWK независимо от фактора XII, однако клиническая значимость этого факта неясна [16].
Дефицит или дисфункция C1-ИНГ приводит к снижению уровня С4-компонента системы комплемента, поскольку комплекс C1 обычно расщепляет C4-компонент при классическом пути, что усиливается при дефиците активности C1-ИНГ. Таким образом, низкий уровень C4 представляет из себя достоверный признак дефицита C1-ИНГ, хотя и не имеет прямого отношения к патогенезу НАО-C1-ИНГ [17].
Вышеописанные нарушения развиваются с самого рождения, поэтому дебют симптомов НАО, как правило, происходит в детском и молодом возрасте. Описана также приобретенная форма дефицита C1-ИНГ, которая проявляется у пожилых пациентов (>40 лет) без отягощенного по НАО семейного анамнеза, и в большинстве случаев связана с сопутствующими заболеваниями или образованием аутоантител против C1-ИНГ [18].
Клиническая картина
К основным проявлениям заболевания относятся [1]:
- периферические отеки,
- абдоминальные атаки,
- отёки, способные привести к асфиксии (потенциально фатальные отёки): отёк гортани и связочного аппарата, языка, нёбной занавески.
Периферические отеки встречаются у большинства пациентов, характеризуются рецидивирующим течением и не сопровождаются крапивницей. Кожа пораженных областей не гиперемирована, нормальной температуры. Отёки нарастают медленно (2-4 дня), могут сопровождаться ощущениями покалывания, жжения и локальной болезненностью. Наиболее частая локализация – верхние и нижние конечности.
Абдоминальные атаки встречаются у 80% пациентов. Могут проявляться как лёгким дискомфортом, так и имитировать клинику «острого живота» (острая боль с сопутствующей рвотой, расстройствами моторики ЖКТ (запор, диарея, метеоризм) и резкой слабостью). Во время приступа с помощью визуализирующих исследований (УЗИ, КТ) можно выявить отёк участка кишечника и наличие свободной жидкости в брюшной полости или полости малого таза.
Более редкие проявления НАО:
- отёк мозговых оболочек – интенсивные головные боли;
- отёк мочевого пузыря и уретры – дизурия, прерывистое мочеиспускание, олиго- или анурия;
- отёки мышц – локальное уплотнение;
- отёки суставов;
- боли или чувство сдавления в грудной клетке, не сопровождающееся изменениями на электрокардиограмме;
- боль в области почек;
- боль в области пищевода.
Также в ряде случаев наблюдают «предвестники» отёков в виде колебаний настроения, подавленности, слабости, парестезий, ощущения утолщения кожи, а также маргинальной эритемы – розово-красных высыпаний без зуда и шелушения, не возвышающихся над поверхностью кожи, проходящих бесследно в течение 2 суток. Маргинальная эритема может быть и самостоятельным проявлением заболевания [19].
Диагностика
Диагноз НАО устанавливается на основании анализа жалоб и клинической картины, физикального обследования, а также ряда лабораторных исследований [1].
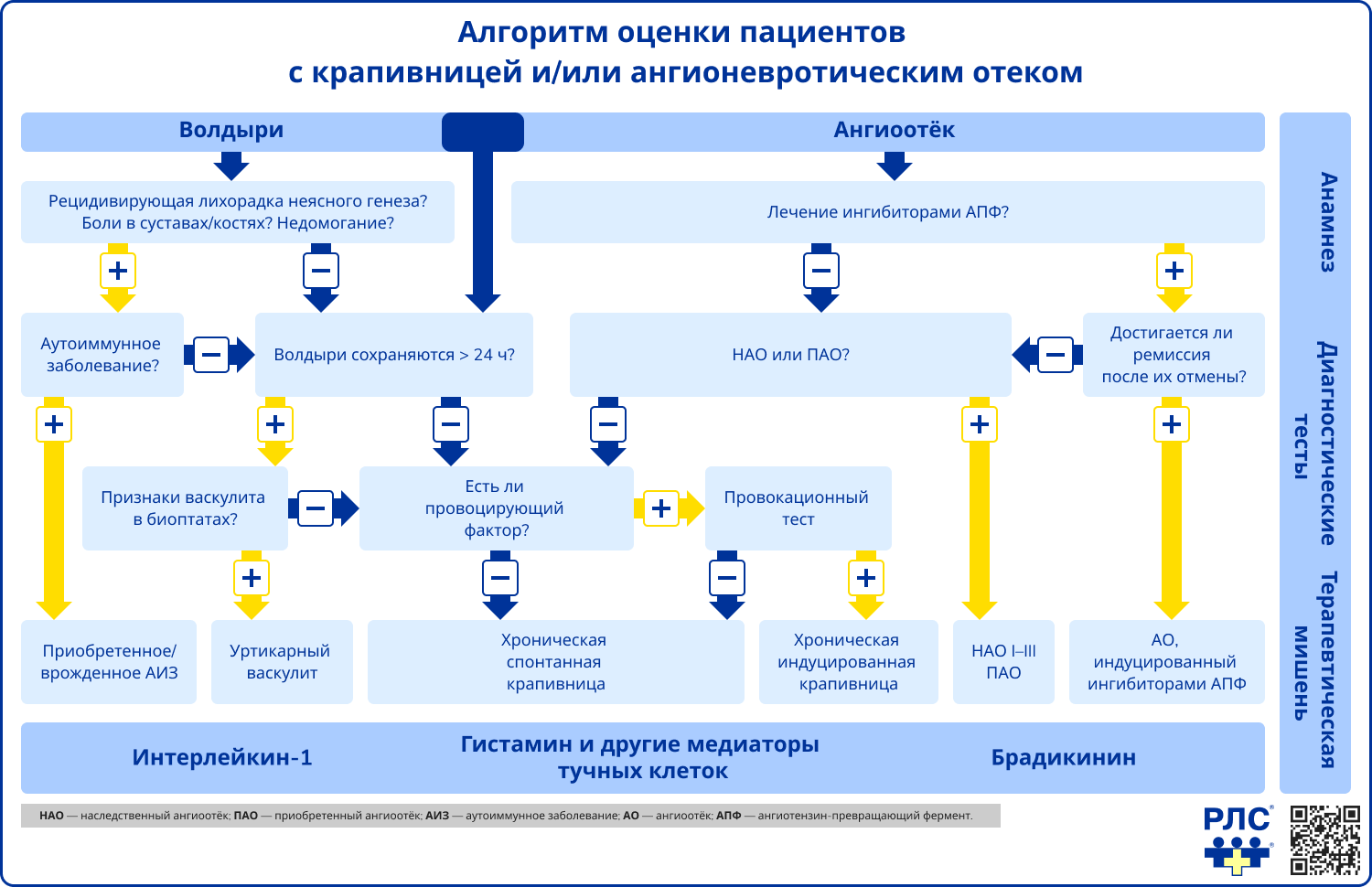
Источник: Zuberbier T., Aberer W., Asero R. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria // Allergy – 2018. – Т. 73 – № 7 – С. 1393-1414.
Анализ жалоб и физикальное обследование
- При наличии у пациента ангиоотёка на момент осмотра выявляют типичные признаки: отсутствие гиперемии, зуда, шелушения и ямки после надавливания.
- У пациентов с жалобами на нарушение дыхания и глотания, дисфонию оценивают звучность голоса и возможность глотания, а также проводят визуальное обследование ВДП для оценки их проходимости.
Лабораторные исследования
Пациентам с подозрением на НАО без отягощенного наследственного анамнеза рекомендовано проведение одного из двух исследований:
- Двукратное определение уровня и функциональной активности С1-ИНГ в крови;
- Однократное исследование уровня и функциональной активности С1-ИНГ в крови в сочетании с выявлением мутаций в гене SERPING1 на основании молекулярно-генетического тестирования.
Пациентам с проявлениями заболевания и отягощенным по НАО семейным анамнезом можно однократно измерить уровень и функциональную активность С1-ИНГ в крови или определить причинно-значимую мутацию в гене SERPING1, выявленную у пробанда.
У родственников первой линии пациента с НАО даже при отсутствии у них симптомов заболевания исследуют уровень и функциональную активность С1-ИНГ или проводят поиск причинно-значимой мутации в гене SERPING1 у пробанда.

Детям до 1 года с клиническими признаками НАО или с отягощенным семейным анамнезом проводят только молекулярно-генетическое тестирование для выявления мутаций в гене SERPING1.
У пациентов с подозрениями на НАО определение уровня С4-компонента комплемента используют только для скрининга [17].


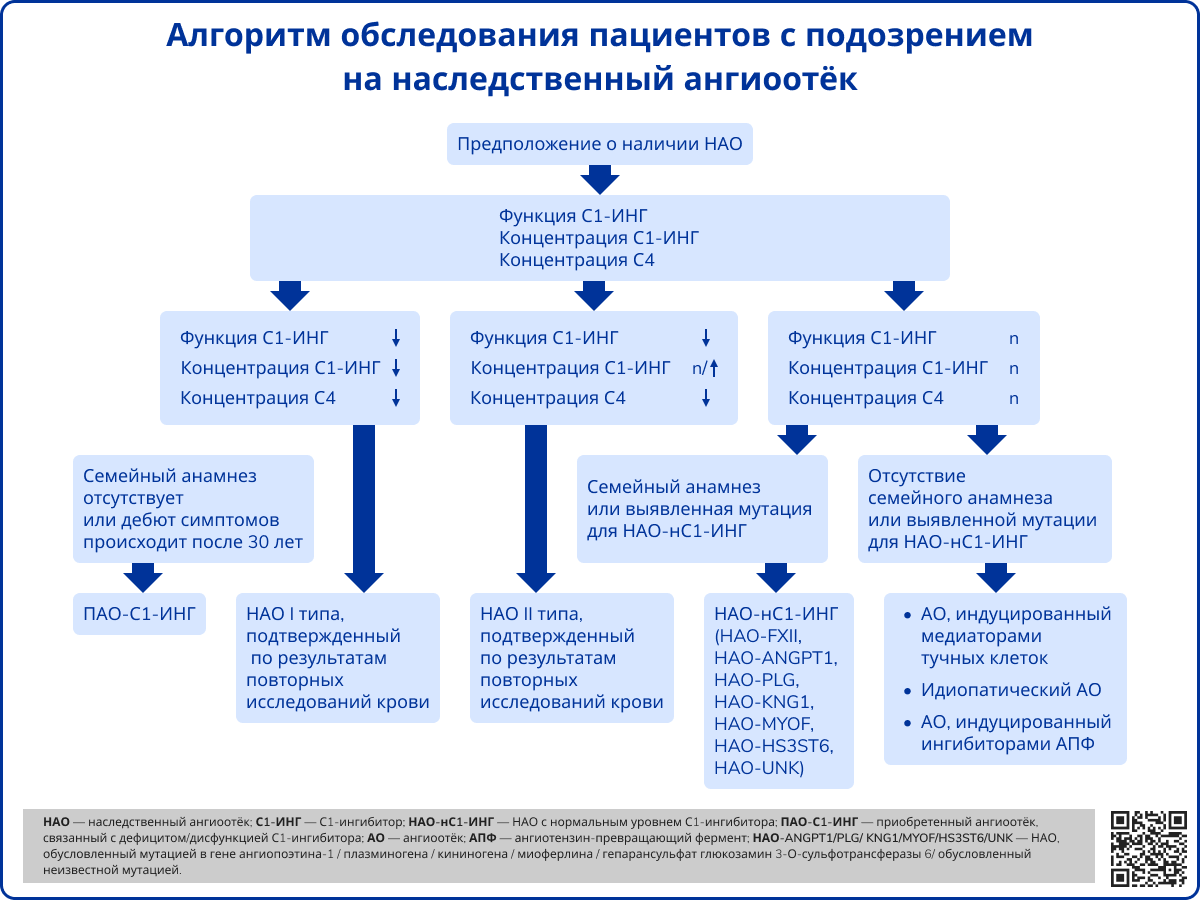
Источник: Maurer M., Magerl M., Betschel S. The international WAO/EAACI guideline for the management of hereditary angioedema-The 2021 revision and update // Allergy – 2022. – Т. 77 – № 7 – С. 1961-1990.
Инструментальные исследования
У пациентов с подозрением на НАО и выраженными болями в животе рекомендовано провести УЗИ или КТ для дифференциальной диагностики с заболеваниями, сопровождающимися клиникой острого живота [1].
Лечение
Выделяют три направления терапии НАО: купирование уже возникших отёков, краткосрочная профилактика перед медицинскими манипуляциями и долгосрочная профилактика при тяжелом течении заболевания или частых рецидивах [1, 20].

Купирование отёков
Для лечения потенциально фатальных отёков, тяжелых абдоминальных атак и периферических отеков, сопряженных с риском развития осложнений (например, отёк половых органов у мужчин) используются препараты [1]:
- Икатибант – высокоселективный антагонист брадикининовых рецепторов 2 типа;
- Ингибитор С1-эстеразы человека – средство заместительной терапии при НАО I и II типов;
- Экаллантид – рекомбинантный ингибитор плазменного калликреина (не зарегистрирован в РФ) [20];
- Свежезамороженная плазма – применяется только в условиях стационара при отсутствии иных терапевтических средств и не является эквивалентом патогенетической терапии.
Краткосрочная профилактика
При НАО проведение стоматологических, оперативных или диагностических вмешательств не противопоказано, однако рекомендуется проведение профилактических мероприятий для предотвращения развития ангиоотёка. Связанные с медицинскими манипуляциями отёки, как правило, возникают в течение 48 часов с момента проведения процедуры [20]. Для краткосрочной профилактики используются [1]:
- Ингибитор С1-эстеразы человека – вводится внутривенно в качестве премедикации перед проведением срочных и плановых оперативным вмешательств;
- Даназол – используется при отсутствии ингибитора С1-эстеразы. Прием начинают за 5-7 дней до планируемой манипуляции, при этом, если пациент получает препарат в качестве базисной терапии, то дозу увеличивают в 2 раза от исходной;
- Свежезамороженная плазма.
Долгосрочная профилактика
Для уменьшения частоты и выраженности атак заболевания и повышения качества жизни пациента применяют следующие препараты [1]:
- Даназол – используют у взрослых, в наименьшей эффективной дозе для снижения риска развития побочных эффектов; возможно применение off-label у детей, достигших V стадии половой зрелости по Таннеру, но только по жизненным показаниям (частые рецидивы, жизнеугрожающие локализации) и в минимальной эффективной дозе;
- Ингибитор С1-эстеразы человеческий – основной препарат для профилактики отёков у детей. Обладает наилучшим профилем безопасности и также разрешен к применению у беременных женщин и лиц старше 65 лет;
- Транексамовая кислота – в отличие от даназола имеет более высокий профиль безопасности, однако эффективна лишь у части пациентов;
- Прогестагены – назначаются женщинам 18-45 лет и требуют совместного ведения пациентки с гинекологом. Используются в виде монопрепаратов, так как приём эстрогенов, входящих в состав комбинированных оральных контрацептивов, может спровоцировать развитие ангиоотёка;
- Ланаделумаб – человеческое моноклональное антитело к калликреину. Одобрен для профилактики рецидивирующих приступов НАО у пациентов старше 12 лет [21];
- Беротралстат – синтетическая малая молекула, разработанная для ингибирования калликреина плазмы крови [20]. Препарат не зарегистрирован в РФ.
Дополнительные мероприятия
- Избегание факторов, провоцирующих ангиоотёк [22]:
- Травмы, особенно ятрогенные, в области лица и ВДП;
- Инфекции зубов и ВДП;
- Эстроген-содержащие препараты, ингибиторы АПФ и др.
- Готовность к возникновению острых приступов НАО [20]:
- Пациенту рекомендуют носить специальный браслет или ожерелье с указанием на наличие заболевания, а также письменный план экстренных мероприятий в виде карточки с указанием контактов лечащего врача для использования в отделении неотложной помощи;
- Пациенты с НАО должны иметь возможность самостоятельно вводить препарат для купирования приступа вне медицинского учреждения – для этого необходимо наличие препаратов в личном пользовании пациента и владение техникой их самостоятельного применения.
- Целесообразно проведение вакцинации против вируса гепатита В для предотвращения инфицирования пациента при переливании донорских компонентов крови [23].
Список литературы
- Союз педиатров России, Российская ассоциация аллергологов и клинических иммунологов (РААКИ), Национальная Ассоциация Экспертов в области Первичных Иммунодефицитов, Ассоциация медицинских генетиков. Клинические рекомендации "Наследственный ангиоотек". 2020.
- Picard C. et al. Primary immunodeficiency diseases: an update on the classification from the International Union of Immunological Societies Expert Committee for Primary Immunodeficiency 2015 //Journal of clinical immunology. – 2015. – Т. 35. – С. 696-726.
- Pappalardo E. et al. Frequent de novo mutations and exon deletions in the C1inhibitor gene of patients with angioedema //Journal of allergy and clinical immunology. – 2000. – Т. 106. – №. 6. – С. 1147-1154.
- Tosi M. Molecular genetics of C1 inhibitor //Immunobiology. – 1998. – Т. 199. – №. 2. – С. 358-365.
- Bork K. et al. Treatment of acute edema attacks in hereditary angioedema with a bradykinin receptor-2 antagonist (Icatibant) //Journal of Allergy and Clinical Immunology. – 2007. – Т. 119. – №. 6. – С. 1497-1503.
- Zotter Z. et al. The influence of trigger factors on hereditary angioedema due to C1-inhibitor deficiency //Orphanet journal of rare diseases. – 2014. – Т. 9. – С. 1-6.
- Prada A. E., Zahedi K., Davis III A. E. Regulation of C1 inhibitor synthesis //Immunobiology. – 1998. – Т. 199. – №. 2. – С. 377-388.
- Beinrohr L. et al. C1 inhibitor serpin domain structure reveals the likely mechanism of heparin potentiation and conformational disease //Journal of Biological Chemistry. – 2007. – Т. 282. – №. 29. – С. 21100-21109.
- Csuka D. et al. The role of the complement system in hereditary angioedema //Molecular Immunology. – 2017. – Т. 89. – С. 59-68.
- van Geffen M. et al. Alterations of coagulation and fibrinolysis in patients with angioedema due to C1-inhibitor deficiency //Clinical & Experimental Immunology. – 2012. – Т. 167. – №. 3. – С. 472-478.
- Longhurst H., Cicardi M. Hereditary angio-oedema //The Lancet. – 2012. – Т. 379. – №. 9814. – С. 474-481.
- Agostoni A. et al. Hereditary and acquired angioedema: problems and progress: proceedings of the third C1 esterase inhibitor deficiency workshop and beyond //Journal of Allergy and Clinical Immunology. – 2004. – Т. 114. – №. 3. – С. S51-S131.
- Cugno M. et al. Activation of factor XII and cleavage of high molecular weight kininogen during acute attacks in hereditary and acquired Cl-inhibitor deficiencies //Immunopharmacology. – 1996. – Т. 33. – №. 1-3. – С. 361-364.
- Joseph K., Tholanikunnel B. G., Kaplan A. P. Factor XII–independent cleavage of high-molecular-weight kininogen by prekallikrein and inhibition by C1 inhibitor //Journal of allergy and clinical immunology. – 2009. – Т. 124. – №. 1. – С. 143-149.
- Kaplan A. P., Joseph K. The bradykinin-forming cascade and its role in hereditary angioedema //Annals of Allergy, Asthma & Immunology. – 2010. – Т. 104. – №. 3. – С. 193-204.
- Joseph K., Tholanikunnel B. G., Kaplan A. P. Activation of the bradykinin-forming cascade on endothelial cells: a role for heat shock protein 90 //International immunopharmacology. – 2002. – Т. 2. – №. 13-14. – С. 1851-1859.
- Tarzi M. D. et al. An evaluation of tests used for the diagnosis and monitoring of C1 inhibitor deficiency: normal serum C4 does not exclude hereditary angio-oedema //Clinical & Experimental Immunology. – 2007. – Т. 149. – №. 3. – С. 513-516.
- Cicardi M. et al. Classification, diagnosis, and approach to treatment for angioedema: consensus report from the H ereditary A ngioedema I nternational W orking G roup //Allergy. – 2014. – Т. 69. – №. 5. – С. 602-616.
- Martinez-Saguer I., Farkas H. Erythema marginatum as an early symptom of hereditary angioedema: case report of 2 newborns //Pediatrics. – 2016. – Т. 137. – №. 2.
- Maurer M. et al. The international WAO/EAACI guideline for the management of hereditary angioedema–The 2021 revision and update //World Allergy Organization Journal. – 2022. – Т. 15. – №. 3. – С. 100627.
- Проскурина Е. В., Морозова Н. В., Кокушкин К. А. Опыт применения ланаделумаба для долгосрочной профилактики атак при наследственном ангиоотеке у пациентов Московской области // Российский аллергологический журнал. – 2024. – Т. 21. – №. 2.
- Cicardi M. et al. Evidence‐based recommendations for the therapeutic management of angioedema owing to hereditary C1 inhibitor deficiency: consensus report of an International Working Group //Allergy. – 2012. – Т. 67. – №. 2. – С. 147-157.
- Bowen T. et al. 2010 International consensus algorithm for the diagnosis, therapy and management of hereditary angioedema //Allergy, Asthma & Clinical Immunology. – 2010. – Т. 6. – С. 1-13.
Описание проверено экспертом
Статьи по теме Иммунология
- Аллергический ринит
- Пищевая аллергия
- Гиперчувствительный пневмонит
- Крапивница
- Атопический дерматит
- Анафилаксия
- Мастоцитоз
- Эозинофильный эзофагит
- Узловатая почесуха
- Бронхиальная астма
- Системная красная волчанка
Фармгруппы в статье:
- H1-антигистаминные средства
- Эстрогены, гестагены; их гомологи и антагонисты
- Антагонисты рецепторов ангиотензина II (AT1-подтип)
- Ингибиторы АПФ
Оцените статью:
- Наследственный ангионевротический отек
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
ангионевротический отек
наследственный ангионевротический отек
отек на фоне предшествующей терапии АРА II или ингибиторами АПФ, идиопатический ангионевротический отек, ангионевротический отек, в том числе связанный с предшествующим лечением ингибиторами АПФ, ангионевротический отек (на фоне применения ингибиторов АПФ, в том числе в анамнезе), ангионевротический отек на фоне применения ингибиторов АПФ, ангионевротический отек на фоне применения других ингибиторов АПФ, ангионевротический отек на фоне применения других ингибиторов АПФ, в том числе и в анамнезе, ангионевротический отек, ангионевротическим отеком, отек Квинке, связанный с применением ингибиторов АПФ, Отек Квинке, появление ангионевротического отека в случаях применения препаратов с аналогичным действием, появление ангионевротического отека при применении препаратов с аналогичным действием, лекарственный ангионевротический отек, ангионевротического отека, идиопатический ангионевротический отек Квинке, ангионевротический отек гортани, лекарственно-индуцированный ангионевротический отек, отеком Квинке, наследственный отек Квинке, наследственный ангионевротический отек, ангионевротический отек наследственный, наследственный отек, наследственными формами ангионевротического отека, наследственным ангионевротическим отеком, Наследственный ангионевротический отек Квинке,


