T78.0 Анафилактический шок, вызванный патологической реакцией на пищу, МКБ-10
Отредактировано: 30.01.2025
Анафилаксия
Определение
Анафилаксия – тяжелая, угрожающая жизни генерализованная или системная реакция гиперчувствительности с быстрым развитием, способная привести к летальному исходу [1].
Анафилактический шок (АШ) представляет собой острую форму нарушения кровообращения, возникающую из-за анафилаксии. Он характеризуется снижением систолического артериального давления (АД) ниже 90 мм рт. ст. или более чем на 30% от исходного уровня, что приводит к гипоксии жизненно важных органов.
Диагноз шока не может быть установлен при отсутствии выраженных гемодинамических изменений. Например, жизнеугрожающий бронхоспазм в сочетании с крапивницей квалифицируется как анафилаксия, но не как АШ.
Классификация
Анафилаксия
Выделяют три степени тяжести анафилактических реакций в зависимости от степени вовлеченности различных органов и систем.
_1.png)
Источник: Vetander M. et al. Classification of anaphylaxis and utility of the EAACI Taskforce position paper on anaphylaxis in children //Pediatric allergy and immunology. – 2011. – Т. 22. – №. 4. – С. 369-373.
По особенностям течения анафилактической реакции выделяют [2]:
- Затяжной характер течения (продленная анафилаксия) – патологические реакции выявляются длительно (несколько часов или суток), даже после проведения активной противошоковой терапии, которая имеет временный или частичный эффект. Развивается при анафилаксии, возникшей при введении препаратов пролонгированного действия.
- Рецидивирующее течение (бифазная анафилаксия) – возобновление характерных симптомов через 1-72 часа после их полного исчезновения при отсутствии повторной экспозиции аллергена.
Анафилактический шок
Выделяют 4 степени тяжести АШ [1]:
- 1 степень:
- Незначительные гемодинамические нарушения, АД снижено на 30-40 мм рт. ст. от нормальных для больного значений.
- Началу могут предшествовать першение в горле, кашель, кожный зуд и сыпь. К гемодинамическим симптомам (шум в ушах, головная боль, боль за грудиной) могут присоединяться крапивница, ангиоотек, риноконъюнктивит, кашель.
- Сознание сохранено, но могут наблюдаться беспокойство, возбуждение, страх смерти или вялость.
- 2 степень:
- Более выраженное снижение АД (ниже 90-60/40 мм рт. ст.) и респираторные симптомы (осиплость голоса, одышка, хрипы, стридорозное дыхание).
- Присутствуют симптомы со стороны других органов, в том числе рвота, непроизвольное мочеиспускание и дефекация.
- Характерны тахикардия, тахиаритмия, глухие тоны сердца.
- Может наблюдаться потеря сознания.
- 3 степень:
- АД составляет 60-40/0 мм рт. ст.
- Пациент находится без сознания.
- Возможно появление судорог, холодного липкого пота, цианоза губ, расширение зрачков.
- Пульс нитевидный, ритм сердца неправильный.
- 4 степень:
- АД не определяется.
- Наблюдается внезапная остановка кровообращения, из-за чего применяется протокол сердечно-легочной реанимации.
Выделяют несколько вариантов течения АШ:
- Злокачественное течение: начинается остро, сопровождается резким падением АД (диастолическое АД снижается до 0 мм рт. ст.), нарушением сознания, усилением дыхательной недостаточности с бронхоспазмом. Эта форма плохо поддается лечению, прогрессирует до тяжелого отека легких, стойкой гипотонии и глубокой комы. Быстрое развитие анафилаксии повышает риск летального исхода.
- Острое доброкачественное течение: характерно для типичной формы АШ. Отмечаются оглушение или сопор, умеренные изменения сосудистого тонуса и дыхательной функции. Своевременная терапия дает хороший эффект, прогноз благоприятный.
- Затяжное течение: возникает после активной терапии, которая дает временный или частичный эффект. Симптомы выражены слабее, чем при злокачественном или доброкачественном течении, но сохраняются дольше и хуже поддаются лечению. Возможны осложнения: пневмония, гепатит, энцефалит. Характерно для АШ при введении препаратов пролонгированного действия.
- Рецидивирующее течение: повторный шок возникает после купирования первоначальных симптомов, часто из-за препаратов пролонгированного действия. Рецидивы могут отличаться по клинической картине, быть более тяжелыми и резистентными к лечению.
- Абортивное течение: наиболее легкая форма, часто протекает как асфиктический вариант. Гемодинамические нарушения минимальны и быстро устраняются.
Варианты АШ в зависимости от преобладающих клинических симптомов:
- Типичный вариант – сочетание гемодинамических нарушений с бронхоспазмом и кожными проявлениями (крапивница, ангиоотек).
- Гемодинамический вариант – преобладание нарушений гемодинамики или их изолированный характер.
- Асфиктический вариант – доминирование симптомов острой дыхательной недостаточности.
- Абдоминальный вариант – наибольшая выраженность симптомов со стороны желудочно-кишечного тракта (ЖКТ) в сочетании с респираторными или гемодинамическими нарушениями.
- Церебральный вариант – преобладание нарушений со стороны центральной нервной системы (ЦНС) в сочетании с симптомами со стороны дыхания и кровообращения.
Можно встретить термин «анафилактоидные реакции», которым ранее обозначались все IgE-независимые реакции, однако на данный момент они также входят в понятие анафилаксии.
Этиология
К факторам, провоцирующим развитие анафилактических реакций, относятся [1, 3]:
- лекарственные средства (ЛС), включая бета-лактамные антибиотики, нестероидные противовоспалительные препараты (НПВП), нейротропные препараты, миорелаксанты, йод-содержащие рентгенконтрастные вещества), латекс,
- пищевые продукты (например, арахис, орехи, морепродукты, рыба),
- яд перепончатокрылых насекомых (осы, пчелы).
Возможно развитие анафилаксии, индуцированной физической нагрузкой, приемом алкоголя, а также ядами других животных (например, змей). В 24-26% случаев причина анафилаксии остается неустановленной.
Прослеживаются возрастные различия провоцирующих анафилаксию факторов: у детей чаще причиной являются пищевые продукты, у взрослых – яд перепончатокрылых насекомых и лекарственные средства.
Патогенез
Анафилаксия представляет собой комплекс иммунных, IgE-опосредованных и не-IgE-опосредованных реакций, а также неиммунных механизмов, тесно взаимосвязанных между собой. Однако из-за угрозы для жизни, а также этических ограничений данные об иммунологических механизмах анафилаксии у человека остаются ограниченными.
_1.png)
_1.png)
Источник: Nguyen S. M. T. et al. Mechanisms governing anaphylaxis: inflammatory cells, mediators, endothelial gap junctions and beyond //International journal of molecular sciences. – 2021. – Т. 22. – №. 15. – С. 7785.
IgE-зависимые реакции
IgE-антитела играют важную роль в активации эффекторных клеток при анафилаксии и аллергических заболеваниях. IgE связываются с высокоаффинными рецепторами FcεRI на базофилах и тканевых тучных клетках, а также на других клетках (нейтрофилах, эозинофилах, моноцитах, дендритных клетках, тромбоцитах). При воздействии аллергена сшивание FcεRI-связанного IgE вызывает активацию тучных клеток и базофилов, что приводит к немедленному высвобождению предварительно сформированных медиаторов (гистамин, протеазы) или синтезу de novo (лейкотриены, простагландины, цитокины) [4, 5].
Образование антиген-специфических IgE рассматривается как ключевой фактор риска развития аллергии и анафилаксии при последующем контакте с антигеном. Однако уровень IgE сам по себе не объясняет предрасположенность к анафилаксии: некоторые пациенты с высоким уровнем IgE могут не испытывать никаких симптомов при контакте с аллергеном, в то время как у других, с низким или необнаруживаемым уровнем IgE, развиваются тяжелые анафилактические реакции [6,7].
IgE-независимые реакции
Отсутствие обнаружения свободного IgE не исключает возможность IgE-независимых путей развития анафилаксии. Несмотря на отсутствие свободного IgE, у таких пациентов может быть достаточное количество FcεRI-связанного IgE для возникновения IgE-опосредованных реакций [4].
IgG-опосредованные механизмы
Эти механизмы опосредованы IgG-иммунными комплексами, которые связываются с низкоаффинным рецептором FcγRIII на макрофагах, активируя синтез фактора активации тромбоцитов (ФАТ) тучными клетками, тромбоцитами, нейтрофилами, моноцитами. Это может привести к агрегации тромбоцитов, высвобождению тромбоксанов и серотонина, увеличению проницаемости эндотелия, утечке плазмы из капилляров и вазодилатации. Снижение сердечного выброса, бронхоспазм или диарея также могут быть опосредованы ФАТ [8].
Хотя прямые доказательства существования IgG-опосредованной анафилаксии у людей отсутствуют, она играет роль в отдельных клинических ситуациях. Исследования на мышах показали, что низкие дозы антигена стимулируют блокирующий IgG-ответ, предотвращающий IgE-опосредованную анафилаксию, в то время как высокие дозы антигена могут опосредовать IgG-опосредованную анафилаксию [9]. Примеры таких реакций включают инфузии биологических агентов (например, инфликсимаба), декстранов, внутривенного иммуноглобулина у пациентов с IgA-дефицитом, апротинина, фактора Виллебранда и других лекарственных препаратов [10].
Роль системы комплемента
Активация системы комплемента происходит в ответ на многие раздражители и приводит к образованию небольших полипептидов: C3a, C4a и C5a, также называемых анафилатоксинами, которые являются мощными медиаторами воспаления. При анафилаксии у человека наблюдается истощение уже синтезированных С3а и С5а, сопровождающееся снижением уровней этих анафилотоксинов. Анафилатоксины способны активировать различные миелоидные клетки, включая тучные клетки и базофилы. Кроме того, было показано, что уровень C3a, C4a и C5a в крови коррелирует с тяжестью анафилаксии у людей [11, 12].
Потенциальные эффекторные клетки анафилаксии
- Тучные клетки
Тучные клетки играют ключевую роль в IgE-зависимой аллергии и анафилаксии. Они экспрессируют высокоаффинный рецептор к IgE (FcεRI), который при связывании с антигеном активирует сигнальные пути, приводящие к высвобождению биологически активных веществ, таких как гистамин и цистеиниловые лейкотриены (ЦисЛТ). Гистамин, несмотря на то что используется для диагностики анафилаксии, быстро распадается, из-за чего его обнаружение в клинических образцах затруднено [13].
Триптаза, в отличие от гистамина, более стабильна и является важным маркером активации тучных клеток. Зрелая β-триптаза хранится в гранулах тучных клеток и высвобождается при их активации, например, при анафилаксии. α- и β-протриптазы секретируются тучными клетками постоянно, поэтому повышенный уровень триптазы в крови указывает на увеличение нагрузки на тучные клетки, а не на анафилаксию [4, 14].
У пациентов с мастоцитозом, заболеванием, характеризующимся избыточным количеством тучных клеток, часто наблюдаются анафилактические реакции. У детей с мастоцитозом повышенный уровень триптазы в сыворотке крови является фактором риска развития анафилаксии и увеличения числа её эпизодов [15].
- Базофилы
Базофилы человека экспрессируют высокоаффинный IgE-рецептор FcεRI, а также активирующий IgG-рецептор FcγRIIA и ингибирующий IgG-рецептор FcγRIIB. Активация базофилов, зависимая от IgE, сопровождается увеличением уровня поверхностных клеточных маркеров, таких как CD203c и CD63. Эти изменения лежат в основе «тестов активации базофилов», использующихся для диагностики и подтверждения сенсибилизации к аллергенам, а также мониторинга эффективности иммунотерапии. Однако вклад базофилов в патогенез анафилаксии у человека остается неясным из-за сопутствующей активации тучных клеток в этом процессе [4, 16].
- Моноциты и макрофаги
Моноциты и макрофаги экспрессируют высокие уровни активирующих FcγR и могут реагировать на анафилатоксины. Исследования на мышах показали, что истощение моноцитов/макрофагов с помощью липосомального клодроната уменьшает анафилаксию как в IgG-опосредованных пассивных, так и в активных моделях. Это указывает на важную роль моноцитов и макрофагов в патогенезе анафилаксии. Однако участие этих клеток в развитии анафилаксии у человека остается малоизученным [4].
- Нейтрофилы
Недавние исследования подробно изучили потенциальные функции нейтрофилов при анафилаксии. Установлено, что нейтрофилы человека способны экспрессировать активирующие FcγR, вырабатывать гистамин и выделять ФАТ в ответ на стимуляцию иммунными комплексами in vitro [17]. Также сообщается о возможной экспрессии FcεRI на нейтрофилах, особенно у пациентов с астмой [18].
Основным ферментом, накапливающимся в нейтрофилах, является миелопероксидаза (МПО). В недавнем исследовании обнаружено повышение уровня циркулирующей МПО у пациентов с анафилаксией по сравнению со здоровыми донорами. Однако важно отметить, что эти результаты не являются окончательным подтверждением активации нейтрофилов при данном процессе, поскольку МПО выделяется другими клеточными популяциями, включая макрофаги [4].
Снижение экспрессии активирующих IgG рецепторов FcγRIII и FcγRIV на нейтрофилах мышей после IgG-опосредованной пассивной анафилаксии (сенсибилизация организма достигалась путем введения специфических IgG от сенсибилизированного организма) указывает на возможность прямой активации нейтрофилов IgG иммунными комплексами [19].
- Тромбоциты
Анафилаксия может быть связана с активацией тромбоцитов в ответ на ФАТ и другие факторы. Активированные тромбоциты высвобождают медиаторы, такие как тромбоцитарный фактор 4 и серотонин, которые играют важную роль в патофизиологии анафилактических реакций.
Тромбоциты человека экспрессируют рецепторы FcεRI, FcεRII и FcγRIIA, а также могут быть активированы in vitro после инкубации с сывороткой пациентов с аллергией и воздействия соответствующего аллергена. В недавних исследованиях показано, что во время тестов активации базофилов in vitro базофилы (потенциальный источник ФАТ) образуют ассоциации с тромбоцитами. Это указывает на необходимость дальнейшего изучения взаимодействия между тромбоцитами и базофилами в контексте анафилаксии [20].
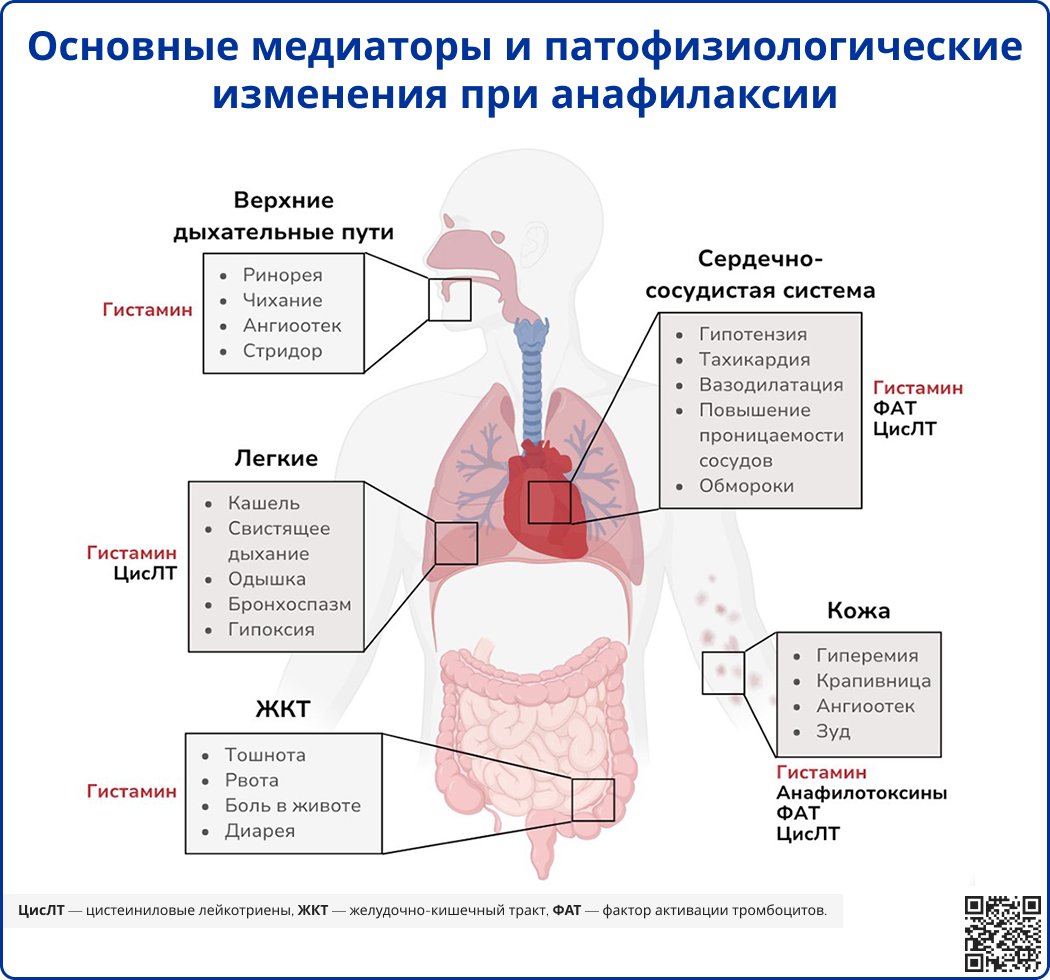
Источник: Reber L. L., Hernandez J. D., Galli S. J. The pathophysiology of anaphylaxis //Journal of Allergy and Clinical Immunology. – 2017. – Т. 140. – №. 2. – С. 335-348.
Потенциальные медиаторы анафилаксии
- Гистамин
Гистамин долгое время считается ключевым медиатором анафилаксии. Было показано, что аэрозольное введение гистамина вызывает бронхоконстрикцию у здоровых людей, хотя его эффект был значительно слабее, чем у лейкотриенов. Внутривенное введение гистамина добровольцам воспроизводит многие симптомы анафилаксии: гиперемию кожи, головную боль, обструкцию дыхательных путей и преходящие гемодинамические изменения, включая системную гипотензию, тахикардию, увеличение работы левого желудочка [21].
Исследования с использованием антагонистов рецепторов выявили, что некоторые системные эффекты гистамина, такие как обструкция дыхательных путей и тахикардия, опосредуются через H1-рецепторы. Другие эффекты, такие как кожная гиперемия и головная боль, вероятно, связаны с активацией H1- и H2-рецепторов [21, 22].
- Фактор активации тромбоцитов
ФАТ – фосфолипидный медиатор, участвующий в агрегации тромбоцитов и играющий важную роль в ряде иммунных и воспалительных реакций. ФАТ выделяется различными клетками человека, в том числе очищенными тучными клетками легких и базофилами крови после стимуляции ex vivo анти-IgE антителами, а также очищенными нейтрофилами после инкубации in vitro с термически агрегированным IgG человека. Многие клеточные популяции, продуцирующие ФАТ (тромбоциты, тучные клетки, нейтрофилы, макрофаги), могут сами на него реагировать. Инъекция ФАТ в кожу здоровых добровольцев вызывает реакцию в виде сыпи и эритемы. Поскольку эти реакции могут быть заблокированы H1-антигистаминными препаратами, впервые было выдвинуто предположение, что ФАТ вызывает сыпь через вторичное высвобождение гистамина тучными клетками кожи [4].
- Цистеиниловые лейкотриены
Третий класс потенциальных медиаторов анафилаксии, первоначально обозначенный как «медленно реагирующая субстанция анафилаксии» (SRS-A), включает три биологически активных ЦисЛТ: лейкотриен B4 (ЛТB4), ЛТC4, ЛТD4. Эти соединения синтезируются из арахидоновой кислоты различными клетками, такими как тучные клетки, базофилы и макрофаги. Многочисленные исследования указывают на способность ЦисЛТ вызывать острые аллергические реакции. Внутрикожное введение каждого из трех ЦисЛТ здоровым добровольцам приводило к появлению сыпи, а также покраснению кожи. Аэрозольное введение ЛТC4 и ЛТD4 также вызывало бронхоконстрикцию, которая была в 1000 раз сильнее, чем при введении гистамина [23].
- Другие потенциальные медиаторы
Анафилаксия также связана с изменениями уровней других медиаторов, таких как триптаза, простагландины и цитокины/хемокины. При анафилаксии наблюдается истощение брадикинина, высокомолекулярного кининогена и факторов свертывания крови, что может приводить к развитию ДВС-синдрома. У некоторых пациентов развиваются рецидивирующие симптомы, требующие длительного лечения эпинефрином и глюкокортикостероидами. Эти поздние последствия могут быть связаны с действием ЦисЛТ, различных цитокинов и хемокинов. Тучные клетки могут также выделять аденозин, который оказывает комплексное воздействие через аденозиновые рецепторы, что потенциально влияет на патофизиологию анафилаксии. Однако для полного понимания роли этих медиаторов в анафилаксии необходимы дальнейшие исследования [4].
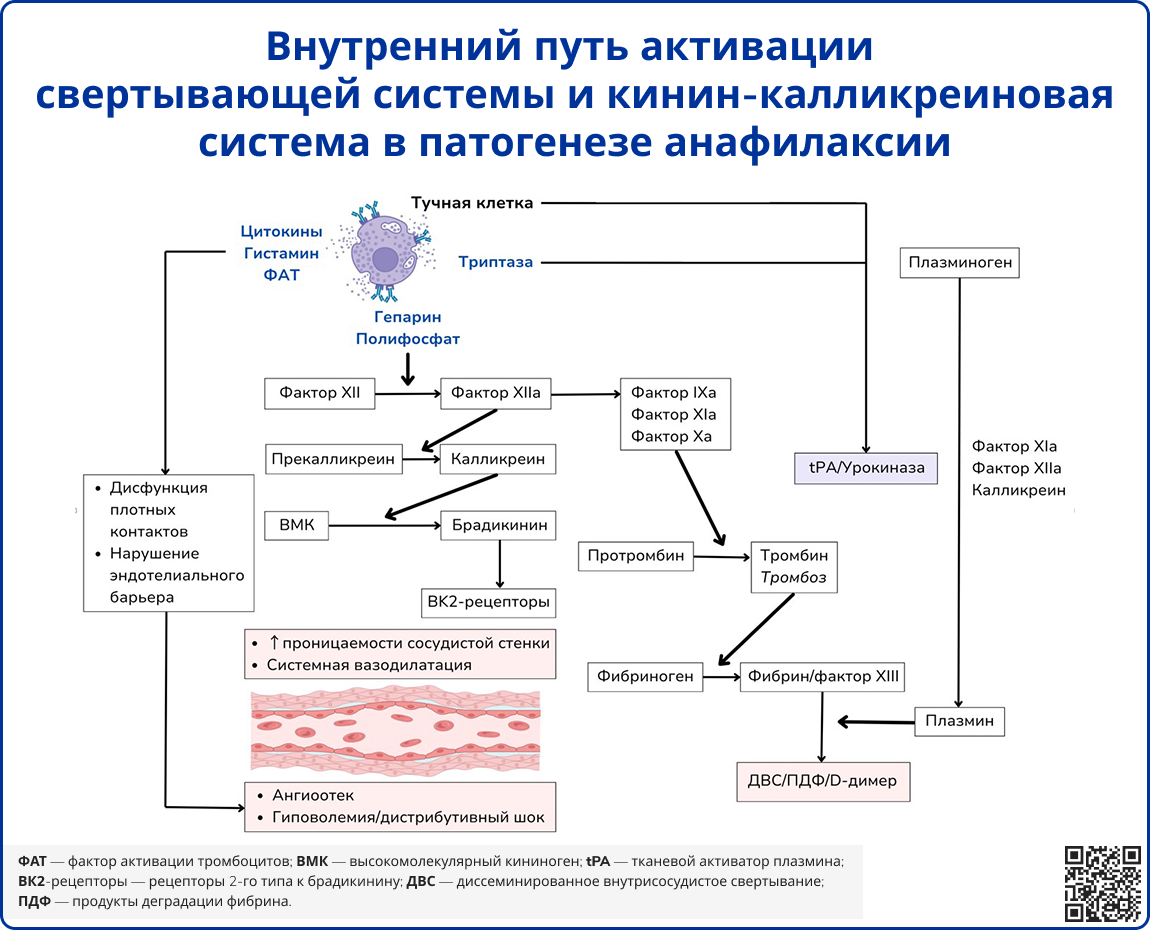
Источник: Nguyen S. M. T. et al. Mechanisms governing anaphylaxis: inflammatory cells, mediators, endothelial gap junctions and beyond //International journal of molecular sciences. – 2021. – Т. 22. – №. 15. – С. 7785.
Клиническая картина
Анафилактические реакции, как правило, развиваются в течение двух часов после контакта с причинно-значимым аллергеном, чаще всего – в течение получаса. При развитии АШ среднее время от начала симптомов до остановки кровообращения составляло 30, 15 и 5 минут для пищевых продуктов, ядов насекомых и ЛС для парентерального введения соответственно [1].
Анафилаксия проявляется различными комбинациями симптомов, которые могут значительно различаться по частоте и выраженности. Наиболее распространенные клинические проявления включают [2]:
- Симптомы со стороны кожи и слизистых оболочек: наблюдаются в 90% случаев. Эти проявления включают генерализованную крапивницу, зуд, гиперемию кожи, отек языка, губ, мягкого неба, периорбитальный отек, а также инъецированность склер.
- Симптомы со стороны дыхательной системы: встречаются в 70% случаев и могут включать заложенность носа, ринорею, осиплость голоса, ощущение першения в горле, спазм гортани, чувство удушья, стридор, поверхностное дыхание, хрипы, кашель.
- Симптомы желудочно-кишечного тракта: наблюдаются в 45% случаев. Они включают тошноту, рвоту, диарею, схваткообразные боли в животе.
- Кардиоваскулярные симптомы: отмечаются в 45% случаев. К ним относятся артериальная гипотензия (вплоть до коллапса), обморок, спутанность сознания, головокружение, тахикардия, мышечная гипотония.
Клиническое течение анафилаксии варьирует от легких форм, которые могут спонтанно купироваться благодаря компенсаторным эндогенным медиаторным механизмам (например, эпинефрин, ангиотензин II, эндотелин), до крайне тяжелых случаев, которые развиваются за считаные минуты и приводят к декомпенсации дыхательной и сердечно-сосудистой систем с возможным летальным исходом.
На этапе появления первых симптомов невозможно предсказать тяжесть, скорость прогрессирования, вероятность успешного купирования симптомов, а также вероятность трансформации в бифазное или затяжное течение.
К распространенным причинам смерти при анафилаксии относятся:
- Отек дыхательных путей и асфиксия из-за их обструкции,
- Сердечно-сосудистый коллапс (реже).
Диагностика
Первичная диагностика анафилаксии основывается исключительно на клинических проявлениях. Остальные диагностические методы не имеют решающего значения для экстренной тактики, поэтому носят вспомогательный характер и используются, например, для установления причины анафилактической реакции и исключения заболеваний, на фоне которых такая реакция могла развиться (например, системного мастоцитоза).
Диагностические критерии
Согласно диагностическим критериям, сформулированным многопрофильной группой экспертов в 2006 году и широко используемым в клинических рекомендациях на данный момент, анафилаксия крайне вероятна при наличии одного из трех критериев [1, 3, 24]:
- Острое начало (несколько минут-часов) с вовлечением кожи или слизистых оболочек (генерализованная крапивница, зуд, эритема, отек губ, языка, мягкого неба) и минимум один из следующих признаков:
- Нарушение дыхания (одышка, хрипы, бронхоспазм, стридор, снижение пиковой скорости выдоха (ПСВ), гипоксемия);
- Снижение АД или ассоциированные с ним симптомы со стороны органов (гипотония или коллапс, обморок, нарушение сознания).
- Два и более из следующих симптомов, возникшие вскоре (несколько минут-часов) после воздействия предполагаемого аллергена:
- Поражение кожи и слизистых оболочек (генерализованная крапивница, зуд, эритема, отек губ, языка, мягкого неба);
- Нарушение дыхания (одышка, хрипы, бронхоспазм, стридор, снижение ПСВ, гипоксемия);
- Снижение АД или ассоциированные с ним симптомы со стороны органов (гипотония или коллапс, обморок, нарушение сознания);
- Стойкие симптомы со стороны ЖКТ (схваткообразные боли в животе, тошнота).
- Снижение АД вскоре (несколько минут-часов) после контакта с предполагаемым аллергеном:
- Взрослые: систолическое АД < 90 мм рт. ст. или снижение систолического АД > 30% от нормального уровня для пациента.
- Дети: низкое систолическое АД или снижение систолического АД > 30% от нормального для пациента уровня.
У детей определение низкого систолического АД зависит от возраста:
- от 1 месяца до 1 года: < 70 мм рт. ст.;
- 1-10 лет: < (70 + 2 х возраст в годах) мм рт. ст.;
- 11-17 лет: < 90 мм рт. ст.
В ряде случаев, когда пациенты не соответствуют ни одному из критериев, может понадобиться назначение эпинефрина. Такая тактика применяется у лиц с остро возникшими симптомами, например, только со стороны кожи и слизистых (генерализованная крапивница или картина орального аллергического синдрома) непосредственно после контакта с аллергеном, которые имеют в анамнезе тяжелые анафилактические реакции при взаимодействии с этим аллергеном [2].
Дополнительные исследования
Активность сывороточной триптазы определяется через 15 минут-3 часа после начала первых симптомов и после выздоровления. Диагностически значимым считается повышение уровня выше, чем (1,2 × базальный уровень триптазы + 2 мг/дл). Однако нормальный уровень активности фермента не исключает анафилаксию, а повышенный встречается при других состояниях (инфаркт миокарда, травма, мастоцитоз). Определение активности сывороточной триптазы не используется рутинно [1].
Специфические IgE крови используются для выявления сенсибилизации к подозреваемому потенциальному провокатору уже после купирования анафилактической реакции.
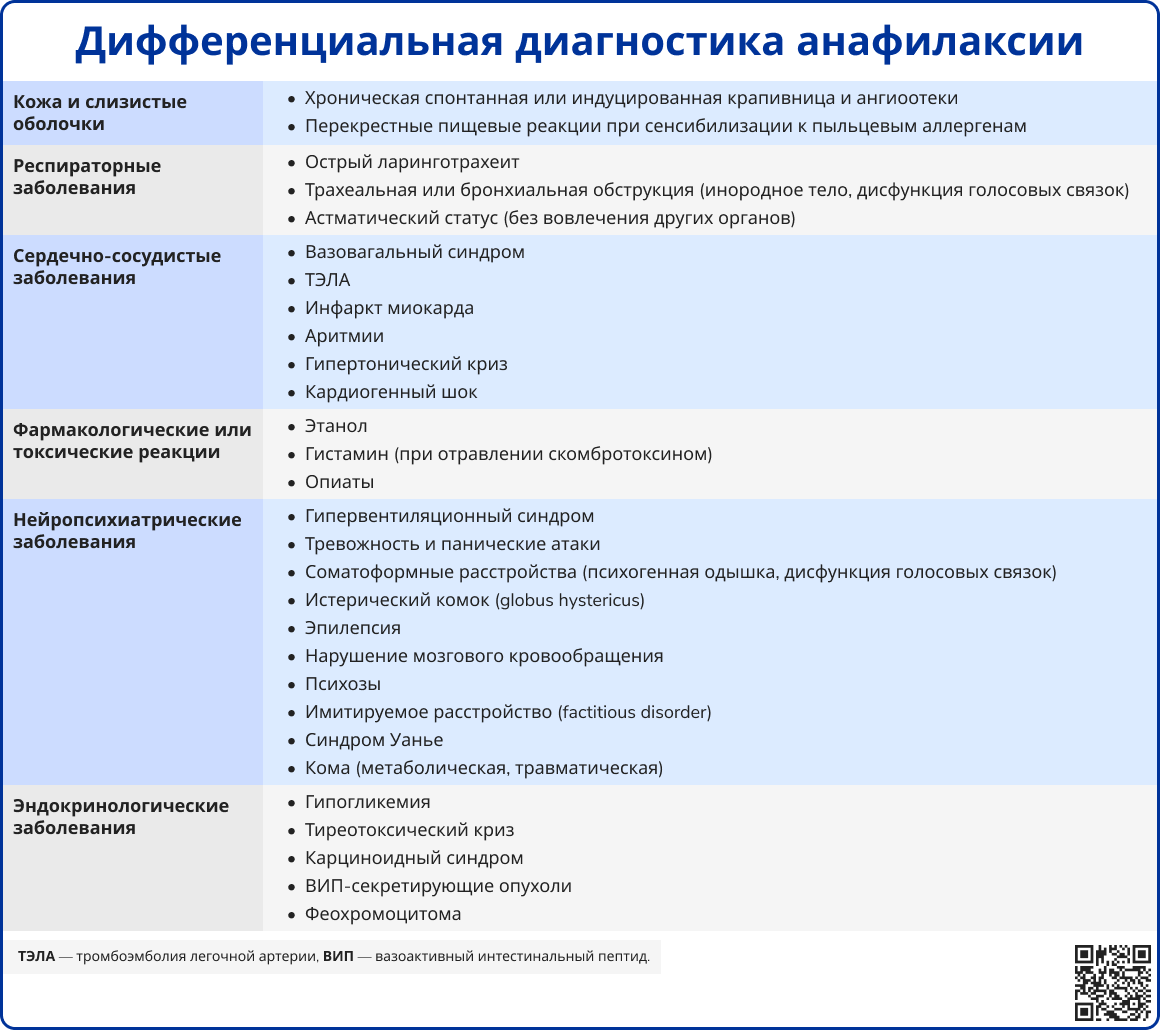
Источник: Muraro A. et al. EAACI guidelines: Anaphylaxis (2021 update) //Allergy. – 2022. – Т. 77. – №. 2. – С. 357-377.
Лечение
Доврачебный этап включает следующие мероприятия [1, 2]:
- Устранение контакта с предполагаемым причинно-значимым аллергеном.
- Вызов бригады скорой медицинской помощи.
- Внутримышечная инъекция эпинефрина в дозе 0,01 мг/кг массы тела, максимальная разовая доза для взрослого пациента составляет 0,5 мг, для ребенка 6-12 лет – 0,3 мг, до 6 лет – 0,15 мг. Предпочтительно введение в средне-наружную часть бедра (можно даже через одежду). При отсутствии эффекта через 5-10 минут инъекцию повторяют.
- Размещение пациента в положении лежа с приподнятыми ногами, при наличии рвоты дополнительно поворачивают голову набок. У лиц без сознания выполняют прием Сафара для обеспечения проходимости дыхательных путей.
На врачебном этапе лечение состоит из следующих этапов:
- При недостаточном ответе на 2 и более дозы эпинефрина все последующие введения проводят при непрерывном контроле гемодинамических показателей. При неэффективности 3 болюсов эпинефрина (в/м или в/в), переходят на в/в инфузии эпинефрина с постепенным титрованием дозы.
- Среднепоточная кислородотерапия через лицевую маску.
- Болюсное введение кристаллоидных растворов после инъекции эпинефрина для профилактики гиповолемии.
- Введение глюкокортикостероидов для снижения риска развития продленной фазы респираторных проявлений (не в режиме пульс-терапии).
- При сохранении симптомов со стороны кожи и слизистых оболочек после стабилизации АД назначают антигистаминные препараты системного действия для снижения проницаемости капилляров, уменьшения отека, зуда и гиперемии.
- При сохранении бронхоспазма на фоне применения адреналина используют ингаляционно селективные агонисты β2-адренорецепторов (сальбутамол).

Источник: Muraro A. et al. EAACI guidelines: Anaphylaxis (2021 update) //Allergy. – 2022. – Т. 77. – №. 2. – С. 357-377.
Список литературы
- Клинические рекомендации Российской ассоциации аллергологов и клинических иммунологов, Общероссийской общественной организации "Федерация анестезиологов и реаниматологов" "Анафилактический шок", М.: 2020
- Фомина Д. С., Горячкина Л. А. Анафилаксия–диагностика и лечение: учебное пособие. ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» //М.: ФГБОУ ДПО РМАНПО. – 2017. – С. 95.
- Muraro A. et al. EAACI guidelines: Anaphylaxis (2021 update) //Allergy. – 2022. – Т. 77. – №. 2. – С. 357-377.
- Reber L. L., Hernandez J. D., Galli S. J. The pathophysiology of anaphylaxis //Journal of Allergy and Clinical Immunology. – 2017. – Т. 140. – №. 2. – С. 335-348.
- Kraft S., Kinet J. P. New developments in FcεRI regulation, function and inhibition //Nature Reviews Immunology. – 2007. – Т. 7. – №. 5. – С. 365-378.
- Simons F. E. R. et al. Risk assessment in anaphylaxis: current and future approaches //Journal of allergy and clinical immunology. – 2007. – Т. 120. – №. 1. – С. S2-S24.
- Sturm G. J. et al. Influence of total IgE levels on the severity of sting reactions in Hymenoptera venom allergy //Allergy. – 2007. – Т. 62. – №. 8. – С. 884-889.
- Chong K. W. et al. Reaction phenotypes in IgE-mediated food allergy and anaphylaxis //Annals of Allergy, Asthma & Immunology. – 2020. – Т. 124. – №. 5. – С. 473-478.
- Jiménez‐Saiz R. Drug‐induced IgG‐neutrophil‐mediated anaphylaxis in humans: Uncovered! //Allergy. – 2020. – Т. 75. – №. 2.
- Nguyen S. M. T. et al. Mechanisms governing anaphylaxis: inflammatory cells, mediators, endothelial gap junctions and beyond //International journal of molecular sciences. – 2021. – Т. 22. – №. 15. – С. 7785.
- Klos A. et al. The role of the anaphylatoxins in health and disease //Molecular immunology. – 2009. – Т. 46. – №. 14. – С. 2753-2766.
- Brown S. G. A. et al. Anaphylaxis: clinical patterns, mediator release, and severity //Journal of allergy and clinical immunology. – 2013. – Т. 132. – №. 5. – С. 1141-1149. e5.
- Galli S. J., Tsai M. IgE and mast cells in allergic disease //Nature medicine. – 2012. – Т. 18. – №. 5. – С. 693-704.
- Schwartz L. B. Diagnostic value of tryptase in anaphylaxis and mastocytosis //Immunology and Allergy Clinics. – 2006. – Т. 26. – №. 3. – С. 451-463.
- Valent P. et al. Advances in the classification and treatment of mastocytosis: current status and outlook toward the future //Cancer research. – 2017. – Т. 77. – №. 6. – С. 1261-1270.
- Karasuyama H. et al. Nonredundant roles of basophils in immunity //Annual review of immunology. – 2011. – Т. 29. – №. 1. – С. 45-69.
- Alcañiz L. et al. Histamine production by human neutrophils //The FASEB Journal. – 2013. – Т. 27. – №. 7. – С. 2902-2910.
- Gounni A. S. et al. Human neutrophils express the high‐affinity receptor for immunoglobulin E (FceRI): role in asthma //The FASEB Journal. – 2001. – Т. 15. – №. 6. – С. 940-949.
- Jönsson F. et al. Mouse and human neutrophils induce anaphylaxis //The Journal of clinical investigation. – 2011. – Т. 121. – №. 4. – С. 1484-1496.
- Kasperska-Zajac A., Rogala B. Platelet function in anaphylaxis //Journal of Investigational Allergology and Clinical Immunology. – 2006. – Т. 16. – №. 1. – С. 1.
- Kaliner M. et al. Effects of infused histamine: analysis of the effects of H-1 and H-2 histamine receptor antagonists on cardiovascular and pulmonary responses //Journal of Allergy and Clinical Immunology. – 1981. – Т. 68. – №. 5. – С. 365-371.
- Vigorito C. et al. Cardiovascular effects of histamine infusion in man //Journal of cardiovascular pharmacology. – 1983. – Т. 5. – №. 4. – С. 531-537.
- Peters‐Golden M., Gleason M. M., Togias A. Cysteinyl leukotrienes: multi‐functional mediators in allergic rhinitis //Clinical & Experimental Allergy. – 2006. – Т. 36. – №. 6. – С. 689-703.
- Sampson H. A. et al. Second symposium on the definition and management of anaphylaxis: summary report—Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium //Journal of Allergy and Clinical Immunology. – 2006. – Т. 117. – №. 2. – С. 391-397.
Описание проверено экспертом
Статьи по теме Иммунология
- Аллергический ринит
- Пищевая аллергия
- Гиперчувствительный пневмонит
- Наследственный ангиоотек
- Крапивница
- Атопический дерматит
- Мастоцитоз
- Эозинофильный эзофагит
- Узловатая почесуха
- Бронхиальная астма
- Системная красная волчанка
Болезни в статье:
- L50 Крапивница
- I46 Остановка сердца
- J18 Пневмония без уточнения возбудителя
- G04 Энцефалит, миелит и энцефаломиелит
- T78.3 Ангионевротический отек
- J96 Дыхательная недостаточность, не классифицированная в других рубриках
- D80.2 Избирательный дефицит иммуноглобулина A [IgA]
- Q82.2 Мастоцитоз
- J45 Астма
- D65 Диссеминированное внутрисосудистое свертывание [синдром дефибринации]
- I21 Острый инфаркт миокарда
Фармгруппы в статье:
- Ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
- Нейротропные средства
- Рентгеноконтрастные средства
- Иммуноглобулины
- H1-антигистаминные средства
- Глюкокортикостероиды
- Бета-адреномиметики
Оцените статью:
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
См. Аллергия.



