- Эпидемиология
- Этиология и факторы риска
- Патогенез
- Морфогенез и гистогенез
- Классификация рака легкого
- Гистологическая классификация опухолей легкого и плевры (Histological typing of lung and pleural tumours, 1999)
- cTNM клиническая классификация
- pTNM патологическая классификация
- G — гистопатологическая дифференцировка
- Диагностика рака легкого
- Клинические аспекты рентгенодиагностики
- Рентгеновская компьютерная томография (спиральная или многосрезовая)
- Бронхоскопия
- Морфологическая верификация рака легкого
- Определение распространенности рака легкого
- Современная лечебная тактика при раке легкого
- Лечение больных немелкоклеточным раком легкого
- Химиотерапия распространенного НМРЛ
- Современная лечебная тактика при мелкоклеточном раке легкого
- Химиолучевая терапия при мелкоклеточном раке легкого
- Лучевая терапия при раке легкого
- Эндобронхиальная брахитерапия
- Конформальная лучевая терапия (3D-CRT)
- Лекарства и излучение
C34 Злокачественное новообразование бронхов и легкого, МКБ-10
- C34.0 Главных бронхов
- C34.1 Верхней доли бронхов или легкого
- C34.2 Средней доли бронхов или легкого
- C34.3 Нижней доли бронхов или легкого
- C34.8 Поражение бронхов или легкого, выходящее за пределы одной и более вышеуказанных локализаций
- C34.9 Бронхов или легкого неуточненной локализации
Отредактировано: 02.04.2024
д.м.н., проф. Полоцкий Б.Е., к.м.н. Лактионов К.К.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Эпидемиология. Этиология и факторы риска. Патогенез. Морфогенез и гистогенез. Классификация рака легкого. Диагностика рака легкого. Современная лечебная тактика при раке легкого. Лучевая терапия при раке легкого
Рак легкого — опухоль эпителиального происхождения, развивающаяся в слизистой оболочке бронха, бронхиол и слизистых бронхиальных желез.
Эпидемиология
Заболеваемость раком легкого за последние 50 лет резко возросла во многих странах мира. В настоящее время в большинстве развитых стран рак легкого является наиболее распространенной формой опухоли у мужчин и остается одной из важнейших медицинских и социально-экономических проблем. Ежегодно в мире регистрируется 1,2 млн новых случаев рака легкого, 921 тыс. смертей от этого заболевания; из них около 60% приходится на развитые страны.
Самые высокие показатели заболеваемости отмечены в Северной Америке и Европе (особенно в Восточной), несколько ниже — в Южной Америке, Австралии и в некоторых регионах Восточной Азии. Значительно ниже заболеваемость среди женского населения. Максимальны показатели в Северной Америке и Северной Европе; высока заболеваемость женского населения в Китае (13,4o/oooo) и Австралии (16,1o/oooo). Различия в заболеваемости мужчин и женщин достигают наибольших значений на Мальте, в Испании, Франции, Белоруссии; наименее выражены в Исландии и Новой Зеландии среди маори.
В 2002 г. в России раком легкого заболела 63,1 тыс. человек.
Абсолютное число умерших в России увеличилось за 20-летний период на 40% и достигло в 2000 г. 58,9 тыс. В структуре умерших от злокачественных новообразований доля рака легкого составляла 30,8% у мужчин и 6,6% у женщин. Стандартизованный показатель смертности у лиц обоего пола составил 60,1 и 5,9% соответственно.
Ранжированный ряд 45 стран мира представлен в отношении смертности от рака легкого в следующем порядке: для мужчин — Венгрия, Польша, Россия, Чехия, Эстония; для женщин — Дания, США, Канада, Англия, Венгрия; Россия находится на 27 месте.
Очень малое различие в среднем возрасте заболевших (64,7 года) и умерших (65,1 года) является следствием неблагополучного прогноза при этой форме опухоли, характеризующейся высокой летальностью. По данным SEER, 5-летняя выживаемость больных в США составляет 14%, в Европе — всего 8%, такие же показатели в развивающихся странах.
Этиология и факторы риска
Роль курения в этиологии рака легкого
Курение является наиболее важным фактором химически индуцированного рака легкого. На конференциях, проведенных под эгидой Международного агентства по изучению рака, посвященных проблеме курения, сделано заключение, что с ним связано 70–95% случаев возникновения рака легкого, а риск развития рака легкого среди курящих в среднем в 10 раз выше, чем у некурящих.
Установлено, что табачный дым содержит более 3800 химических веществ, многие из которых являются канцерогенными для человека. К ним относятся прежде всего полиароматические углеводороды, в т.ч. бенз(а)пирен(БП), 2-толуидин, 2-нафтиламин, 4-аминобифенил, никель, 210Po и ряд N-нитрозосоединений. Важным параметром, определяющим уровень N-нитрозосоединений в табачном дыме, является содержание в табаке нитратов. Относительный риск развития рака легкого, связанный с курением, возрастает и зависит от количества выкуриваемых в день сигарет. Однако продолжительность курения является более существенным фактором, чем количество ежедневно выкуриваемых сигарет.
Профессиональные факторы
Немаловажную роль в возникновении рака легкого играют профессиональные факторы. С достоверностью установлена этиологическая связь возникновения рака легкого с такими веществами и производственными процессами, как асбест, мышьяк, хром, никель и их соединения, радон и продукты его распада, горчичный газ, каменноугольные смолы, подземная добыча гематита, алюминиевая промышленность, производства, связанные с коксованием угля, выплавкой железа и стали, резиновая промышленность и др. Доля рака легкого, связанного с профессиональными факторами, колеблется в пределах от 4 до 40%, в зависимости от места и времени проводимого исследования, а так же от концентрации в зоне эпидемиологического исследования в определенный период времени того или иного канцерогенного фактора. Необходимо отметить, что курение и профессиональные факторы синергически влияют на риск возникновения рака легкого.
Загрязнение атмосферного воздуха
Рак легкого в большей степени, чем другие формы злокачественных опухолей, связан с загрязнением атмосферного воздуха канцерогенными веществами. Эти вещества обнаруживаются не только на территории промышленных предприятий, выбрасывающих их, в промышленных центрах, вдоль автомобильных магистралей, но и далеко за их пределами. Население, проживающее в городах и территориально-промышленных комплексах с высокой степенью индустриального развития, преимущественно тяжелой, химической, нефтехимической и нефтеперерабатывающей промышленности, чаще поражается онкологическими заболеваниями, в т.ч. раком легкого, чем в городах, специализирующихся на легкой и пищевой промышленности. Однако существующие эпидемиологические данные о загрязнении атмосферного воздуха как этиологическом факторе рака легкого указывают на то, что загрязнение воздуха, скорее всего, влияет на риск развития этого заболевания, но влияние курения и профессиональных факторов имеют гораздо большее значение.
Загрязнение воздуха жилых помещений
В последние годы появился большой интерес к изучению роли загрязнения воздуха жилых помещений табачным дымом и альфа-частицами радиоактивного изучения радона и его производных в этиологии рака легкого. Показано, что химический состав табачного дыма, который попадает в воздух (побочный поток), несколько отличается от состава вдыхаемого дыма при активном курении (основной поток). В частности, в побочном потоке более высокое содержание аммиака, аминов, включая ароматические амины, и газообразных N-нитрозосоединений, чем в основном потоке.
Свидетельства канцерогенного воздействия ионизирующего излучения были выявлены на людях. Первыми пострадавшими от него оказались физики и врачи-рентгенологи. Впоследствии круг расширился за счет пострадавших при атомных взрывах, подвергшихся воздействию такого излучения в медицинских (диагностических и терапевтических) целях и занятых на производствах, связанных с действием радиоактивного излучения. Наиболее весомым из всех естественных источников ионизирующего излучения является радон — невидимый и не имеющий запаха тяжелый газ.
На поступление радона в жилые помещения влияет ряд факторов: содержание и выделение его из подстилающих горных пород, из строительных материалов, которые часто содержат высокие концентрации радона и его производных, потребление питьевой воды и газа, содержащих радон, вентиляция помещений и др. Легкие подвергаются особенно высокому риску злокачественных изменений в связи с альфа-излучением из продуктов деградации радона. Основываясь на экспозиции к ним рабочих в шахтах, показано, что по отношению ко всему телу 70% осаждения радона приходится на легкие.
Результаты эпидемиологических исследований позволили предположить, что различные факторы вызывают определенные гистологические типы рака легкого. Было показано, что связь между курением и риском возникновения рака легкого — значительная для плоскоклеточного и менее для крупноклеточного рака и аденокарциномы, которая часто встречается у некурящих женщин и среди населения с невысокой заболеваемостью раком легкого.
К настоящему времени получены убедительные данные о том, что центральный и периферический рак различаются не только локализацией и структурами, из которых он развивается, но и особенностями этиологии, пато-, морфо- и гистогенеза. В этиологии центрального рака легкого имеет значение вдыхание канцерогенных веществ, а периферического — проникновение канцерогенов с крово- и лимфотоком, что подтверждается экспериментальными и клиническими данными. Центральный рак развивается в крупных бронхах, вплоть до проксимальных отделов сегментарных бронхов. Основная часть канцерогенов попадает с вдыхаемым загрязненным атмосферным воздухом при курении (активном и пассивном), смогах, работе с профессиональными вредностями (на шахтах по добыче урановых и железных руд, на сталелитейном производстве, деревообрабатывающей промышленности и др.). Периферический рак развивается из эпителия мелких бронхов, бронхиол и альвеол. При этом канцерогенные агенты, как это было установлено в экспериментах на животных, обычно попадают в легкие гематогенным и лимфогенным путями. У человека развитие периферического рака легкого, как правило, не удается связать с курением или вдыханием вредной профессиональной пыли.
Таким образом, результаты эпидемиологических исследований влияния факторов окружающей среды на риск развития рака легкого позволяют сделать вывод, что доля влияния различных изучаемых факторов неодинакова, а роль курения и профессиональная экспозиция несравнимо больше, чем загрязнение атмосферного воздуха.
Патогенез
Развитие злокачественной опухоли — многофакторный и многостадийный процесс, в основе которого лежит накопление клетками различных генетических изменений, приводящих к злокачественной трансформации. Малигнизация нормальных клеток является следствием каскадного накопления в их геноме различных нарушений. Предполагается, что для развития рака у человека необходимы изменения не менее 6–10 генетических факторов.
Известно, что основной причиной возникновения и прогрессии злокачественных новообразований является нарушение функционирования относительно небольшого числа генов, в частности протоонкогенов и генов-супрессоров опухолевого роста (антионкогенов). Кроме того, существует большая группа генов-модуляторов, не отвечающих за злокачественную трансформацию клеток, но способствующих распространению опухоли в организме.
В настоящее время накоплен достаточно большой объем данных, касающихся отдельных молекулярно-генетических характеристик различных типов рака легкого. И хотя спектр генетических изменений в случае каждой конкретной опухоли носит индивидуальный характер, тем не менее, наблюдаются определенные закономерности генных альтераций, которые дают основания связывать их с развитием или характером прогрессии той или иной патологии.
В патогенезе рака легкого можно условно выделить 3 этапа:
I этап — связан с первичным контактом канцерогенного агента и легких, его активацией, взаимодействием с ДНК эпителиальной клетки, что приводит к изменению ее генома и фенотипа — образованию латентной раковой клетки.
II этап — характеризуется хроническим повторным контактом канцерогенов или некоторых других повреждающих агентов (промоторов) с клетками; затем происходят дополнительные генные изменения, вызывающие размножение раковых клеток с образованием опухолевого узла.
III этап — нарастание различных признаков злокачественности (атипии, инвазивного роста, метастазирования, хромосомных аберраций и др.), часто независимо друг от друга.
Ключевым моментом I и II этапов патогенеза рака легкого является повреждение генома эпителиальной клетки, которые развиваются в 3 направлениях: хромосомных аберраций, точечных мутаций и повреждения протоонкогенов. В НМРЛ при росте в культуре ткани в клетке часто возникают повреждения 1, 2, 3 и 9 хромосом. Хромосомные аберрации зарегистрированы в МРЛ в виде делеции (утраты части хромосомы) в коротком плече 3 хромосомы.
Рост и дифференцировка опухолевых клеток регулируется онкогенами и генами-супрессорами через их белковые продукты. Онкогены — нормальные клеточные гены (протоонкогены), изменение в структуре или уровне экспрессии которых приводят к продукции измененного белкового продукта и нарушению нормальных взаимосвязей с белками-партнерами. Антионкогены — гены, кодирующие ключевые регуляторные белки, потеря которых влечет за собой нарушение контроля клеточной пролиферации. В настоящее время известно более 100 различных онкогенов и около 10 генов-супрессоров (подробнее см. соответствующий раздел).
Концепция протоонкогенов позволяет установить взаимосвязь между всеми теориями канцерогенеза, поскольку повреждение или активация этих особых генов может происходить при воздействии самых различных канцерогенов. Множественные хромосомные и генные мутации, выявляемые при раке легкого в пределах каждой опухоли, свидетельствуют в пользу гипотезы многоступенчатости онкогенеза.
Морфогенез и гистогенез
Начальным этапом морфогенеза центрального рака легкого является повреждение бронхиального эпителия. Реснитчатые и бокаловидные клетки слущиваются в просвет бронхов, обнажаются подлежащие слои базальных клеток, не защищенных от внешних воздействий ни ресничками, ни слизеобразованием. В этих условиях канцерогенные вещества могут свободно контактировать, накапливаться и повреждать базальные клетки, вызывая их пролиферацию — базально-клеточную гиперплазию. Продолжающееся действие канцерогенного агента может приводить к нарушению клеточной дифференцировки в очагах повреждения и к пролиферации базальных клеток, что вызывает развитие плоскоклеточной метаплазии. Эпителий в очагах плоскоклеточной метаплазии обладает повышенной чувствительностью к канцерогенным воздействиям и быстрее может подвергаться трансформации.
Следующим этапом морфогенеза является дисплазия эпителия, развивающаяся в бронхах в очагах плоскоклеточной метаплазии, особенно часто в местах выхода выводных протоков бронхиальных желез. Установлено, что дисплазия I и II степени может быть вызвана воздействием различных повреждающих агентов, как канцерогенных, так и неканцерогенных. Дисплазия эпителия бронхов III степени возникает в эксперименте только при действии канцерогенных веществ. Дисплазия и carcinoma in situ в интактных бронхах больных раком легкого выявляются в 2–3 раза чаще, чем у людей с неопухолевыми заболеваниями легких.
Морфогенез периферического рака легкого и предраковые изменения при нем изучены в гораздо меньшей степени, чем при центральном раке. Установлено, что периферический рак в подавляющем большинстве случаев развивается в очагах пневмосклероза после перенесенного туберкулеза, пневмоний, инфаркта легкого, вокруг инородных тел. В рубцах на периферии легкого обнаруживается широкий спектр предопухолевых изменений эпителия мелких бронхов, бронхиол, альвеол, часто выявляются очаги аденоматоза. Роль рубца в злокачественной трансформации клеток может быть связана с депонированием в нем канцерогенных агентов, гипоксией, местной иммунодепрессией, нарушением межклеточных регуляторных взаимодействий.
Гистогенез центрального рака легкого следует рассматривать с позиции цитогенеза легочного эпителия. В очагах дисплазии эпителия крупных бронхов обнаруживаются разнообразные клетки — цилиндрические, базальные, промежуточные, нейроэндокринные, сохраняющие митотическую активность, а, следовательно, способные подвергаться злокачественной трансформации. Поскольку очаги дисплазии крупных бронхов построены в основном из базальных клеток, мультипотентных цилиндрических клеток-предшественниц, промежуточных и нейроэндокринных клеток, преобладающими типами при центральном раке являются плоскоклеточный рак и мелкоклеточный рак. Крупноклеточный рак и аденокарцинома развиваются относительно редко.
Гистогенез периферического рака легкого несколько отличается от гистогенеза центрального рака в связи с тем, что на периферии в очагах дисплазии имеется большое разнообразие клеток, которые могут быть источником роста опухоли. Это цилиндрические, базальные, пререснитчатые, бокаловидные клетки, клетки Клара, пневмоциты II и, вероятно, эндокринные клетки. Кроме того, на периферии преобладают клетки с железистой дифференцировкой. Поэтому на периферии легкого развиваются практически те же гистологические типы рака легкого, что и в крупных бронхах, но с преобладанием железистых типов опухолей. В бронхиолах и альвеолах имеются клетки Клара и пневмоциты II, не встречающиеся в крупных бронхах и сохраняющие митотическую активность на протяжении всей жизни человека. Эти клетки обнаруживаются в очагах дисплазии эпителия и могут быть источником рака легкого, встречающегося только на периферии легкого, — бронхиолоальвеолярного рака.
Классификация рака легкого
В основу существующих классификаций рака легкого положены два принципа: клинико-анатомический и гистоморфологический.
Наибольшее практическое применение получила Клинико-анатомическая классификация рака легкого, предложенная А.И. Савицким в 1957 г., согласно которой выделяют:
1. Центральный рак:
а) эндобронхиальный,
б) перибронхиальный,
в) разветвленный.
2. Периферический рак:
а) круглая опухоль,
б) пневмониеподобный рак,
в) рак верхушки легкого (Панкоста).
3. Атипичные формы, связанные с особенностями метастазирования:
а) медиастинальная,
б) милиарный карциноматоз и др.
В клинике преобладают центральный и периферический рак. Эти виды опухоли существенно отличаются друг от друга по анатомическому paсположению, симптоматике и клиническому течению.
Центральный рак поражает крупные бронхи (главные, долевые и ceгментарные), периферический — субсегментарные и более мелкие бронхи. Соотношение первично выявленного центрального и периферического рака составляет примерно 2:1 соответственно. Правое легкое поражается в несколько раз чаще. Это относится и к развитию опухолей в верхних долях легких.
Существенное значение в характеристике рака легкого имеет форма роста опухоли.
Экзофитный рак с эндобронхиальным (в просвет бронха) ростом опухоли характеризуется частичной или полной его обтурацией.
Эндофитный рак с экзобронхиальным (перибронхиальным) ростом опухоли характеризуется преимущественным ее распространением в толщу легочной ткани. Длительное время сохраняется проходимость бронха.
Разветвленный рак с перибронхиальным ростом опухоли характеризуется муфтообразным расположением новообразования вокруг бронха, равномерно суживая его просвет.
В клинической практике чаще наблюдается смешанный характер роста опухоли с преобладанием того или иного компонента.
Окончательное суждение о характере роста опухоли можно иметь только при морфологическом изучении операционного препарата или патологоанатомическом исследовании.
Характеристика периферического рака:
а) круглая или узловатая опухоль наиболее часто встречается в виде шаровидного образования в ткани легкого, реже — в виде уплотнений неправильной формы. По клиническому течению и особенностям диагностики данные опухоли делятся на 2 группы: связанные с просветом бронха и не связанные с просветом бронха. Выделяют также полостную форму периферического рака, которая характеризуется наличием полости распада опухоли;
б) пневмониеподобный рак не имеет четких границ, по клинико-рентгенологическим данным напоминает пневмонию с локализацией в сегменте или доле легкого;
в) рак верхушки легкого локализуется в апикальной части легкого с тенденцией к врастанию и разрушению I и II ребер и поперечных отростков шейных и верхнегрудных позвонков. Для этой опухоли характерен клинический синдром (боли в области плечевого сустава и плеча, прогрессирующая атрофия мышц дистальных отделов предплечья и синдром Горнера), впервые описанный американским рентгенологом Н. Pancoast в 1924 г., вследствие чего и опухоль получила название опухоли Панкоста.
Гистологическая классификация опухолей легкого и плевры (Histological typing of lung and pleural tumours, 1999)
1. Эпителиальные опухоли
1.1. Доброкачественные
1.1.1. Папилломы
1.1.1.1. Плоскоклеточная папиллома
1.1.1.1.1. Экзофитная
1.1.1.1.2. Инвертированная
1.1.1.2. Железистая папиллома
1.1.1.3. Смешанная плоскоклеточная и железистая папиллома
1.1.2. Аденомы
1.1.2.1. Альвеолярная аденома
1.1.2.2. Папиллярная аденома
1.1.2.3. Аденомы типа слюнной железы
1.1.2.4. Муцинозная железистая аденома
1.1.2.5. Плейоморфная аденома
1.1.2.6. Другие
1.1.3. Муцинозная цистаденома
1.1.4. Другие
1.2. Преинвазивные поражения
1.2.1. Плоскоклеточная дисплазия. Рак in situ
1.2.2. Атипическая аденоматозная гиперплазия
1.2.3. Диффузная идиопатическая нейроэндокринно-клеточная гиперплазия легкого
1.3. Злокачественные
1.3.1. Плоскоклеточный рак. Вариант
1.3.1.1. Папиллярный
1.3.1.2.Светлоклеточный
1.3.1.3. Мелкоклеточный
1.3.1.4. Базалоидный
1.3.2. Мелкоклеточный рак. Вариант
1.3.2.1. Комбинированный мелкоклеточный рак
1.3.3. Аденокарцинома
1.3.3.1. Ацинарная
1.3.3.2. Папиллярная
1.3.3.3. Бронхиолоальвеолярный рак
1.3.3.3.1. Без слизеобразования (немуцинозный)
1.3.3.3.2. Муцинозный
1.3.3.3.3. Смешанный муцинозный и без слизеобразования или из клеток промежуточного типа
1.3.3.4. Сóлидная аденокарцинома со слизеобразованием
1.3.3.5. Аденокарцинома со смешанными подтипами
1.3.3.6. Варианты
1.3.3.6.1. Хорошо дифференцированная фетальная аденокарцинома
1.3.3.6.2. Муцинозная (“коллоидная”) аденокарцинома
1.3.3.6.3. Муцинозная цистаденокарцинома
1.3.3.6.4. Перстневидноклеточная аденокарцинома
1.3.3.2.5. Светлоклеточная аденокарцинома
1.3.4. Крупноклеточный рак. Варианты
1.3.4.1. Крупноклеточный нейроэндокринный рак
1.3.4.1.1. Комбинированный крупноклеточный нейроэндокринный рак
1.3.4.2. Базалоидный рак
1.3.4.3. Лимфоэпителиальноподобный рак
1.3.4.4. Светлоклеточный рак
1.3.4.5. Крупноклеточный рак с рабдоидным фенотипом
1.3.5. Железисто-плоскоклеточный рак
1.3.6. Раки с плейоморфными, саркоматоидными или
саркоматозными элементами
1.3.6.1. Раки с веретенообразными и/или гигантскими клетками
1.3.6.1.1. Плейоморфный рак
1.3.6.1.2. Веретеноклеточный рак
1.3.6.1.3. Гигантоклеточный рак
1.3.6.2. Карциносаркома
1.3.6.3. Легочная бластома
1.3.6.4. Другие
1.3.7. Карциноидная опухоль
1.3.7.1. Типичный карциноид
1.3.7.2. Атипичный карциноид
1.3.8. Раки типа слюнной железы
1.3.8.1. Мукоэпидермоидный рак
1.3.8.2. Аденокистозный рак
1.3.8.3. Другие
1.3.9. Неклассифицируемый рак
2. Мягкотканные опухоли
2.1. Локализованная фиброзная опухоль
2.2. Эпителиоидная гемангиоэндотелиома
2.3. Плевропульмональная бластома
2.4. Хондрома
2.5. Кальцифицирующая фиброзная псевдоопухоль плевры
2.6. Врожденная перибронхиальная миофибробластическая опухоль
2.7. Диффузный легочный лимфангиоматоз
2.8. Десмопластическая круглоклеточная опухоль
2.9. Другие
3. Мезотелиальные опухоли
3.1. Доброкачественные
3.1.1. Аденоматоидная опухоль
3.2. Злокачественная мезотелиома
3.2.1. Эпителиоидная мезотелиома
3.2.2. Саркоматоидная мезотелиома
3.2.2.1. Десмопластическая мезотелиома
3.2.3. Бифазная мезотелиома
3.2.4. Другие
4. Смешанные опухоли
4.1. Гамартома
4.2. Склерозирующая гемангиома
4.3. Светлоклеточная опухоль
4.4. Герминогенные опухоли
4.4.1. Тератома зрелая
4.4.2. Тератома незрелая
4.4.3. Другие герминогенные опухоли
4.5. Тимома
4.6. Злокачественная меланома
4.7. Другие
5. Лимфопролиферативные заболевания
5.1. Лимфоидная интерстициальная пневмония (LIP)
5.2. Модулярная лимфоидная гиперплазия
5.3. В-клеточная лимфома MALT-типа (mucosa assotiated tissue) из клеток маргинальной зоны, низкой степени злокачественности
5.4. Лимфоматоидный гранулематоз
6. Вторичные опухоли
7. Неклассифицируемые опухоли
8. Опухолеподобные поражения
8.1. Опухолька
8.2. Маленькие (“minute”) менинготелиоидные узелки
8.3. Лангергансоклеточный гистиоцитоз
8.4. Воспалительная псевдоопухоль (воспалительная миофибробластическая опухоль)
8.5. Локализованная организующаяся пневмония
8.6. Амилоидная опухоль (нодулярный амилоид)
8.7. Гиалинизированная гранулема
8.8. Лимфангиолейомиоматоз
8.9. Микронодулярная гиперплазия пневмоцитов
8.10. Эндометриоз
8.11. Бронхиальный воспалительный полип
8.12. Другие
При центральном раке легкого чаще встречаются плоскоклеточная и мелкоклеточная формы опухоли. Наоборот, аденокарцинома почти в 4 раза чаще наблюдается при периферическом раке. По данным ГУ РОНЦ им. Н.Н. Блохина РАМН (2002), у мужчин преобладает плоскоклеточный рак (77,6%), аденокарцинома встречается относительно редко (17,9%). У женщин аденокарцинома возникает в 4 раза чаще, чем у мужчин, и на ее долю приходится 69,5% больных раком легкого. Диморфный рак характеризуется наличием 2 различных морфологических структур в 1 опухоли (например плоскоклеточный и железистый рак).
Для оценки распространенности рака легкого используется Классификация UICC по системе TNM (5-е издание, 1998), которая позволяет систематизировать различные клинические ситуации, выработать общую тактику лечения, прогнозировать его результаты на основе анатомических параметров опухоли.
Правила классификации
Классификация применима только для рака. Должно быть гистологическое подтверждение диагноза, позволяющее определить морфологический подтип опухоли.
При оценке критериев Т, N и М используются следующие методы:
Т критерий: физикальный осмотр, методы визуализации, эндоскопия и/или хирургическое исследование.
N критерий: физикальный осмотр, методы визуализации, эндоскопия и/или хирургическое исследование.
М критерий: физикальный осмотр, методы визуализации и/или хирургическое исследование.
Анатомические области и части легкого
1. Главный бронх (С34.0).
2. Верхняя доля (С34.1).
3. Средняя доля (С34.2).
4. Нижняя доля (С34.3).
Регионарные лимфатические узлы
Регионарными лимфатическими узлами являются внутригрудные, прескаленные и надключичные.
cTNM клиническая классификация
Критерий Т — первичная опухоль
ТХ — недостаточно данных для оценки первичной опухоли или опухоль доказана только наличием опухолевых клеток в мокроте или промывных водах бронхов, но не выявляется методами визуализации или при бронхоскопии;
Т0 — первичная опухоль не определяется;
Tis — преинвазивная карцинома (carcinoma in situ);
Т1 — опухоль не более 3 см в наибольшем измерении, окруженная легочной тканью или висцеральной плеврой, без видимой инвазии проксимальнее долевого бронха при бронхоскопии (без поражения главного бронха);*
Т2 — опухоль более 3 см в наибольшем измерении или опухоль любого размера, прорастающая висцеральную плевру или сопровождающаяся ателектазом или обструктивной пневмонией, распространяющейся на корень легкого, но не захватывающей все легкое. Проксимальный край опухоли располагается не менее 2 см от карины;
ТЗ — опухоль любого размера, непосредственно переходящая на грудную стенку (включая опухоли верхней борозды), диафрагму, медиастинальную плевру, перикард, или опухоль, не доходящая до карины*, или опухоль с сопутствующим ателектазом или обструктивной пневмонией всего легкого;
Т4 — опухоль любого размера, непосредственно переходящая на средостение, сердце, крупные сосуды, трахею, пищевод, тела позвонков, карину (отдельные опухолевые узлы в той же доле или опухоль со злокачественным плевральным выпотом).**
* Необычные поверхностно распространяющиеся опухоли любого размера, если их инфильтративный рост ограничен стенкой бронха, при распространении на главный бронх классифицируют как Т1.
** Большинство плевральных выпотов, сопутствующих раку легкого, вызваны опухолью. Однако имеются случаи, когда многократные цитологические исследования плевральной жидкости не верифицируют опухолевую природу выпота. Эти данные, наряду с клиническими, позволяют судить о неопухолевой природе выпота, и в этом случае наличие выпота не оказывает влияния на классификацию Т.
Критерий N — регионарные лимфатические узлы
NХ — недостаточно данных для оценки регионарных лимфатических узлов;
N0 — нет признаков метастатического поражения регионарных лимфатических узлов;
N1 — имеется поражение перибронхиальных и/или лимфатических узлов корня легкого на стороне поражения, внутрилегочных лимфатических узлов, включая непосредственное распространение опухоли на лимфатические узлы;
N2 — имеется поражение лимфатических узлов средостения на стороне поражения или бифуркационных узлов;
N3 — имеется поражение лимфатических узлов средостения или корня легкого на противоположной стороне, прескаленных или надключичных лимфатических узлов на стороне поражения или на противоположной стороне;
Критерий М — отдаленные метастазы
MХ — недостаточно данных для определения отдаленных метастазов;
М0 — нет признаков отдаленных метастазов;
Ml — имеются отдаленные метастазы, включая отдельные опухолевые узлы в другой доле.
pTNM патологическая классификация
рТ, pN и рМ критерии соответствуют Т, N и М критериям.
pN — при гистологическом анализе материала из корня легкого или средостения, полученного при лимфаденэктомии, необходимо исследование не менее 6 лимфатических узлов.
G — гистопатологическая дифференцировка
GХ — степень дифференцировки не может быть установлена;
G1 — высокая степень дифференцировки;
G2 — средняя степень дифференцировки;
G3 — низкая степень дифференцировки;
G4 — недифференцированные опухоли.
Таблица 1
Группировка по стадиям
| Occult carcinoma | Tx | N0 | M0 |
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | T1 | N0 | M0 |
| Стадия IB | T2 | N0 | M0 |
| Стадия IIA | T1 | N1 | M0 |
| Стадия IIB | T2 T3 |
N1 N0 |
M0 M0 |
| Стадия IIIA | T1 T2 T3 |
N2 N2 N1, N2 |
M0 M0 M0 |
| Стадия IIIB | Любая T T4 |
N3 Любая N |
M0 M0 |
| Стадия IV | Любая T | Любая N | M1 |
Диагностика рака легкого
Клинические проявления рака легкого
Сопутствующие раку легкого клинические признаки заболевания неспецифичны, весьма вариабельны, и их проявление зависит от распространенности опухоли.
Принято выделять 3 периода развития рака легкого:
1) т.н. биологический период, который охватывает время от начала возникновения опухоли до появления первых рентгенологических ее признаков;
2) доклинический или бессимптомный период, который характеризуется только рентгенологическими и/или бронхоскопическими проявлениями рака;
3) клинический период, когда наряду с рентгенологическими отмечаются также и клинические симптомы заболевания.
Начальные проявления рака легкого в I стадии заболевания, как правило, относятся к биологическому или бессимптомному периоду развития опухоли. Полное отсутствие в это время признаков расстройства здоровья в подавляющем большинстве случаев исключает не только самостоятельное обращение больных за врачебной помощью, но и раннее выявление болезни. Подавляющее число заболевших обращается в лечебные учреждения во II-III стадиях заболевания, но даже в это время клинические проявления рака легкого весьма неоднозначны и неспецифичны.
Клинические проявления зависят от локализации опухоли в легком, существующих анатомических и функциональных нарушений, степени их выраженности, количества и длительности. Необходимо помнить, что различные клинические “маски” рака легкого, под которыми подразумевают симптомы или синдромы, обусловленные вторичными патологическими процессами (опухолевый стеноз бронха, гиповентиляция, пневмония или ателектаз соответствующего участка легкого, очаговый пневмосклероз, бронхоэктазы, плеврит и др.), являются следствием изменений, возникающих в ходе роста первичной опухоли.
По патогенетическому механизму клинические симптомы делятся на первичные, вторичные и общие.
К первичным, или местным относятся проявления, обусловленные первичной опухолью; как правило, это кашель, примесь крови в мокроте (кровохаркание), одышка и боль в груди.
Вторичные симптомы возникают вследствие присоединения осложнений инфекционной природы либо в результате метастатического поражения регионарных лимфатических узлов, отдаленных органов или прорастания соседних структур.
Общие проявления болезни, такие как слабость, снижение трудоспособности, повышенная утомляемость, потеря веса, гипертермия, являются результатом интоксикации организма продуктами жизнедеятельности опухоли или возникают вследствие присоединения воспалительных осложнений со стороны легких и плевры.
Клинические проявления рака легкого в значительной мере определяются калибром пораженного бронха, анатомическим типом роста опухоли, ее взаимоотношением с просветом бронха, степенью нарушения бронхиальной проходимости, характером сопутствующих осложнений и метастазирования. Качественный состав клинических признаков, первичных и вторичных симптомов рака легкого практически одинаков при центральной и периферической локализации, однако при центральной локализации (при эндобронхиальном экзофитном характере роста) — первичные и вторичные симптомы (ателектаз, гиповентиляция, обтурационный пульмонит, обтурационная пневмония) могут быть относительно ранними признаками заболевания и выражены наиболее ярко. При периферическом раке опухоль длительное время протекает бессимптомно или клинические симптомы стерты, что приводит к поздней диагностике.
Физикальное исследование
При малых размерах первичной опухоли данные наружного осмотра, пальпации, перкуссии, аускультации могут быть нормальными. При физикальном исследовании необходимо обратить особое внимание на лимфатические узлы в области прескаленного пространства шеи, локальные усиливающиеся боли при пальпации, на появление каких-либо новообразований на коже или под кожей, изменения со стороны невралгического статуса, звучность голоса.
Центральный рак
Особенности клинической картины центрального рака легкого в значительной мере определяются калибром пораженного бронха, темпом и направлением роста опухоли, анатомическим типом новообразования и степенью нарушения бронхиальной проходимости, которую подразделяют следующим образом:
1 степень — частичная закупорка бронха;
2 степень — клапанный или вентильный бронхостеноз;
3 степень — окклюзия или полная закупорка бронха.
Рост опухоли в просвет бронха приводит к его частичному сужению (I-II степень бронхостеноза). Клиническая картина либо отсутствует, либо больного беспокоит кашель со слизистой или слизисто-гнойной мокротой. При окклюзии бронха опухолью и воспалительно-измененной, отечной слизистой оболочкой в соответствующем сегменте развивается либо ателектаз, либо обтурационный пневмонит. Последний характеризуется ярко выраженными и характерными вторичными симптомами центрального рака легкого: кашлем, болью в груди, повышением температуры. Ателектаз, не осложненный воспалительными изменениями, имеет стертую клиническую картину.
Перибронхиальная узловая форма, являясь самой частой в группе центрального рака (примерно 1/3 случаев), не сопровождается на начальных стадиях ярко выраженной клинической картиной, как при эндобронхиальном варианте опухоли, поскольку нарушение бронхиальной проходимости развивается медленно. В клинической картине могут преобладать умеренный, постоянный кашель, боли в грудной клетке, субфебрильная температура по вечерам. Однако при развитии окклюзии бронха клиническая картина соответствует обструктивному пневмониту.
Перибронхиальная разветвленная форма центрального рака не сопровождается образованием опухолевого узла, а растет в виде диффузного инфильтрата вокруг бронхов, поражая при этом их стенку, перибронхиальную клетчатку и паренхиму легкого. Она представляет наибольшие трудности для диагностики, т.к. не имеет четко выраженной клинической картины и протекает по типу хронической пневмонии или хронического бронхита. Ведущими симптомами являются длительно существующий, изнурительный кашель со слизистой или слизисто-гнойной мокротой, периодический подъем температуры до субфебрильных цифр, боль в грудной клетке, которая по мере вовлечения в процесс расположенных в перибронхиальной клетчатке нервов и прогрессирования воспалительных изменений в бронхах, легком и плевре усиливается; может наблюдаться примесь крови в мокроте. Эта форма центрального рака легкого наиболее трудна для рентгенодиагностики, поскольку бронхи длительное время проходимы, а при томографии опухолевый узел на фоне уплотненной легочной ткани не выявляется. Зачастую правильный диагноз ставится на этапе метастатического поражения лимфатических узлов или отдаленных органов, либо метастатического плеврита.
Периферический рак
Особенностью клинической картины “круглой” формы периферического рака легкого является длительное, бессимптомное скрытое течение заболевания, т.к. опухоль располагается в периферических отделах легкого, часто субплеврально, не вызывая при этом каких-либо симптомов. Для выявления скрыто протекающего периферического новообразования широко применяют профилактическое флюорографическое обследование, которое позволяет диагностировать новообразования в диаметре более 1 см.
Первые признаки болезни проявляются тогда, когда опухоль увеличивается и прорастает в довольно крупные бронхи (2–3–4 порядка), плевру, грудную клетку, прилежащие органы, обусловливая легочные признаки заболевания.
Распад опухоли может сопровождаться кашлем с мокротой различного характера, примесью крови в ней, повышением температуры тела, однако нередко при этом симптомы вообще могут отсутствовать.
Внелегочные проявления заболевания могут быть обусловлены метастазами в отдаленные органы.
В целом симптомы периферического рака идентичны клиническим проявлениям центрального поражения. Ведущими среди них являются кашель, боль в грудной клетке, повышение температуры, кровохаркание.
Особенности клинической картины рака верхушки легкого (опухоль Панкоста) определяются инфильтрацией прилежащих органов и нервных стволов. Нередко первым симптомом при этом является боль в верхней части плеча или плечевом поясе, которая затем распространяется по локтевой стороне (при прорастании шейно-плечевого сплетения). Боли в межлопаточном пространстве и на передней поверхности грудной полости появляются позднее, при прорастании межреберных нервов и задних отрезков II-IV ребер, что нередко выявляется при рентгенологическом исследовании. При прорастании спинномозговых нервов CVII-ThI-II появляются слабость мышц кисти, парестезии или расстройства чувствительности участков кисти и предплечья, иннервируемых срединным нервом. В связи с поражением нижних шейных симпатических ганглиев часто наблюдается полный или неполный синдром Горнера. Вовлечение в опухолевый процесс возвратного нерва (справа) может сопровождаться охриплостью.
Пневмониеподобная форма периферического рака легкого встречается значительно реже и характеризуется своеобразным клиническим течением. Отмечается инфильтрирующий рост опухоли, которая развивается, как правило, на уровне альвеол и терминальных бронхиол и в процессе увеличения объема заполняет рядом расположенные альвеолы. Междолевая, костальная, медиастинальная и диафрагмальная плевра длительное время ограничивает распространение опухоли на соседние доли. В процессе роста и распространения новообразования в нем могут развиваться некрозы с распадом ткани и формированием полостей. Клиническая и рентгенологическая картины при этом напоминают вялотекущую, не поддающуюся антибактериальной терапии пневмонию. Пневмониеподобный рак легкого сопровождается кашлем, болями в грудной клетке. При вовлечении обширных участков легочной паренхимы и развитии экссудативного (или метастатического) плеврита больных беспокоит одышка. По мере развития процесса присоединяются общие признаки интоксикации — слабость, недомогание, похудание. В зависимости от выраженности воспалительных изменений и их обострения отмечается субфебрильная температура с периодическими подъемами до 39–40°C. Эта анатомическая форма рака легкого встречается, как правило, у женщин и по гистологическому строению в основном является высокодифференцированной аденокарциномой. Установить правильный диагноз чрезвычайно сложно, поскольку и клиническая, и рентгенологическая картины, включая томографию, не позволяют выявить опухолевый узел в легком. Диагноз в большинстве наблюдений удается уточнить после обнаружения метастатического поражения внутригрудных или периферических лимфоузлов либо при получении клеток аденокарциномы в плевральном экссудате. Они могут быть выявлены и в результате бронхоскопии, которую применяют в большинстве случаев, к сожалению, слишком поздно.
Атипичные формы рака легкого
Сюда относятся редко встречающиеся случаи, когда клинические проявления проявляются метастатическим поражением отдаленных органов или массивным внутригрудным лимфогенным метастазированием с синдромом сдавления верхней полой вены. При этом полностью отсутствуют признаки поражения легких, т. е. прижизненная диагностика рака легкого у этих больных невозможна, на аутопсии не во всех случаях удается найти очаг поражения в легком. Поэтому диагноз атипичной формы рака легкого устанавливается на основании гистологического заключения и путем исключения других источников метастазирования. Особенность клинической картины при этом определяется характером поражения определенного органа. Наиболее часто встречаются такие формы, как медиастинальная, костная, мозговая, печеночная. Как видно, этот перечень отражает лимфо- и гематогенное метастазирование рака в соответствующий орган.
Медиастинальная форма обусловлена массивным метастатическим поражением лимфатических узлов. Как правило, преобладает односторонняя локализация метастазов, что можно установить и клиническим, и рентгенологическим методами. Вследствие сдавления органов грудной клетки развивается компрессионный медиастинальный синдром. Наиболее ярким и часто встречающимся проявлением последнего является синдром сдавления верхней полой вены. Для него характерны цианоз и отек лица, шеи и области верхнего плечевого пояса, что больше выражено утром, развитие коллатеральной венозной сети под кожей передней грудной и брюшной стенок, шеи и верхнего плечевого пояса.
При костной форме клиническая картина обусловлена метастазом или метастазами в кости. Солитарный метастаз проявляется локальной болью, при множественных — боли рассеяны в зависимости от расположения очагов поражения или иррадиируют при метастазировании в позвоночник соответственно зонам иннервации. Следует отметить, что на ранних этапах развития метастазов в кости рентгенологически они могут не выявляться и только радиоизотопное исследование скелета позволяет зафиксировать их за 4–6 мес до момента рентгенологической визуализации.
Мозговая форма проявляется неврологическими симптомами и часто больные по жизненным показаниям оперируются с диагнозом “опухоль головного мозга”. Только интраоперационно или по результатам планового морфологического исследования уточняется диагноз метастаза и в дальнейшем выявляется рак легкого.
Рак легкого зачастую проявляется затяжной или рецидивирующей пневмонией.
Паранеопластические синдромы
Рак легкого наряду с новообразованиями других локализаций (помимо опухолей эндокринных органов) способен синтезировать биологически активные вещества, которые проявляют себя своеобразными клиническими синдромами и симптомами. Некоторые из этих синдромов сопровождаются выраженными электролитными и другими метаболическими нарушениями, приводящими к гиперкальциемии, гипокалиемии, гипонатриемии, алкалозу, которые, несомненно, требуют медикаментозной коррекции.
Источником гормонально активных веществ или гормонов являются клетки опухоли, гистогенетически относящиеся к APUD-клеткам. Опухоли из этих клеток или имеющие их в своем составе называются APUDомами и могут локализоваться в любом органе. APUDомы и служат причиной эктопической секреции гормонально активных веществ при раке легкого.
Рак легкого обладает способностью продуцировать следующие гормоны: АКТГ, АДГ, ТТГ, МСГ, ПТГ, соматотропин, инсулин, глюкатон, пролактин, окситоцин.
Основные эктопические синдромы, в зависимости от гистологической структуры опухоли легкого, представлены в таблице 2. Надо отметить, чем ниже степень гистологической дифференцированности опухоли, тем больше ее потенциальная возможность продуцировать гормоны.
Таблица 2
Эктопические эндокринные синдромы при раке легкого
| Клинический синдром | Продуцируемый гормон | Гистологическое строение опухоли |
| Иценко-Кушинга | АКТГ | Овсяноклеточный рак |
| Шварца | АДГ | Овсяноклеточный рак |
| Гиперпаратиреоидизм | АДГ | Овсяноклеточный рак |
| Гинекомастия | ПТГ | Плоскоклеточный рак |
| Остеоартропатия | ФСГ СТГ |
Крупноклеточный рак Аденокарцинома |
Для клинических проявлений эктопической секреции АКТГ при раке легкого характерны выраженная мышечная слабость, повышение АД, отеки. Ожирение, лунообразное лицо, пигментированные полосы, гирсутизм, остеопороз, гипертония, диабет развиваются не у всех больных. Иногда синдром гиперкортицизма сопровождается гиперпигментацией за счет секреции опухолью наряду с АКТГ и МСГ. Наиболее характерным признаком синдрома секреции АКТГ при раке легкого является тяжелый гипокалиемический алкалоз с развитием судорог и комы. Необходимо отметить, что гормональная активность опухоли не зависит от ее размеров. Примерно у половины больных клинических признаков не отмечается. Наличие синдрома Иценко — Кушинга является неблагоприятным прогностическим признаком. Как правило, у большинства этих пациентов операция невозможна.
Причины развития нервно-мышечных и кожных паранеопластических синдромов при раке легкого, как и при других злокачественных новообразованиях, в настоящий момент неясны. Возникновение этих синдромов может быть непосредственно не связано с появлением опухоли, они могут появляться за несколько месяцев или даже лет до возникновения симптомов рака легкого. Успешное удаление новообразования наряду с исчезновением этих проявлений может не оказывать на них никакого влияния.
Клинические аспекты рентгенодиагностики
Рентгенологический метод является одним из основных в диагностике рака легкого, на основании его строится дальнейший план обследования.
Рентгенологическая семиотика центрального рака
Рентгенологическая картина обусловлена первичной бронхогенной опухолью, калибром пораженного бронха и степенью нарушения бронхиальной проходимости, воспалительными осложнениями, реактивной гиперплазией или метастатическим поражением регионарных лимфатических узлов, отдаленным метастазированием.
Рентгенологическая семиотика эндобронхиального рака
При минимальных размерах и глубине инвазии первичной опухоли рентгенологические и клинические симптомы отсутствуют: тень опухоли не видна, просвет бронха свободен, легочное поле прозрачно.
Возникновение частичного сужения просвета бронха свидетельствует о I степени нарушения бронхиальной проходимости. На этом этапе возможны минимальные клинические проявления, при рентгеноскопии и обзорной рентгенографии грудной клетки опухоль не видна. На рентгенограмме определяется гиповентиляция участка легкого, который дренируется пораженным бронхом, в виде уменьшения прозрачности и объема легочной ткани, сгущения сосудистого рисунка, расширения сосудов. Томографическое исследование в этот момент может обнаружить опухоль либо главного, либо долевого бронхов.
II степень нарушения бронхиальной проходимости является следующим этапом развития опухоли и характеризуется клапанной эмфиземой сегмента, доли или всего легкого. Рентгеноскопия или обзорная рентгенография тени опухоли не выявляет. Отмечается увеличение прозрачности и объема вовлеченной в патологический процесс легочной ткани, обеднение легочного рисунка. Более вероятно обнаружение тени первичной опухоли при целенаправленном томографическом исследовании.
III степень нарушения бронхиальной проходимости характеризуется следующими рентгенологическими данными: легочная ткань в состоянии ателектаза треугольной формы, зона ателектаза соответствует сегменту (или доле, или легкому) в зависимости от калибра пораженного бронха (рис. 1). Объем легочной ткани резко уменьшен, вследствие чего отмечается смещение междолевых щелей и сосудистых стволов в соседних отделах. Присоединение пневмонии, распада легочной ткани или опухоли, наличия метастазов в регионарных лимфатических узлах или их гиперплазия, метастатический или воспалительный плеврит дополняют рентгенологическую картину неоднородным затемнением легочной ткани в проекции пораженного сегмента или доли, ячеистыми просветлениями, расширением корня и полицикличностью его контуров, наличием жидкости в плевральной полости. Тень первичной опухоли может выявиться при обзорной рентгенографии. При томографическом исследовании просвета бронха определяется картина “культи” или “ампутации” бронха, возможна также оценка легочной ткани в спавшейся доле или сегменте.
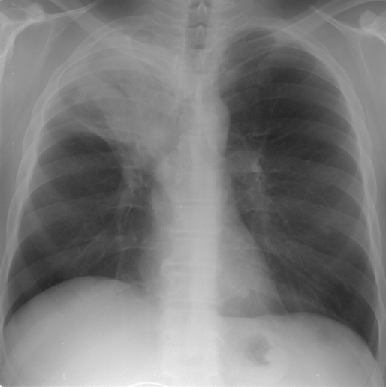
Рисунок 1. Центральный рак верхней доли правого легкого с ателектазом доли
Рентгенологическая семиотика экзобронхиального рака
Опухоль растет снаружи от стенки бронхов. При локализации в прикорневой зоне новообразование может не дифференцироваться до тех пор, пока его размер не станет больше диаметра крупных ветвей легочной артерии или вен. На ранних этапах развития при рентгенологическом исследовании может быть выявлен опухолевый узел диаметром около 1 см. Отчетливое его изображение, связанное со стенкой бронха, может быть получено при томографии в плоскости корня легкого. При прорастании стенки бронха и нарушении бронхиальной проходимости I, II и III степени происходит типичное чередование рентгенологических изменений, как и при эндобронхиальном типе, с выявлением тени опухоли, связанной со стенкой бронха.
Вследствие интимного взаимоотношения первичной опухоли с элементами корня легкого и, в частности, с легочной артерией или ее крупными ветвями при сдавлении их опухолевым узлом может наблюдаться значительное обеднение легочного рисунка при неизменном объеме легочной ткани. Легкие становятся более прозрачными, а теневое изображение корня изменяется, несмотря на наличие опухолевого узла (феномен “парадоксального корня”). Корень противоположного легкого за счет компенсаторной гиперемии расширяется, а легочный рисунок в здоровом легком усиливается.
Поскольку при перибронхиальной узловой форме выражена тенденция к лимфогенному метастазированию, то нередко видимая тень в легком представлена первичным опухолевым узлом, слившимся с увеличенными лимфатическими узлами (гиперплазия или метастатическое поражение). Тень в области корня при этом имеет полициклические контуры. По мере роста первичный опухолевый узел теряет четкие контуры, появляются признаки опухолевой инфильтрации перибронхиальной клетчатки и ткани легкого в виде тяжистых теней и утолщения стенки бронха.
Рентгенологическая семиотика перибронхиального рака
Нередко опухолевый узел первоначально имеет тенденцию инфильтративного роста, распространяясь по ходу бронхов и сосудов. По мере роста и образования опухолевых муфт вокруг сегментарных и долевых бронхов отмечается усиление легочного рисунка. В последующие фазы развития заболевания грубые тяжистые тени веерообразно отходят от корня в ткань легкого. При томографии выявляется равномерное утолщение стенок сегментарных и/или долевого бронхов.
Рентгенологическая семиотика других форм рака
Медиастинальная форма рака легкого имеет определенные особенности рентгенологической картины, которые необходимо учитывать при дифференциальной диагностике с лимфопролиферативными заболеваниями, изменениями внутригрудных лимфатических узлов неопухолевой природы. Эти особенности не являются абсолютно достоверными, но в ряде случаев позволяют предположить правильный диагноз. К ним относятся:
1) гомолатеральное увеличение лимфатических узлов средостения или корня легкого;
2) при медиастинальной форме рака легкого чаще развивается компрессионный медиастинальный синдром, чем при метастатическом поражении внутригрудных лимфатических узлов опухолями экстраторакальных локализаций;
3) возраст больных раком легкого, в т.ч. медиастинальной формой, как правило, старше 40 лет.
Увеличение внутригрудных узлов, выявляемое при рентгенологическом исследовании, может свидетельствовать об их метастатическом поражении или воспалительной гиперплазии, особенно в случаях, осложненных обтурационной пневмонией. С другой стороны, отсутствие их увеличения не является гарантией отсутствия метастазов, поэтому трактовка рентгенологической картины не может быть однозначной.
Рентгенологическая семиотика периферического рака
Рентгенологическое исследование более информативно при периферическом раке легкого и позволяет с определенной уверенностью диагностировать его примерно у 90% больных; выявить эту форму опухоли при профилактическом обследовании и бессимптомном течении.
Периферический рак на начальных этапах развития редко имеет округлую или неправильно-округлую форму. Опухолевый узел размером 1–1,5 см имеет чаще полигональные контуры с разными по протяженности сторонами, но по мере роста приобретает округлые формы. Для него характерны признаки инфильтративного роста в виде коротких тяжей (“усиков”, “щеточек”, “спикул”, “шипов”) по контуру опухоли, уходящих в легочную ткань, они служат опорными рентгенологическими симптомами в проведении дифференциальной диагностики с доброкачественными новообразованиями.
Типичными рентгенологическими признаками периферического рака можно считать неправильную шаровидную форму, бугристые, лучистые контуры, неоднородность тени, измененный легочный фон.
Наибольшие трудности для диагностики представляют пневмониеподобные и полостные формы периферического рака легкого (рис. 2).
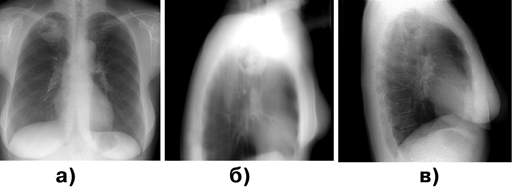
Рисунок 2. Периферический рак верхней доли правого легкого, полостная форма:
а — прямая проекция; б — боковая проекция; в — томограмма
Характерные черты рака верхушки легкого дополняют рентгеносемиотику периферического рака:
1) не прослеживается верхняя граница опухоли;
2) часто наблюдается деструкция задних отрезков II, III и IV ребер от узурации до полного разрушения их на большом протяжении;
3) возможно разрушение поперечных отростков или узурация боковых поверхностей тел верхних грудных позвонков.
Рентгеновская компьютерная томография (спиральная или многосрезовая)
Это исследование можно считать золотым стандартом в оценке местной и регионарной распространенности рака легкого. Метод можно использовать для полноценного исследования грудной клетки, брюшной полости, головного мозга, таза и скелета, что позволяет исключить генерализацию опухолевого процесса. Информативность КТ грудной клетки может быть повышена за счет внутривенного контрастирования, что обеспечивает четкую визуализацию всех сосудистых элементов средостения, их соотношение с опухолевыми массами, позволяет выявить особенности васкуляризации опухоли.
К ограничениям метода нужно отнести трудности при дифференциальной диагностике лимфогенных метастазов и реактивной гиперплазии лимфатических узлов корневых зон и средостения.
Магнитно-резонансная томография (МРТ)
Позволяет получать серии высококачественных изображений целой анатомической области. МРТ позволяет дифференцировать даже незначительные различия структуры тканевых элементов.
К основным достоинствам МРТ следует отнести возможность получения масштабных изображений в любой произвольно определяемой плоскости. Это повышает наглядность отображения патологического процесса в сложных анатомических областях и облегчает топическую диагностику. Именно эти возможности обеспечивают исключительно высокую информативность МРТ при оценке местной распространенности рака легкого. МРТ значительно облегчает пространственное восприятие топографии опухоли и позволяет оценить вовлечение смежных органов и структур. МРТ можно использовать при центральной и медиастинальной формах рака легкого для оценки взаимоотношения элементов средостения и опухоли.
Позитронная эмиссионная томография (ПЭТ)
Применение ПЭТ в диагностике рака легкого представляется многообещающим. ПЭТ подразумевает получение изображений пространственно-временного распределения позитрон-излучающих меченных соединений. 18F-Диоксиглюкоза после в/в введения захватывается преимущественно опухолевыми клетками, что создает условия для визуализации пораженных органов и тканей, которые представляют собой очаги повышенного накопления радионуклидного препарата.
Бронхоскопия
Фибробронхоскопия является важнейшим методом в диагностике рака легкого, поскольку позволяет выяснить морфологическую структуру опухоли, уточнить ее распространение по бронхиальному дереву и, отчасти, регионарным лимфатическим узлам, форму опухолевого роста.
Современные фибробронхоскопы имеют большие разрешающие возможности. Для осмотра доступны, помимо главных, долевые и сегментарные бронхи IV порядка, 86% бронхов V порядка, 56% бронхов VI порядка. Биопсия под контролем зрения выполняется из всех сегментарных, 76% бронхов IV порядка (субсегментарных) и в 38% из бронхов V порядка. Помимо описания визуальной картины обязательным условием этого исследования является взятие материала для морфологической оценки изменений (путем смыва, аспирации, браш-биопсии, слонг-биопсии, кюретажа, мазков-отпечатков, биопсии для гистологического исследования).
Значительно расширяет возможности диагностики направленная катетеризация бронхов с целью взятия материала под контролем рентгенологического исследования.
Перспективной методикой выявления очагов внутриэпителиального и инвазивного рака бронхов небольших размеров является определение флюоресценции гематоморфина, который накапливается в опухоли в концентрации, превышающей таковую в нормальных тканях в 10 раз.
Различают прямые и косвенные, анатомические и функциональные бронхоскопические признаки рака легкого.
К прямым относятся:
— бугристые, грибовидные, папилломатозные, гранулематозные, полиповидные опухоли различного цвета и размера;
— плоские, бугристые, с гладкой или шершавой поверхностью инфильтраты. Триада Икеды: инфильтраты с расширением сосудов + размытый рисунок хрящей + разрастание бесформенной мягкой бело-желтой или розово-желтой ткани. Сужение просвета бронха эксцентрического, реже концентрического характера с ригидностью и стертым рельефом хрящей.
Косвенными прямыми признаками являются: седлообразная, утолщенная картина бифуркации; уплотнение стенки бронха при инструментальной пальпации, деструкция гребня межсегментарной и субсегментарной шпоры; рыхлая, отечная с локальной гиперемией, легко кровоточащая слизистая оболочка; стертость рисунка хрящей с вдавлением в просвет 2–3 колец; ограниченное расширение сосудов петлеобразного характера; резко ограниченная зона гиперемии слизистой оболочки.
Косвенные функциональные признаки: неподвижность стенок трахеи и бронхов; локальное выпячивание мембранозной части при ограниченной респираторной подвижности; синдром “мертвого устья” — отсутствие смещения в устьях сегментарных и субсегментарных бронхов капелек секрета и респираторной подвижности; отсутствие передаточной пульсации сердца и крупных сосудов, пассивной смещаемости бронха; неподвижность одной из половин гортани.
Прямые и косвенные признаки рака легкого являются абсолютным показанием к биопсии и морфологическому исследованию.
Задачи морфологической верификации диагноза и оценки распространенности опухолевого процесса, как правило, решаются в условиях специализированных онкологических лечебных учреждений.
Морфологическая верификация рака легкого
Материал для гистологического и цитологического исследования с целью морфологической верификации рака легкого можно получить при фибробронхоскопии, трансторакальной игловой биопсии, медиастиноскопии, диагностической торакоскопии, диагностической торакотомии.
Бронхоскопия
Этот метод наиболее эффективен в диагностике центрального рака легкого, т.к. позволяет оценить прямые и косвенные признаки, определить проксимальную границу опухоли, выявить ее отсевы на слизистой бронхов, трахеи и одновременно взять материал для морфологического исследования.
Гистологическое и цитологическое изучение биопсийного материала позволяет подтвердить морфологический диагноз у 70–99% больных в зависимости от анатомической формы роста опухоли и стадии заболевания. При периферической опухоли результативность бронхологических методов в плане морфологической верификации диагноза значительно ниже.
Трансторакальная игловая биопсия
Трансторакальная игловая биопсия является инвазивным (хирургическим) методом исследования, который используют в диагностике периферического рака легкого. Игловую биопсию следует выполнять при солитарных интрапульмональных образованиях, только в случаях неудачи эндобронхиальной биопсии, при локализации их, как правило, в плащевой зоне легкого, при множественных интрапульмональных шаровидных тенях диаметром более 1 см; при диссеминированных мелкоочаговых и ретикулярных затемнениях легкого, при медиастинальных образованиях, не доступных классической и расширенной медиастиноскопии.
При отрицательных результатах бронхоскопии с биопсией трансторакальная пункция может подтвердить диагноз у 76–88% больных с периферической локализацией новообразования.
Медиастиноскопия
Оперативное эндоскопическое исследование, выполняемое для изучения паратрахеальных, загрудинных и бифуркационных лимфатических узлов. Производится под интубационным наркозом в операционной, в стерильных условиях. Медиастиноскоп вводят через разрез в яремной вырезке, проникают в верхнее средостение, ориентируясь на переднюю поверхность трахеи.
Показаниями к применению метода являются внутригрудные аденопатии с преимущественным поражением лимфатических узлов паратрахеальной, трахеобронхиальной, бифуркационной групп, труднодоступных для биопсии. При раке легкого это исследование приобретает особое значение для уточнения состояния контрлатеральных лимфатических узлов, особенно в тех случаях, когда имеются рентгенологические данные об их увеличении.
Абсолютным противопоказанием к ней в связи с возможностью кровотечения является синдром сдавления верхней полой вены. К другим осложнениям относятся подкожная эмфизема, пневмоторакс, нагноение раны, повреждение перикарда, возвратного нерва. Возможны летальные исходы.
Диагностическая торакоскопия
Если совокупность проведенных исследований не позволяет с полной достоверностью исключить рак легкого, то вполне оправдано выполнение в качестве завершающего этапа диагностической торакоскопии (видеоторакоскопия). Это — оперативное эндоскопическое исследование, выполняемое для исследования периферических новообразований, диффузных поражений легкого, медиастинальных лимфатических узлов. Проводится под интубационным наркозом с однолегочной вентиляцией в операционной, в стерильных условиях.
Во время торакоскопии выполняется срочная биопсия, (в т.ч. тотальная) из основного очага поражения легкого и регионарных лимфатических узлов. Индивидуально, в соответствии с данными срочного морфологического исследования избирается дальнейшая лечебная тактика.
Диагностическая торакотомия
В некоторых случаях, когда диагноз не может быть установлен вышеперечисленными методами и нельзя исключить рак легкого, показана диагностическая торакотомия. Окончательный объем операции определяется после ревизии и срочного морфологического (гистологического, цитологического) исследования. Чаще (8–12%), планируемая операция заканчивается диагностической торакотомией из-за выявления нерезектабельной опухоли.
Определение распространенности рака легкого
Является важнейшей диагностической задачей, которая решается на всех этапах диагностики, начиная с физикального осмотра больного. Применение современных методов (бронхоскопия, УЗ, КТ, МРТ, радиоизотопные исследования, ПЭТ) позволяет выбрать оптимальную лечебную тактику у подавляющего числа больных.
Современная лечебная тактика при раке легкого
Клиническое стадирование cTNM с использованием современных диагностических возможностей является основополагающим (с учетом функциональных возможностей пациента) в выборе тактики лечения больного.
Патологическое или послеоперационное стадирование pTNM является более точным, заключительным. Оно позволяет при необходимости дополнить хирургическое лечение лучевой или лекарственной противоопухолевой терапией, скорректировать сроки мониторинга и является основой последующего изучения результатов различных методов лечения и других исследуемых показателей.
Морфологически рак легкого неоднороден, но преобладающим гистологическим типом (до 80%) является немелкоклеточный рак легкого (НМРЛ) (плоскоклеточный, железистый, крупноклеточный). Мелкоклеточный рак (МРЛ) в силу биологических особенностей течения и иных подходов к лечебной тактике выделяется в отдельную группу.
Лечение больных немелкоклеточным раком легкого
Клинико-биологические особенности НМРЛ (разнообразие гистологических форм; отчетливо выраженная способность к распространению как лимфогенным, так и гематогенным способом) делают возможным достижение стойкого успеха при лечении этого заболевания только тогда, когда опухолевый процесс не вышел за пределы пораженного органа и ближайших зон регионарного метастазирования. Поэтому естественно ожидать благоприятных результатов лечения при выявлении опухоли на ранних стадиях. К сожалению, в основном (70–80%) НМРЛ выявляется при значительном местно-регионарном распространении и наличии отдаленных метастазов. В США 5-летняя выживаемость среди заболевших составляет 13%. Если в момент выявления опухоль носит локальный характер, этот показатель повышается до 47%, но такая распространенность заболевания определяется лишь у 15% заболевших.
Общепринятыми методами лечения больных НМРЛ сегодня являются хирургический, лучевой, лекарственный и их комбинации.
Однако НМРЛ малочувствителен к существующим консервативным (лекарственному и лучевому) методам лечения; и только 10–20% из вновь заболевших могут быть оперированы, из них радикальная операция возможна у 70–80% больных.
Хирургический метод лечения НМРЛ остается до сих пор единственно радикальным.
Именно поэтому прежде всего рассматривается вопрос о его использовании, и при отсутствии общеизвестных противопоказаний к операции, связанных с распространенностью опухоли или сниженными функциональными резервами, предпочтение отдается хирургическому методу. Онкологически адекватными являются операции в объеме пневмонэктомии и лобэктомии с систематической медиастинальной ипсилатеральной лимфодиссекцией (полноценное, выполняемое всегда удаление клетчатки с лимфатическими узлами переднего, заднего, верхнего и нижнего средостения на стороне поражения независимо от локализации опухоли в легком и размеров лимфоузлов), позволяющей повысить радикальность хирургического вмешательства, а также объективизирующей распространенность опухолевого процесса. В силу необходимости соблюдения радикализма эти операции могут дополняться резекцией соседних органов при их поражении (грудной стенки, диафрагмы, крупных сосудов верхней полой вены, легочной артерии, аорты и ее ветвей, предсердия, перикарда, бифуркации трахеи, пищевода и т.д.) (см. рис. 3–6 на цветной вклейке).
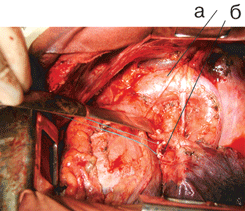
Рисунок 3. Вид послеоперационной раны после верхней лобэктомии слева с систематической медиастинальной лимфодиссекцией:
а — дуга аорты, б — культя верхнедолевого бронха
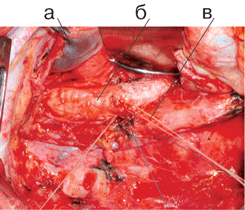
Рисунок 4. Вид послеоперационной раны после пневмонэктомии справа с систематической медиастинальной лимфодиссекцией:
а — ВПВ с культей v. Azygos; б — трахея (ручная бескультевая обработка места отхождения бронха); в — аорта
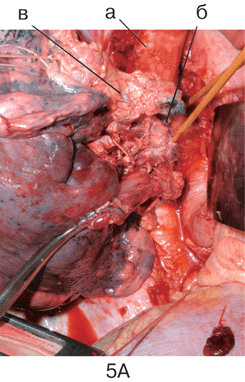
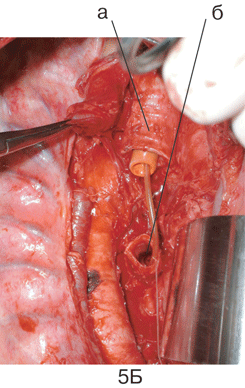
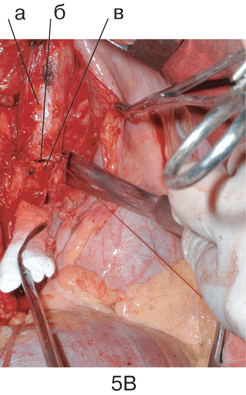
Рисунок 5. Этапы пневмонэктомии справа с циркулярной резекцией бифуркации трахеи
А. Мобилизация бифуркации трахеи: а — трахея; б — на держалке левый главный бронх, в — опухолевый конгломерат, в который замурован корень правого легкого.
Б. Вид операционной раны после удаления правого легкого и бифуркации трахеи, дыхание больного осуществляется через катетер высокочастотной вентиляции, проведенный в левый главный бронх: а – трахея; б — левый главный бронх.
В. Формирование анастомоза (б) между трахеей (а) и левым главным бронхом (в)
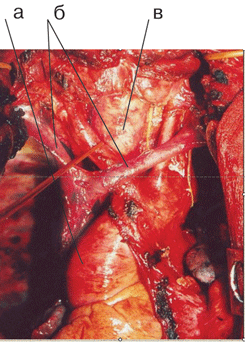
Рисунок 6. Вид послеоперационной раны после систематической медиастинальной билатеральной лимфодиссекции:
а- дуга аорты с отходящими ветвями; б – левая и правая плечеголовные вены, сливающиеся в ВПВ; в – трахея
Лучевая терапия НМРЛ проводится по радикальной (СОД не менее 60 Гр) или паллиативной программам. Радикальная лучевая терапия операбельных опухолей является альтернативой хирургическому лечению при отказе от операции из-за сниженных функциональных резервов или других причин. Роль паллиативной лучевой терапии сводится к облегчению клинических проявлений опухоли. Использование лучевой терапии как с неоадъювантной, так и с адъювантной целями является предметом клинических исследований.
Химиотерапия — целесообразность ее использования (из-за низкой чувствительности опухоли к цитостатикам) в лечении НМРЛ сегодня уже не является предметом дискуссий. Внедрение в клиническую практику препаратов платины (цисплатин, карбоплатин), этопозида, таксанов, винкаалкалоидов, гемцитабина, иринотекана изменил возможности лекарственного лечения как местно-распространенных, так и диссеминированных форм НМРЛ. Сегодня активно изучаются вопросы комбинированного лечения с использованием неоадъювантной и адъювантной химиотерапии.
В настоящее время тактика лечения определяется в соответствии со стадией опухолевого процесса.
Стадия 0 (TisN0M0)
Пациенты с неинвазивной карциномой легкого нуждаются в хирургическом лечении с максимальной экономией легочной ткани. Возможно применение лобэктомии или экономной резекции в объеме сегментэктомии с удалением обязательно бронхопульмональных регионарных лимфатических узлов.
Стадия IA, В (T1N0M0; T2N0M0)
Ведущим методом лечения этой группы пациентов является хирургический в объеме лобэктомии. При заинтересованности устья долевой или дистальной части главного или проксимальной части промежуточного бронха может быть выполнена бронхопластическая операция.
Использование сегментэктомии и тем более клиновидных резекций легкого не оправдано с онкологических позиций. Как правило, больной, способный перенести торакотомию, может перенести и лобэктомию, как полноценную онкологическую операцию.
При невозможности выполнения оперативного вмешательства следует обсудить вопрос о лучевой терапии (как дистанционной, так и эндобронхиальной), стремясь использовать радикальные суммарные дозы (60–70 Гр). Целесообразность проведения химиотерапии при этой распространенности опухоли пока сомнительна.
Результаты 5-летние хирургического лечения больных IA стадии — 70–80%; IВ стадии — 50–60%.
Стадия IIA (T1N1M0) и II В (T2N1M0 и Т3N0M0)
Основным методом лечения остается хирургический в объеме лоб- или пневмонэктомии, при необходимости, с клиновидной (окончатой) резекцией главного (промежуточного) бронха. Отказ от хирургического лечения может быть обусловлен только тяжестью сопутствующих заболеваний и сниженными функциональными резервами. Альтернативным лечением в этих случаях является химио- и/или лучевая терапия.
После хирургического лечения 5-летняя выживаемость больных II стадии — 30–40%.
Стадия IIIA (Т3N1M0; T1–3N2M0)
Представлена очень разнородной группой больных, куда включены пациенты с различной характеристикой первичной опухоли и метастатическим поражением лимфатических узлов.
Общим для всего многообразия опухолей, включенных в IIIA стадию, является быстрая реализация отдаленного субклинического метастазирования.
Выбор лечебной тактики у больных упомянутой распространенности — наиболее сложная задача. Зачастую больных этой группы можно считать условно операбельными. Если в хирургическом пособии больному не отказано, то лечение этих пациентов должно планироваться с обязательным дополнительным использованием лучевой или химиотерапии.
Последовательность применения этих методов в каждой субкатегории IIIA стадии во многом является предметом научных исследований.
Сегодня широко обсуждается вопрос о проведении неоадъювантной химиотерапии с использованием прежде всего производных платины, гемцитабина, этопозида, таксанов, винорелбина, виндезина, ифосфамида и других препаратов. В ряде исследований показаны объективные эффекты предоперационной химиотерапии.
Объем хирургического вмешательства у пациентов с этой стадией заболевания расширяется, чаще выполняется пневмонэктомия, но возможна и лобэктомия. Это определяется локализацией, размером новообразования, возрастом, общим состоянием, сопутствующей патологией. В то же время увеличивается число паллиативных операций. Зачастую приходится выполнять комбинированные операции с резекцией соседних органов из-за их истинного прорастания, или интимного предлежания к опухоли, или ангио- и/или бронхопластические вмешательства.
Пациентам, не подлежащим по тем или иным причинам хирургическому лечению, следует планировать лучевую терапию по радикальной программе, химиотерапию в самостоятельном варианте или химио-лучевое лечение.
Исследования по изучению адъювантной химиотерапии после радикальных операций сегодня не позволяют высказаться о ее целесообразности.
Выживаемость 5-летняя больных IIIA стадии — 15–20%.
Стадия IIIB (T4N любоеМ0)
Хирургическое лечение у больных НМРЛ IIIB стадии, как правило, не проводится. Лечебная тактика предполагает проведение лучевой химиотерапии или комбинации этих 2 методов. Химиолучевая терапия позволяет достоверно увеличить показатели 2-летней выживаемости на 4%. При этом предпочтение отдается химиотерапии (препаратам платины в комбинации с винорелбином или паклитакселом, или этопозидом, или ифосфамидом, или доксорубицином). При наличии выпота в плевральной полости рекомендуется внутриплевральное введение цитостатиков или склерозирующих препаратов.
Больным с IIIB стадией в неудовлетворительном общем состоянии и невозможностью проведения химиотерапии лечение ограничивается симптоматической и/или паллиативной лучевой терапией с целью облегчения симптомов заболевания.
Выживаемость 5-летняя больных IIIB стадии — менее 10%.
Стадия IV (Т любое N любое M1)
Лечение больных НМРЛ IV стадии следует расценивать только как паллиативное или симптоматическое. Это может быть полихимиотерапия, которая эффективнее монохимиотерапии, химиолучевая или лучевая терапия. Выбор варианта лечения зависит от общего состояния больного, количества и локализации метастазов. Продолжительность лечебных эффектов и выживаемость больных практически одинакова и не зависит от схемы химиотерапии. Больные в удовлетворительном общем состоянии с небольшим числом метастазов имеют, как правило, лучший лечебный эффект.
Химиотерапия распространенного НМРЛ
В последние десятилетия появились новые препараты: таксаны, гемцитабин, винорелбин, иринотекан, топотекан, которые при использовании их в комбинированной химиотерапии с цисплатином (в виде дублетов) увеличили 1-летнюю выживаемость до 40–50% у больных с распространенным НМРЛ (Bunn Р.А., Kelly К., 1998).
Всесторонний анализ больших рандомизированных клинических испытаний за 10 лет, с 1991 по 2001 г., (8468 больных) с целью определения роли химиотерапии при распространенном НМРЛ, показал, что медиана выживаемости была наименьшей в группе 783 больных, получавших лечение одним цисплатином — 7,2 мес, в группе 509 пациентов, лечившихся по схеме цисплатин + этопозид, она равнялась 7,8 мес, а наибольшей медиана выживаемости была в группе больных, получавших цисплатин с новыми цитостатиками — 9,2 мес (Raftopoulos H. et al.).
Метаанализ опубликованной литературы (8 больших клинических испытаний, 3296 пациентов) о влиянии различных режимов химиотерапии в качестве 1-й линии лечения на выживаемость больных НМРЛ III-IV стадий (Baggstrom M.Q. et al.). Авторы отметили, что III поколение современной химиотерапии — комбинация платиновых препаратов с таксанами, гемцитабином, винорелбином — увеличивает число объективных эффектов на 13% (р=0,001) и медиану выживаемости на 4% (р=0,001) по сравнению со II поколением комбинированной химиотерапии (комбинация платиновых препаратов с другими цитостатиками).
Анализ ECOG-испытаний с 1980 по 2000 г. по сравнению отдаленных результатов и характеристике больных с распространенным НМРЛ, получавших различные схемы химиотерапии (Schiller J.H., 2002), показал, что из 3398 больных, разделенных на 2 группы: в 1 — лечившиеся до 1990 г. (1574 человека), а во 2 — после 1990 г. (1824 человека, получавших таксаны, гемцитабин, винорелбин и др.) медиана выживаемости в 1 группе была 5,9 мес, а во 2 — 8,1 мес, т.е. увеличилась в 1,4 раза. Время до прогрессирования в 1 группе было 2,7 мес, а во 2 — 3,5, т.е. также увеличилось в 1,3 раза. Интервал времени от начала прогрессирования до смерти в 1 группе был 2,7 мес , а во второй — 4,1 мес, т.е. также увеличился в 1,6 раза.
Основные эффективные схемы для лечения распространенного НМРЛ
Выбор той или иной равноэффективной схемы зависит от предпочтения врача и больного, профиля токсичности, а также от стоимости лечения.
Дублеты:
1. Этопозид + Цисплатин
2. Гемцитабин + Цисплатин
3. Паклитаксел + Цисплатин
4. Доцетаксел + Цисплатин
5. Винорелбин + Цисплатин
6. Паклитаксел + Карбоплатин
Триплеты:
1. Паклитаксел + Карбоплатин + Гемцитабин
2. Паклитаксел + Цисплатин + Винорелбин
3. Доцетаксел + Цисплатин + Гемцитабин
Литература
1. Bunn Р.А. et al. New chemotherapeutic agents prolonging survival and improve guality of life in NSCLC: a rewiew of the literature and future directions//Clin. cancer res.- 1998.- V. 4.
2. Raftopoulas H. et al. ...Proc. ASCO.- 2001.- V. 21, 322a, abstr. 1284.
3. Baggstrom M.O. et al. ...Proc. ASCO.- 2002.- V. 21, 306a, abstr. 1222.
4. Schiller J.H. et al. ...Proc. ASCO.- 2002.- V. 21, 304f, abstr. 1215.
Современная лечебная тактика при мелкоклеточном раке легкого
МРЛ — своеобразная форма рака легкого, существенно отличающаяся по своим биологическим характеристикам от прочих форм, объединяемых термином “немелкоклеточный рак легкого”.
Биологические особенности МРЛ определяют быстрый рост и раннюю генерализацию опухоли, обладающей в то же время высокой по сравнению с НМРЛ чувствительностью к цитостатикам и лучевой терапии.
При МРЛ, как и при других формах рака легкого, используется стадирование по международной системе TNM. Однако большинство больных в момент установления диагноза уже имеет III-IV стадию заболевания. Поэтому до настоящего времени не потеряла своего значения классификация Veterans Administration Lung Cancer Study Group, согласно которой различают больных с локализованным и распространенным МРЛ.
При локализованном МРЛ опухолевое поражение ограничено одним гемитораксом с вовлечением в процесс регионарных и контрлатеральных лимфоузлов корня, средостения и ипсилатеральных надключичных лимфатических узлов, когда технически возможно облучение с использованием одного поля.
Распространенным МРЛ считается процесс, выходящий за пределы локализованного. Ипсилатеральные легочные метастазы и наличие легочного плеврита указывает на распространенный МРЛ.
Даже при ранних стадиях МРЛ химиотерапия является обязательным компонентом комплексного лечения.
Хирургическое лечение возможно только в ранних стадиях МРЛ — при первичной опухоли Т1–2 без регионарных метастазов, либо с поражением бронхопульмональных лимфоузлов (N1).
Однако одно хирургическое лечение или сочетание операции с облучением не обеспечивает удовлетворительных отдаленных результатов. Статистически достоверное увеличение продолжительности жизни достигается при использовании послеоперационной адъювантной комбинированной химиотерапии (не менее 4 курсов).
Целесообразность использования неоадъювантной химиотерапии при локализованном МРЛ, когда после достижения эффекта от индукционной терапии больные подвергались оперативному лечению, продолжает изучаться.
В поздних стадиях заболевания основой терапевтической тактики является использование комбинированной химиотерапии, причем в случае локализованного МРЛ доказана целесообразность сочетания химио- с лучевой терапией, а при распространенном МРЛ применение лучевой терапии возможно только по показаниям (метастазы в головной мозг, позвоночник и др.).
На основе сочетания наиболее активных препаратов разработаны режимы комбинированной химиотерапии, которые получили широкое применение при МРЛ.
В течение последнего 10-летия стандартом для лечения больных МРЛ стала комбинация ЕР или ЕС (этопозид+цисплатин либо карбоплатин).
Доказано, что комбинация ЕР и ЕС обладает противоопухолевой активностью при распространенном МРЛ порядка 61–78% (полный эффект у 10–32% больных).
Основной причиной популярности комбинации ЕР является то, что, обладая равной противоопухолевой активностью с комбинацией CAV, она в меньшей степени угнетает миелопоэз, меньше ограничивая возможности использования лучевой терапии — по современным представлениям обязательного компонента терапии локализованного МРЛ.
Целесообразность включения в режимы комбинированной химиотерапии таксанов, гемцитабина, ингибиторов топоизомеразы I и таргетных препаратов продолжает изучаться.
Несмотря на продолжающиеся исследования по ранней интенсификации терапевтических режимов, убедительных доказательств преимущества этого подхода не получено.
Представление о том, что длительная поддерживающая химиотерапия может улучшить отдаленные результаты лечения больных МРЛ было опровергнуто рядом рандомизированных исследований. Современная терапия МРЛ не предусматривает использование поддерживающей терапии как цитостатиками, так и с помощью цитокинов и иммуномодуляторов.
Сочетанное применение комбинированной химиотерапии и лучевой терапии при локализованных формах МРЛ получило всеобщее признание, а преимущество такого подхода доказано в ряде рандомизированных исследований.
Оптимальная последовательность применения химиотерапии, облучения, а также конкретные терапевтические режимы составляют предмет дальнейших исследований.
Химиолучевая терапия при мелкоклеточном раке легкого
В настоящее время химиотерапия является основным системным методом лечения, а лучевая терапия может добавляться к ней для улучшения локального контроля или профилактического облучения головного мозга.
При облучении грудной клетки основной задачей является предотвращение локального рецидива, увеличение безрецидивного интервала и, в конечном счете, улучшение выживаемости.
Было показано, что при локализованном МРЛ местные рецидивы выявлялись в 82% после 1 химиотерапии, в 33% после 1 лучевой терапии и 28% — после объединенного подхода. Много рандомизированных исследований изучали роль лучевой терапии при МРЛ, но этот вопрос был решен только после публикации 2 метаисследований. В исследовании, основанном на опубликованных данных, локальная частота рецидива после облучения первичной опухоли понижалась от 65 до 40%, что привело к увеличению на 6% 2-летней выживаемости (от 16 до 22%). При метаанализе, основанном на индивидуальных данных 2140 пациентов, отмечено повышение 3-летней выживаемости от 8,9% после химиотерапии до 14,3%, после комбинации обоих методов, но при этом увеличилась токсичность.
В 1989 г. были подведены итоги 15-летних исследований ГУ РОНЦ им. Н.Н. Блохина РАМН по химио- и химиолучевому лечению больных МРЛ (Михина З.П., 1991). При изучении выживаемости лучшие результаты (по медианам) были получены при локализованной форме МРЛ, при минимальном поражении лимфатических узлов (N0–1), при химиолучевом лечении по сравнению с 1 химиотерапией и у больных с полной регрессией процесса в результате первичного лечения. По нашим данным, преимуществ в выживаемости в зависимости от какой-либо схемы химио-лучевой терапии (последовательная, одновременная протяженная или альтернирующая ускоренная) выявлено не было. Полученные результаты позволили рекомендовать при локализованных формах МРЛ использовать 3–4 курса химиотерапии с последующим облучением локорегионарной области в дозах 50–56 Гр. Такой подход дает возможность применять оба метода в необходимо максимальных режимах, с учетом чувствительности опухоли к каждому из них.
При первично распространенном МРЛ основным видом лечения является химиотерапия, лучевая терапия имеет паллиативный характер у большинства больных. Только при высокой чувствительности опухоли к химиотерапии облучение грудной клетки и отдельных метастазов может способствовать сохранению стойкой ремиссии и увеличению продолжительности жизни у таких больных.
Таким образом, облучение грудной клетки — партнер лечении локализованного МРЛ, но еще требуется изучение таких факторов как вид лекарства, выбор времени начала лучевой терапии, схема, доза облучения и фракционирование.
Больные локализованным МРЛ, у которых достигнута полная клиническая ремиссия, имеют 60% актуариальный риск метастазирования в головной мозг в течение 2–3 лет с начала лечения. Риск развития этих метастазов может быть снижен более чем на 50% при использовании профилактического облучения головного мозга в суммарной дозе 24 Гр.
Лучевая терапия при раке легкого
Принципы лучевой терапии рака легкого
ЛТ, как и хирургия, является локорегионарным методом лечения. В настоящее время уточнены ее пределы, стало возможно использование более активных схем (ускоренное гиперфракционирование), новых технических методов (3Д радиотерапия и внутриполостная брахитерапия) и современных радиационных программ в комбинации с хирургическим методом или химиотерапией.
Лучевая терапия основана на 2 ключевых принципах: суммарная доза радиации и объем облучения. Они применимы и к опухоли, и к нормальным тканям.
При раке легкого особенно значимы факторы, связанные:
— с распространением, размером опухоли и вовлечением регионарных узлов;
— с состоянием больного (шкала Карновского, потеря в весе);
— с характеристикой лучевой терапии — доза, фракционирование и радиационная методика.
Чтобы контролировать опухоль диаметром 3 см нужна доза 70 Гр, но большинство новообразований легкого имеют больший диаметр. Использование эскалированных доз облучения ограничивает толерантность (переносимость лучевой терапии) нормальных тканей (остающееся легкое, сердце, спинной мозг, пищевод). Имеется несколько подходов улучшения местного контроля:
— увеличение физической дозы — конформальная пространственная лучевая терапия — 3D-CRT;
— эндобронхиальное облучение — брахитерапия, интраоперационная лучевая терапия;
— увеличение биологической дозы (гиперфракционирование, радиосенсибилизация);
— объединение лучевой и химиотерапии.
Предоперационная лучевая терапия
Направлена на девитализацию опухоли, уменьшение перифокального воспаления и размеров новообразования; может увеличивать резектабельность у определенных пациентов, например, при раке верхушки легкого (типа Пенкоста). Сочетание с химиотерапией в предоперационном периоде позволяет чаще получить непосредственный эффект, но также повышается токсичность лечения. В настоящее время активно исследуется эффективность предоперационной химиолучевой терапии пациентам с III стадией заболевания.
Послеоперационная лучевая терапия
Уменьшает частоту местных рецидивов, что показано многими исследованиями, особенно при III стадии болезни. Она должна планироваться и в случае незавершенной резекции или наличии метастазов в лимфатические узлы средостения, а также при нарушении капсулы узла. В то же время не следует забывать, что положительный эффект послеоперационной лучевой терапии может нивелироваться отрицательным воздействием на нормальные ткани, которое возникает из-за большого объема облучения, высоких суммарных доз, особенностей кобальтового излучения. Следует использовать современные методики, которые уменьшают риск серьезных отдаленных последствий. Это особенно важно, т.к. после операции наблюдается нарушение функции легкого и происходит длительное восстановление оставшегося легкого, особенно при наличии хронических изменений, связанных с курением.
Эндобронхиальная брахитерапия
В пораженный бронх при бронхоскопии вводится зонд, через который, используя высокодозный источник иридия, осуществляется облучение перибронхиальной опухоли. Метод может использоваться:
— для обработки малых эндобронхиальных опухолей, особенно у пациентов с недостаточной функцией легкого;
— как локальный “буст” в дополнение к наружному облучению при больших опухолях;
— с симптоматической целью для улучшения проходимости бронха.
Так, исследователи группы Feng сочетали внешнее облучение в дозе 40 Гр и эндобронхиальную брахитерапиию в дозе 25 Гр. При лечении 64 пациентов непосредственное излечение было достигнуто у 60 с 5-летней выживаемостью 72%. При маленьких опухолях легкого 2-летняя выживаемость достигнута у 29 из 34 (85,3%) пациентов и у 44 из 73 (60,3%) больных (Hennequin C. et al., 1998; Marsiglia H. et al., 2000).
Конформальная лучевая терапия (3D-CRT)
В ее основе лежит очень старая концепция, согласно которой с увеличением физической дозы будет уничтожаться большее количество клоногенных клеток. Однако это возможно, если увеличение дозы ограничено опухолью при защите нормальных тканей (Perez C.A. et al., 1982).
Методика 3D-CRT позволяет соблюсти оба эти условия. Интерес к ней возродился с внедрением и развитием способов отображения, компьютерных средств и радиотерапевтического оборудования. Разработанные системы планирования лучевой терапии позволяют получить трехмерное представление об объеме опухоли, который нужно обработать, и объеме нормальных тканей, которые будут сэкономлены, и дают возможность вычислить дозы облучения в каждом из этих объемов.
Для осуществления методики 3D-CRT необходимо использование линейных ускорителей, оборудованных коллиматором “мультилиф”, делающим возможным изменение размеров и формы поля в течение сеансов облучения, с использованием фиксирующих устройств и проверкой точности укладок.
В ряде исследований показаны большие возможности этой технологии, при которой нормальные ткани, особенно легкие и сердце, максимально исключены из зоны облучения. На опухолевый объем доза может быть увеличена до 70, 90 и даже 100 Гр с сохранением доз в нормальных тканях в пределах принятых уровней переносимости (Graham M.V. et al., 1999; Rozensweig K.E. et al., 1999).
Но при планировании уменьшенного объема возникает проблема правильного распознавания первичного очага и пораженных лимфатических узлов средостения. Выбор облучаемого объема проводится по данным спиральной КТ грудной клетки, которая, как правило, осуществляется без контрастирования сосудов, что затрудняет определение лимфатических узлов, особенно при подозрении на метастатическое поражение. При наличии зон гиповентиляции, ателектазов, воспаления такие же трудности имеются и при определении границ первичной опухоли.
С первых шагов планирования лучевой терапии по принципу 3D-CRT необходимо иметь максимальную информацию о локорегионарном процессе, привлекая для этого самые современные методы диагностики. Следует проводить диагностические исследования в следующем объеме:
1. Первичная клиническая оценка:
— физикальный осмотр;
— общий и биохимический анализы крови;
— рентгенологическое исследование грудной клетки в 2 проекциях;
— КТ грудной клетки;
— бронхоскопия;
— исследование мокроты в течение 3 дней.
2. Специальные методы исследования:
— исследование верхней части живота — КТ и/или УЗКТ;
— КТ или МРТ головного мозга;
— сканирование и рентгеновское исследование подозрительных зон; при положительных результатах — сканирование костей скелета.
3. Локорегионарное поражение — объем процесса уточняют:
— медиастиноскопия;
— ПЭТ в случае выявления на КТ лимфатических узлов, подозрительных на метастатические (N2), или вовлечения соседних органов и сосудов (T4).
4. Завершающий диагностический комплекс:
— пункция плевры при наличии выпота;
— цитологическое исследование выпота;
— торакоскопия, если плевральная цитология отрицательная;
— тонкоигольная биопсия любого подозрительного на метастаз очага.
Только уточненные данные о локорегионарном процессе можно использовать при объемном планировании, особенно при решении вопроса об этапах и суммарных дозах в области первичной опухоли и средостения с максимальным исключением непораженных критических органов (сердце, спинной мозг, пищевод, легочная ткань, крупные сосуды). Вопрос о суммарных дозах радиации на область средостения в сомнительных случаях (поражение лимфатических узлов) требует дальнейшего изучения. Известно, что у больных с III стадией заболевания частота 2-летнего контроля узлов средостения составляет 92%, но локальный контроль составил только 40% для доз вокруг 70 Гр.
Увеличение суммарной дозы с использованием стандартных радиационных режимов (2 Гр ежедневно, 5 раз в неделю), будет удлинять срок лечения. Репопуляция (восстановление числа опухолевых клеток за счет деления) — важная для лучевой терапии проблема. Значит удлинение суммарного времени лечения уменьшит эффективность дополнительной подведенной дозы. Очень интересный подход — объединить 3D-CRT с гиперфракционным облучением, направленным на сохранение постоянного времени или даже уменьшение его длительности.
В настоящее время, изучается возможность использования еще более высоких доз суммарной радиации и/или интегрированием 3D-CRT с химиотерапией.
Фракционирование
Радиационные схемы учитывают 2 основных принципа:
1. Различия в процессах репарации в опухоли и нормальных тканях.
2. Скорость репопуляции опухоли.
Репарация влияет на отдаленные последствия, которые зависят от величины фракции. Использование малых фракций несколько раз в день допускает увеличение суммарной дозы радиации без увеличения риска поздних повреждений (Sibley G.S. et al., 1999).
Репопуляция ведет к потере эффективности за счет увеличения доли клоногенных клеток, и этот факт подразумевает, что срок лечения должен быть минимален. Механизм репопуляции хорошо иллюстрируется отрицательным действием на выживаемость более длительных курсов облучения. Исследования группы RTOG показали: 2-летняя выживаемость снижалась с 33 до 14%, если сроки лечения были увеличены больше, чем на 5 дней (Cox J.D. et al., 1993).
Лучшим является курс лучевой терапии по схеме CHART (непрерывная, гиперфракционированная, ускоренная радиационная терапия) (Saunders M. et al., 1999): курс лучевой терапии осуществляется в течение 12 дней, по 1,5 Гр 3 раза в день с минимальным интервалом между фракциями 6 ч, СОД — 54 Гр. Следует учитывать, что при терапии CHART более выражены острые лучевые реакции.
Лекарства и излучение
Объединение лучевой терапии с химиотерапией преследует несколько целей. Лекарства могут использоваться как радиосенсибилизирующий агент, часто при очень низких дозах, которые не являются цитотоксическими. По времени проведения лечения различают 2 подхода, одновременный и последовательный.
Одновременный подход
Оба метода используются в течение того же самого временнóго интервала, увеличиваются и эффективность, и токсичность лечения. Эффект радиосенсибилизации оценен в основном для препаратов платины. Классическое исследование EORTC по сравнению эффективности еженедельного введения 30 мг/м2 или ежедневного введения 6 мг/м2 цисплатина перед облучением с лучевой терапией показало: 2-летняя выживаемость при ежедневном введении химиопрепарата выше (26 против 13%), но метастатическая болезнь — не единственная проблема, стоящая перед онкологом. Растут гематологическая и негематологическая токсичность. Таксаны, гемцитабин и винорелбин также являются мощными радиосенсибилизирующими препаратами и при этом достаточно токсичны, что представляет определенную проблему при планировании и проведении терапии. Итак, при разработке схем одновременной химиолучевой терапии необходимо стремиться использовать оба метода в полном объеме. Это возможно только при освоении методики трехмерной конформальной лучевой терапии, при сочетании с брахитерапией, интраоперационным облучением. Объединенный подход не может применяться во всех случаях распространенного рака легкого, т.к. лица с ограниченными функциональными резервами и ослабленные больные могут не перенести это лечение.
Последовательный подход
Каждый метод используется в максимальных дозах и при допустимой токсичности. Обычно схема, содержащая цисплатин, предваряет лучевую терапию. Ранние исследования объясняли успех такой терапии следующим обстоятельством: индукционная химиотерапия улучшает эффективность лучевой терапии за счет ответа опухоли на химиопрепараты, что приводит к лучшей оксигенации ее остатка и/или меньшему количеству остающегося пула клоногенных клеток. Однако тщательный анализ, проведенный позднее, доказал, что выживаемость улучшилась благодаря уменьшению отдаленных метастазов без каких-либо отличий в качестве локального контроля.
Литература
Михина З.П. Лучевая терапия в комплексном лечении мелкоклеточного рака легкого: Автореф. ...дис. докт. мед. наук.- М., 1991.- С. 21.
Cox J.D. et al. ...Int. J. Radiat. Oncol. Biol. Phys.- 1993.- V. 27.- P. 493–498.
Graham M.V. et al. ...Int. J. Radiat. Oncol. Biol. Phys.- 1999.- V. 45.- P. 323–329.
Marsiglia H. et al. ...Int. J. Radiat. Oncol. Biol. Phys.- 2000.- V. 47.- P. 665–672.
Perez C.A. et al. ...Cancer.- 1982.- V. 50.- P. 1091–1099.
Rozensweig K.E. et al. ...Int. J. Radiat. Oncol. Biol. Phys.- 1999.- V. 45.- P. 243–244.
Saunders M. et al. ...Radiother. Oncol.- 1999.- V. 52. — P. 137–148.
Sibley G.S. et al. ...Int. J. Radiat. Oncol. Biol. Phys.- 1999.- V. 45.- P. 241.
Warde P. et al. ...J. Clin. Oncol.- 1992.- V. 10.- P. 890–895.
Описание проверено экспертом
Оцените статью:
- Рак легкого
- Рак бронхов
- Мелкоклеточная карцинома легких
- Немелкоклеточный рак легкого
- Карцинома легких
- Мелкоклеточный рак легкого
- Местно-распространенный мелкоклеточный рак легкого
- Немелкоклеточный рак легких
- Рак легких
- Рецидивирующий неплоскоклеточный немелкоклеточный рак легкого
- Местнораспространенный немелкоклеточный рак легкого
- Рак легкого мелкоклеточный
- Рак легкого немелкоклеточный
- Неоперабельный местно-распространенный немелкоклеточный рак легкого
- Неоперабельный метастатический немелкоклеточный рак легкого
- Рак легкого плоскоклеточный
- Бронхогенный рак
- Диссеминированный рак легких
- Мелкоклеточные анапластические опухоли легкого
- Мелкоклеточный и немелкоклеточный рак легкого
- Мелкоклеточный рак легких
- Недифференцированный рак легкого
- Овсяно-клеточная карцинома легкого
- Рак легких мелкоклеточный
- Опухоли легких
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан еженедельный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).





