B98.0 Helicobacter pylori [H. рylori] в качестве причины болезней, классифицированных в других рубриках, МКБ-10
Отредактировано: 15.07.2025
Инфекция Helicobacter pylori
Инфекция Helicobacter pylori (НР) является самой распространенной на планете – более половины населения Земли являются носителями этого возбудителя [1].
Helicobacter pylori – микроаэрофильная спиралевидная грамотрицательная бактерия [2]. Как и все возбудители инфекционного процесса, она имеет собственные факторы патогенности, колонизации и персистенции. Подробнее о них – в статье «Как H. pylori влияет на человека, и может ли человек повлиять на неё?».
Helicobacter pylori населяет слизистую оболочку желудка и способна вызывать развитие хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, злокачественных новообразований желудка.
Заболевания, ассоциированные с инфекцией Helicobacter pylori
Гастрит
Ключевой патогенетический механизм развития НР-ассоциированного гастрита заключается в развитии и сохранении воспалительной реакции в присутствии Helicobacter pylori, а также синдром повышенной эпителиальной проницаемости слизистой оболочки желудка [3].
Основным проявлением НР-ассоциированного гастрита является диспепсия – комплекс симптомов, который включает чувство дискомфорта, жжения, боли в эпигастрии, ощущение переполнения и раннего насыщения во время приема пищи [4]. При этом важно учитывать, что эти жалобы могут встречаться при функциональной диспепсии. Согласно положениям Киотского консенсуса, в том случае, если симптомы купировались после проведения эрадикации Helicobacter pylori, то диспепсия была обусловлена НР-ассоциированным гастритом. В этом случае диагноз формулируется как «диспепсия, ассоциированная с инфекцией Н. pylori». Однако если симптоматика сохраняется после курса антибиотикотерапии, то, вероятнее всего, она связана с функциональным расстройством [5, 6].
Для НР-ассоциированного гастрита не характерны специфические изменения лабораторных показателей, однако заболевание может сочетаться с анемией, связанной с неявными кровотечениями или снижением всасывания железа.
Для подтверждения диагноза НР-ассоциированного гастрита, а также для оценки изменений слизистой оболочки желудка, рекомендовано проведение эзофагогастродуоденскопии (ЭГДС) с взятием биопсии из следующих локусов: 2 биоптата из тела желудка, 2 биоптата из антрального отдела желудка по большой и малой кривизне. Далее возможно проведение быстрого уреазного теста. Для окончательной постановки диагноза НР-ассоциированного гастрита необходимы результаты 13С-уреазного дыхательного теста либо определение антигена НР в кале [4].
Язвенная болезнь желудка и двенадцатиперстной кишки
Около 80% язв двенадцатиперстной кишки (ДПК) и 60% язв желудка ассоциированы с НР-инфекцией [7].
Патоморфологическим субстратом заболевания является язва – дефект в стенке желудка или ДПК. В основе патогенеза язвенной болезни лежит ослабление факторов защиты слизистой (снижение выработки слизи, секреции бикарбонатов, регенеративных способностей тканей, синтеза простагландинов) одновременно с преобладанием факторов повреждения. Ключевым из них является инфекция Helicobacter pylori. Его колонизация приводит к развитию поверхностного гастрита и дуоденита и повышению уровня гастрина с увеличением секреции соляной кислоты. Сохраняющаяся альтерация эпителия обусловливает развитие язвенного дефекта.
Ведущий симптом язвенной болезни – боли в эпигастрии, возникающие сразу после приема пищи, либо через полчаса-час после еды, либо через 2-3 часа после еды, а также «голодные» и ночные боли. Болевой синдром купируется приемом антацидных и антисекреторных препаратов. Также встречаются такие симптомы, как отрыжка, тошнота, запор. Приведенная клиническая картина развивается и при других патологиях ЖКТ, поэтому для подтверждения диагноза и идентификации НР-инфекции проводят инструментальные исследования – ЭГДС с оценкой стадии язвенного процесса по Sakita и Miwa, 13С-уреазный дыхательный тест, либо определение антигена НР в кале [8]. Для первичной диагностики НР-инфекции возможно проведение быстрого уреазного теста.
При прогрессировании болезни возможно развитие жизнеугрожающих состояний, таких как кровотечение, перфорация (прободение) язвы, пенетрация (т.е. прорастание язвы в окружающие органы) и малигнизация.
Рак желудка
Инфекция Helicobacter pylori представляет из себя один из ведущих этиологических факторов, вызывающих рак желудка. С НР-инфекцией ассоциировано 89% случаев некардиального рака желудка, который, в свою очередь, составляет 78% всех случаев рака желудка [9].
Helicobacter pylori провоцирует развитие опухолевого процесса посредством нескольких механизмов. Так, сохраняющееся воспаление приводит к развитию предраковых изменений в виде атрофического гастрита и кишечной метаплазии. Также НР-инфекция приводит к снижению секреции желудочного сока, что провоцирует бактериальный рост в полости желудка. Продукты метаболизма патогенных микроорганизмов могут провоцировать онкогенез [10].
Для рака желудка характерно наличие неспецифической симптоматики (слабость, ухудшение аппетита, тошнота, прогрессирующая потеря массы тела) и симптомов, обусловленных локализацией и формой роста опухоли. Так, при раке кардиоэзофагеального отдела встречаются проявления дисфагии, а при раке антрального отдела – тошнота и рвота.
Диагностика рака желудка включает в себя ряд исследований, среди которых эндоскопические, рентгенологические и патоморфологические методики. Несмотря на то, что НР-инфекция ассоциирована с развитием рака желудка, ее диагностика при подозрении на опухолевый процесс не является приоритетной [11].
MALT-лимфома желудка
MALT-лимфома желудка относится к лимфомам маргинальной зоны – группе злокачественных В-клеточных новообразований, происходящих из В-лимфоцитов с экспрессией CD20, которые в норме встречаются в маргинальной зоне лимфоидных фолликулов лимфатических узлов, селезенки и лимфатических тканей [12].
Лимфомы маргинальной зоны, в том числе MALT-лимфома желудка, характеризуется длительным неагрессивным и медленно прогрессирующим (индолентным) течением без выраженной клинической симптоматики. Со временем могут присоединяться симптомы интоксикации – слабость, потливость, снижение веса, зуд кожных покровов. Согласно современным данным, развитие лимфом маргинальной зоны вызвано продолжительной стимуляцией иммунной системы, связанной с аутоиммунным заболеванием или инфекцией. MALT-лимфома желудка не является исключением – по результатам ряда исследований проведение эрадикации НР в 77-80% случаев приводит к регрессии опухоли, что может подтверждать связь НР-инфекции и развитие MALT-лимфомы [13, 14]
В связи с этим рекомендовано выполнение диагностики НР-инфекции после верификации MALT-лимфомы желудка. Проведение антибиотикотерапии в отношении Helicobacter pylori рекомендовано как первый этап лечения. При этом эрадикационная терапия проводится даже в отсутствие данных о наличии НР-инфекции. Это объясняется возможностью получения ложноотрицательных результатов диагностики, а также инфицирования менее распространенными видами Helicobacter pylori [12].
Железодефицитная анемия
Данные ряда исследований подтверждают связь НР-инфекции и развития дефицита железа и железодефицитной анемии. В случае атрофического НР-ассоциированного гастрита механизм развития дефицита железа связан с нарушением его всасывания. Такая клиническая ситуация чаще всего развивается у взрослых пациентов, инфицированных Helicobacter pylori. Однако ассоциация НР-инфекции и железодефицита также наблюдается у детей и подростков. При этом отсутствует выраженная атрофия слизистой оболочки желудка и снижение секреции соляной кислоты. В этом случае реализуется иной механизм: H. pylori и организм человека находятся в конкуренции в отношении экзогенного пула железа, что приводит к снижению поступления железа и развитию железодефицитной анемии. Таким образом, в случае длительно сохраняющейся железодефицитной анемии у детей и подростков рекомендовано осуществлять диагностику НР-инфекции и при положительном результате назначать эрадикационную терапию [15].
Колоректальный рак
Колоректальный рак является третьим по распространенности онкологическим заболеванием в мире. Данные недавнего когортного исследования подтвердили, что инфекция H. pylori связана с повышенным риском развития колоректального рака на 18% и повышением смертности от колоректального рака на 12% [16]. С точки зрения патогенеза это может быть связано с активацией сигнальных путей канцерогенеза под влиянием Helicobacter pylori [17]. Требуется проведение дальнейших лабораторных и клинических исследований, посвященных связи колоректального рака и НР-инфекции, однако очевидно, что существующие на настоящий момент данные имеют большой потенциал применения во врачебной практике.
Подробнее о данных ретроспективного когортного исследования, отражающего частоту развития колоректального рака и показатели смертности среди инфицированных и неинфицированных H. pylori пациентов, можно прочитать в статье «Helicobacter pylori и колоректальный рак: данные научного исследования».
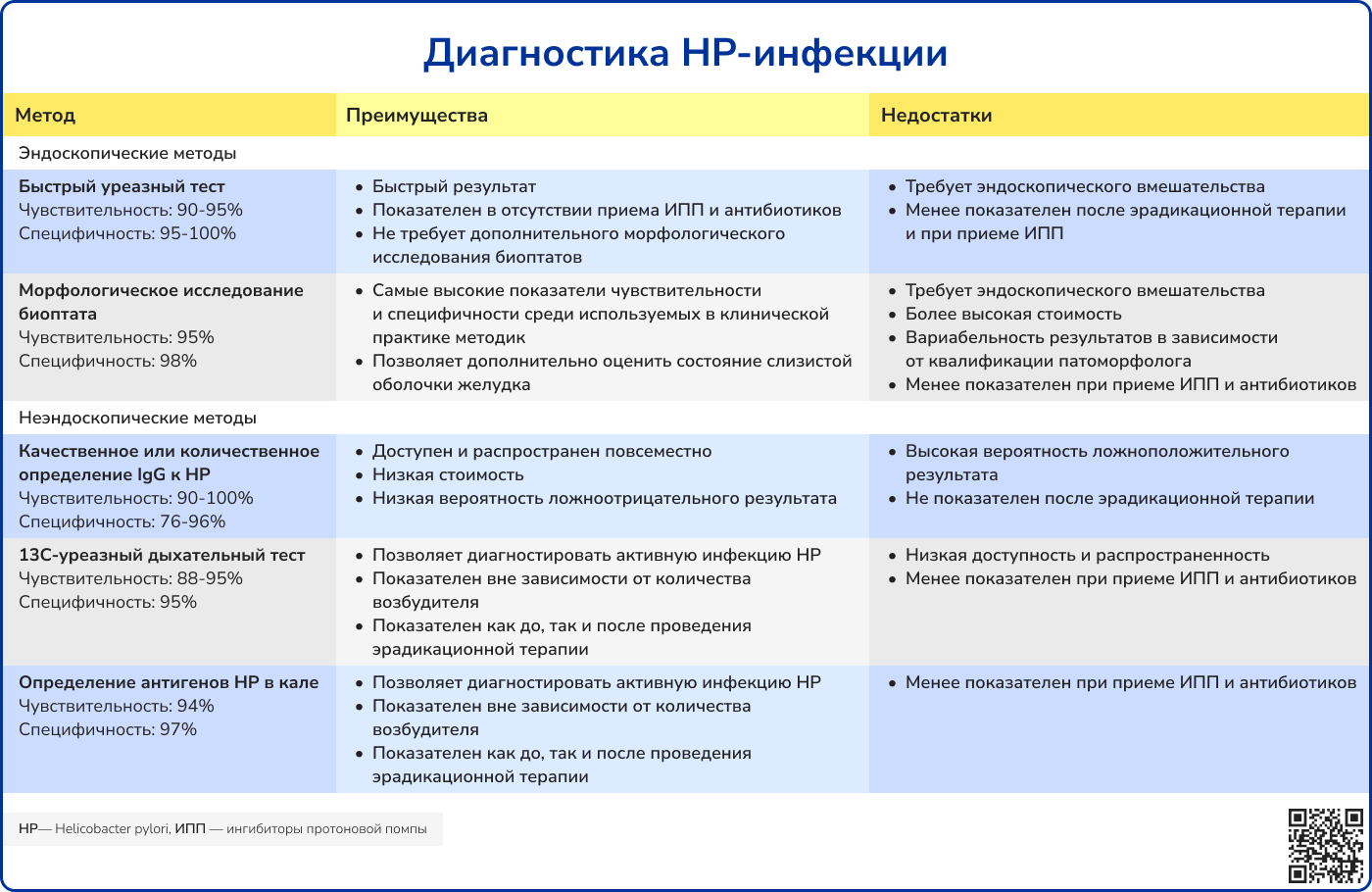
Диагностика
Методы диагностики инфекции Helicobacter pylori классифицируются на:
- Эндоскопические: быстрый уреазный тест и морфологическое исследование биоптата;
- Неэндоскопические: определение IgG к НР, 13С-уреазный дыхательный тест, определение антигенов НР в кале.
Быстрый уреазный тест – экспресс-методика определения наличия НР-инфекции. Биоптаты, полученные в ходе эндоскопического исследования, помещаются в раствор, содержащий мочевину и фенолфталеин – индикатор, меняющий цвет при изменении рН раствора в сторону щелочной среды. Изменение окрашивания раствора при помещении биоптата свидетельствует о наличии НР-инфекции, так как возбудитель при помощи фермента уреазы способен гидролизовать мочевину с образованием гидроксида аммония, который изменяет рН раствора. Преимущество быстрого уреазного теста состоит в простоте его выполнения и высокой скорости получения результатов. При этом стоит помнить о том, что результаты могут быть искажены, если пациент принимает ингибиторы протоновой помпы (ИПП) или прошел курс эрадикационной терапии.
Морфологическое исследование биоптата демонстрирует самые высокие показатели чувствительности и специфичности среди используемых в настоящий момент в клинической практике методов: 95% и 98%, соответственно. Достоинство метода также является возможность оценить состояние слизистой желудка, в том числе выраженность воспалительных изменений, степень атрофии, наличие дисплазии и метаплазии [18]. Для подтверждения диагноза НР-ассоциированного гастрита рекомендовано взятие биопсии из следующих локусов: 2 биоптата из тела желудка и 2 биоптата из антрального отдела желудка по большой и малой кривизне [4]. Однако стоит учитывать, что этот метод длителен в выполнении и имеет высокую стоимость, а точность результатов зависит от квалификации патоморфолога.
Серологические методы диагностики НР-инфекции являются наиболее доступными и распространены повсеместно. Однако определение IgG к НР нередко дает ложноположительные результаты и неинформативно после проведения эрадикационной терапии. Таким образом, серологическая диагностика НР, несмотря на ее доступность и простоту исполнения, не является надежным методом [18].
13С-уреазный дыхательный тест (13С-УДТ) в настоящий момент является «золотым стандартом» диагностики НР-инфекции [4]. Эффективность метода не зависит от количества возбудителя и одинаково высока как до, так и после проведения курса эрадикационной терапии. Суть метода заключается в оценке содержания атомов изотопа углерода 13С в выдыхаемом воздухе после приема мочевины, содержащей этот изотоп. При наличии инфекции Helicobacter pylori уреаза гидролизует поступившую мочевину, меченую изотопом 13С, с образованием гидроксида аммония и углекислого газа. Углекислый газ также будет содержать меченые атомы углерода, что будет определяться при проведении теста. 13С-УДТ выполняется следующим образом: предварительно осуществляется сбор выдыхаемого воздуха для определения базового соотношения 13СО2/12СО2 (небольшое количество атомов 13С в норме содержится в организме). Далее пациент перорально принимает раствор мочевины, содержащей атомы изотопа углерода 13С. Спустя 30 минут вновь проводится сбор выдыхаемого воздуха для определения соотношения 13СО2/12СО2. Далее два соотношения сравниваются, на основании чего делается вывод о наличии НР-инфекции [4, 18].
Определение антигенов НР в кале является относительно новым подходом к диагностике НР-инфекции. Как и 13С-УДТ, он показателен вне зависимости от количества возбудителя и одинаково эффективен как до, так и после эрадикационной терапии. Однако при приеме ИПП, антибиотиков и препаратов висмута допустимо искажение результатов исследования [18].
Таким образом, наиболее оптимальными неэндоскопическими методами первичной диагностики НР-инфекции являются 13С-УДТ и определение антигенов НР в кале. При проведении ЭГДС допустимо проведение быстрого уреазного теста, однако более точным и углубленным диагностическим подходом будет морфологическое изучение биоптата [4].
Источник: Feldman M., Friedman L. S., Brandt L. J. Sleisenger and Fordtran's gastrointestinal and liver disease E-book: pathophysiology, diagnosis, management. – Elsevier health sciences, 2021.
Лечение
Согласно положениям Киотского консенсуса (2016), в отношении каждого случая выявленной инфекции Helicobacter pylori необходимо проводить эрадикационную терапию [6].
Согласно российским клиническим рекомендациям, продолжительность курса лечения должна составлять не менее 14 дней. Это позволяет достигнуть максимальной эффективности проводимого лечения [4, 8].
С учетом того, что в России показатели резистентности H. pylori к кларитромицину не превышают 15%, в качестве первой линии эрадикационной терапии рекомендуется тройная схема [4, 8, 19]:
- ИПП (стандартная доза 2 раза в сутки),
- кларитромицин (500 мг 2 раза в сутки),
- амоксициллин (1000 мг 2 раза в сутки).
При непереносимости антибиотиков пенициллинового ряда допустимо назначение четырехкомпонентной схемы в качестве первой линии:
- ИПП (стандартная доза 2 раза в сутки),
- тетрациклин (500 мг 4 раза в сутки),
- метронидазол (500 мг 3 раза в сутки),
- висмута трикалия дицитрат (120 мг 4 раза в сутки).
При неэффективности тройной терапии с кларитромицином в качестве второй линии эрадикационной терапии назначают четырехкомпонентную схему с препаратами висмута или следующую комбинацию препаратов:
- ИПП (стандартная доза 2 раза в сутки),
- левофлоксацин (500 мг 2 раза в сутки),
- амоксициллин (1000 мг 2 раза в сутки).
При отсутствии эффекта от препаратов второй линии проводится эрадикационная терапия препаратами третьей линии, которые подбираются на основании культурального исследования конкретного штамма H. pylori и определения его чувствительности к антибиотикам [4, 8].
_1.png)
Контроль эрадикации проводится через 4-6 недель после окончания курса препаратов c помощью 13С-УДТ или посредством определения антигена Н.pylori в кале. Чтобы избежать ложноотрицательных результатов, прием ИПП прекращают за 2 недели до контрольного исследования. При этом отрицательный результат наличия НР-инфекции должен быть дополнительно подтвержден другим диагностическим методом [4].
Зарубежные клинические рекомендации по эрадикации H. pylori незначительно отличаются от российских. В ряде европейских стран и регионов Северной Америки показатели устойчивости H. pylori к кларитромицину превышают 15%. Поэтому в качестве первой линии терапии рекомендовано назначать четырехкомпонентную схему с препаратами висмута [20]. Обращают на себя внимание подходы к лечению НР-инфекции, предлагаемые в клинических рекомендациях Японии. Так, рекомендованная продолжительность первой линии лечения – тройной терапии с амоксициллином и кларитромицином составляет 7 дней, а в качестве третьей линии терапии при неэффективности предыдущих курсов лечения возможно применение ИПП, амоксициллина и ситафлоксацина, либо ИПП, амоксициллина и метронидазола [21]. Также в японской врачебной практике распространено назначение пробиотиков в дополнение к основной терапии [21, 22].
Диета
Был проведен ряд исследований, посвященных связи между НР-инфекцией и различными продуктами питания. Их результаты довольно интересны для обсуждения и имеют потенциал для применения в клинической практике.
Так, диета с преобладанием простых углеводов и подслащенных продуктов положительно связана с повышенной распространенностью HP-инфекции и степенью ее прогрессии [23]. При этом включение меда в рацион и употребление его с частотой более 1 раза в неделю ассоциировано с более низкой вероятностью инфицирования HP (50,6% по сравнению с контрольной группой – 70,8%) [24].
Также интересна связь зеленого и черного чая и НР-инфекции: 150 пациентов с жалобами на диспепсические явления были обследованы с помощью ЭГДС и 13С-УДТ. Уровень инфицирования НР был ниже (45,2%) у пациентов, употребляющих зеленый или черный чай один день неделю, чем у других пациентов (64,8%) [24].
Были получены данные о положительном эффекте оливкового масла при НР-инфекции. Исследование было проведено с участием З0 взрослых пациентов, инфицированных Н. pylori. Они принимали 30 г оливкового масла за 30-60 мин до еды на протяжении 14 дней. Наличие инфицирования Н. pylori определялось с помощью 13С-УДТ. Возбудитель был элиминирован у 8 из З0 пациентов через 4-6 недель после первого клинического вмешательства. У 12 из 30 пациентов не было выявлено инфекции Н. pylori через 24-72 часа после последней употребления оливкового масла [25].
Также интересен опыт применения порошка черного тмина в качестве дополнения к четырехкомпонентной эрадикационной терапии с препаратами висмута. Результаты исследования, проведенного иранскими учеными, продемонстрировали, что прием порошка черного тмина Nigella sativa в дозе 2 г в сутки в течение восьми недель совместно с четырехкомпонентной терапией с препаратами висмута может значительно повысить аппетит и концентрацию грелина в сыворотке крови у пациентов с инфекцией, вызванной H. pylori, по сравнению с контрольной группой [26]. Таким образом, порошок черного тмина может стать полезным дополнением к общепризнанной эрадикационной терапии НР-инфекции, которое могло бы положительным образом влиять на общее состояние пациента во время курса лечения.
Список литературы
- Hooi J. K. Y. et al. Global prevalence of Helicobacter pylori infection: systematic review and meta-analysis //Gastroenterology. – 2017. – Т. 153. – №. 2. – С. 420-429.
- FitzGerald R., Smith S. M. An overview of Helicobacter pylori infection //Helicobacter pylori. – 2021. – С. 1-14.
- Симаненков В. И. и др. Синдром повышенной эпителиальной проницаемости в клинической практике. Мультидисциплинарный национальный консенсус //Кардиоваскулярная терапия и профилактика. – 2021. – Т. 20. – №. 1. – С. 121-278.
- Клинические рекомендации Российской гастроэнтерологической ассоциации и Ассоциации «Эндоскопическое общество РЭНДО» “Гастрит и дуоденит”, М.: 2021
- Sugano K. et al. Kyoto global consensus report on Helicobacter pylori gastritis //Gut. – 2015. – Т. 64. – №. 9. – С. 1353-1367.
- Ивашкин В.Т. и др. Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению функциональной диспепсии. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2017. Т. 27. – №1. – С. 50-61.
- Lanas A., Chan F. K. L. Peptic ulcer disease //The Lancet. – 2017. – Т. 390. – №. 10094. – С. 613-624.
- Клинические рекомендации Союза педиатров России, Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии, Общероссийской общественной организации "Российская ассоциация детских хирургов", Автономной некоммерческой организации "Общество детских гастроэнтерологов, гепатологов и нутрициологов" “Язвенная болезнь желудка и/или двенадцатиперстной кишки” М.: 2021
- De Martel C. et al. Global burden of cancers attributable to infections in 2008: a review and synthetic analysis //The lancet oncology. – 2012. – Т. 13. – №. 6. – С. 607-615.
- Lee Y. C. et al. Association between Helicobacter pylori eradication and gastric cancer incidence: a systematic review and meta-analysis //Gastroenterology. – 2016. – Т. 150. – №. 5. – С. 1113-1124. e5.
- Клинические рекомендации Ассоциации онкологов России, Общероссийской общественной организации «Российское общество клинической онкологии» “Рак желудка”, М.: 2020
- Клинические рекомендации Российского общества онкогематологов, Национального гематологического общества, Ассоциации онкологов России “Лимфома маргинальной зоны”, М.: 2023
- Nakamura S. et al. Long-term clinical outcome of gastric MALT lymphoma after eradication of Helicobacter pylori: a multicentre cohort follow-up study of 420 patients in Japan //Gut. – 2012. – Т. 61. – №. 4. – С. 507-513.
- Wündisch T. et al. Second cancers and residual disease in patients treated for gastric mucosa-associated lymphoid tissue lymphoma by Helicobacter pylori eradication and followed for 10 years //Gastroenterology. – 2012. – Т. 143. – №. 4. – С. 936-942.
- Kato S., Gold B. D., Kato A. Helicobacter pylori-associated iron Deficiency anemia in childhood and adolescence-pathogenesis and clinical management strategy //Journal of Clinical Medicine. – 2022. – Т. 11. – №. 24. – С. 7351.
- Shah S. C. et al. Impact of Helicobacter pylori infection and treatment on colorectal cancer in a large, nationwide cohort //Journal of Clinical Oncology. – 2024. – С. JCO. 23.00703.
- Ralser A. et al. Helicobacter pylori promotes colorectal carcinogenesis by deregulating intestinal immunity and inducing a mucus-degrading microbiota signature //Gut. – 2023. – Т. 72. – №. 7. – С. 1258-1270.
- Feldman M., Friedman L. S., Brandt L. J. Sleisenger and Fordtran's gastrointestinal and liver disease E-book: pathophysiology, diagnosis, management. – Elsevier health sciences, 2021.
- Malfertheiner P. et al. Management of Helicobacter pylori infection—the Maastricht V/Florence consensus report //Gut. – 2017. – Т. 66. – №. 1. – С. 6-30.
- Chey W. D. et al. ACG clinical guideline: treatment of Helicobacter pylori infection //Official journal of the American College of Gastroenterology| ACG. – 2017. – Т. 112. – №. 2. – С. 212-239.
- Kato M. et al. Guidelines for the management of Helicobacter pylori infection in Japan: 2016 Revised Edition //Helicobacter. – 2019. – Т. 24. – №. 4. – С. e12597.
- Nei T. et al. Fatal fulminant Clostridioides difficile colitis caused by Helicobacter pylori eradication therapy; a case report //Journal of Infection and Chemotherapy. – 2020. – Т. 26. – №. 3. – С. 305-308.
- Xia Y. et al. Dietary patterns are associated with Helicobacter pylori infection in Chinese adults: a cross-sectional study //Scientific Reports. – 2016. – Т. 6. – №. 1. – С. 32334.
- Boyanova L. et al. Honey and green/black tea consumption may reduce the risk of Helicobacter pylori infection //Diagn Microbiol Infect Dis. – 2015. – Т. 82. – №. 1. – С. 85-6.
- Taşbozan, O., & Gökçe, M. A. (2017). Fatty Acids in Fish. InTech. doi: 10.5772/68048
- Yousefnejad H. et al. Nigella sativa powder for helicobacter pylori infected patients: a randomized, double-blinded, placebo-controlled clinical trial //BMC Complementary Medicine and Therapies. – 2023. – Т. 23. – №. 1. – С. 123.
Автор статьи
Статьи по теме Гастроэнтерология
- Эозинофильный эзофагит
- Вирусный гепатит Е
- Хронический вирусный гепатит С
- Аскаридоз
- Энтеробиоз
- Фасциолез
- Язвенный колит
- Целиакия
- Пищевод Баррета
- Болезнь Крона
- Грыжа пищеводного отверстия диафрагмы
- Гастроэзофагеальная рефлюксная болезнь
- Метаболически ассоциированная жировая болезнь печени
- Синдром раздраженного кишечника
- Хронический панкреатит
- Clostridioides difficile-ассоциированная болезнь
- Асцит
- Острые кишечные инфекции
- Запор
- Язвенная болезнь
- Редкий дебют системной красной волчанки – острый панкреатит: описание случая
- Связь между ингибиторами протонной помпы и заболеваниями почек
- Постхолецистэктомическая диарея
- Акотиамид и функциональная диспепсия: данные систематического обзора и мета-анализов
- Как H. pylori влияет на человека, и может ли человек повлиять на неё?
- Helicobacter pylori и колоректальный рак: данные научного исследования
- Эрозивный эзофагит: 5 тезисов, которые нужно знать врачу и пациенту
- Практические подходы к диагностике и лечению вздутия живота
Статьи по теме Инфекционные болезни
- Хламидийная инфекция
- Гонококковая инфекция
- Урогенитальный трихомониаз
- Вирусный гепатит Е
- Хронический вирусный гепатит С
- Аскаридоз
- Энтеробиоз
- Фасциолез
- Трихинеллез
- Clostridioides difficile-ассоциированная болезнь
- Острые кишечные инфекции
- Сифилис
Болезни в статье:
- K25 Язва желудка
- K26 Язва двенадцатиперстной кишки
- C16 Злокачественное новообразование желудка
- K30 Диспепсия
- D50 Железодефицитная анемия
- K29.4 Хронический атрофический гастрит
- C83.0 Мелкоклеточная (диффузная)
- C20 Злокачественное новообразование прямой кишки
Фармгруппы в статье:
Оцените статью:
Как H. pylori влияет на человека, и может ли человек повлиять на неё?
Инфекция H. pylori – известный провоцирующий фактор язвенной болезни желудка и одна из самых распространенных в человеческой популяции инфекций. Чем же она так опасна? И можно ли от нее избавиться?
Опубликовано на сайте: 12.04.24 | Обновлено на сайте: 13.08.25
Helicobacter pylori и колоректальный рак: данные научного исследования
В статье изложены данные ретроспективного когортного исследования, отражающего частоту развития колоректального рака и показатели смертности среди инфицированных и неинфицированных H. pylori пациен...
Опубликовано на сайте: 16.04.24 | Обновлено на сайте: 16.04.24
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
хеликобактерная инфекция
наличии инфекции Helicobacter pylori, наличие инфекции Helicobacter pylori, наличие инфекции H. pylori, наличие инфекции Н. pylori, Наличие инфекции Helicobacter pylon, инфекции Helicobacter pylori, инфекция Helicobacter pylori, подтвержденный факт наличия инфекции Helicobacter pylori, наличие Helicobacter pylori, инфекцию Helicobacter pylori, инфекциях, вызванных Helicobacter pylori, инфекцией Helicobacter pylori,


