- Эпидемиология рака желудка
- Фоновые заболевания
- Патоморфологические характеристики рака желудка
- Лимфатическая система желудка
- Лимфатическая сеть стенки желудка
- Париетальные и висцеральные регионарные лимфоузлы желудка
- Регионарные висцеральные лимфатические узлы желудка
- Клиническая картина рака желудка
- Предоперационное обследование и стадирование
- Клиническая классификация ЯАРЖ (JGCA, 1998)
- Лечение рака желудка
- Хирургическая тактика
- Основные принципы выбора метода резекции
- Выбор объема удаления желудка при раке различной локализации
- Методы реконструкции после гастрэктомии
- Заключение
- Рак проксимального отдела желудка
- Заключение
- Литература
C16 Злокачественное новообразование желудка, МКБ-10
- C16.0 Кардии
- C16.1 Дна желудка
- C16.2 Тела желудка
- C16.3 Преддверия привратника
- C16.4 Привратника
- C16.5 Малой кривизны желудка неуточненной части
- C16.6 Большой кривизны желудка неуточненной части
- C16.8 Поражение желудка, выходящее за пределы одной и более вышеуказанных локализаций
- C16.9 Желудка неуточненной локализации
Отредактировано: 02.04.2024
акад РАН и РАМН, проф. Давыдов М.И., к.м.н. Тер-Ованесов М.Д.,
д.м.н., проф. Полоцкий Б.Е., к.м.н. Туркин И.Н.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Эпидемиология рака желудка. Патоморфологические характеристики рака желудка. Лимфатическая система желудка. Клиническая картина рака желудка. Подходы к лечению рака желудка. Основные принципы выбора метода резекции. Химиотерапия рака желудка
Эпидемиология рака желудка
Несмотря на стабилизацию показателей заболеваемости, рак желудка (РЖ) по-прежнему остается одной из основных причин смерти от онкопатологии во всем мире. Россия по уровню заболеваемости занимает одно из ведущих мест в мире, и в нашей стране РЖ стабильно занимает 2 место у мужчин и 3 у женщин. Ежегодно заболевает 46 тыс. человек, а одногодичная летальность составляет 56%.
В США в конце прошлого века отмечалось наиболее значимое снижение частоты этого заболевания. Если в середине 50-х гг. ХХ в. среди мужского населения этот показатель был равен 22,8 на 100 тыс., преобладая среди белых, то к концу 80-х гг. частота его выявления составляла лишь 9 на 100 тыс. Среди женщин темпы снижения были более выраженными: с 12,3 до 4,3 на 100 тыс. Наиболее высокий уровень заболеваемости остается в таких странах, как Япония (78 на 100 тыс. населения) и Чили (70 на 100 тыс. населения). Чаще РЖ встречается у менее обеспеченных слоев населения, одинаково часто среди городского и сельского. Не отмечено связи частоты выявления РЖ и характера занятости.
Причина снижения заболеваемости до сих пор не имеет достаточно обоснованного научного объяснения. Один из факторов, с которым были связаны большие надежды на улучшение выявляемости ранних стадий рака желудка и, следовательно, улучшение результатов лечения — широкие скрининговые программы, но они не оправдали ожиданий. Единственной страной, в которой скрининг оказался эффективным в выявлении ранних стадий РЖ, является Япония.
Сравнительный анализ регионов с высоким и низким уровнем заболеваемости РЖ позволяет с некоторым приближением выделить возможные этиологические факторы этой патологии. К другим методам можно отнести популяционные эпидемиологические исследования, основанные на изучении этиологических факторов при изменении уровня заболеваемости у эмигрантов из стран с высоким уровнем заболеваемости в страны с более низким уровнем. Наиболее известной моделью таких исследований являются японцы, эмигрировавшие в США. У них отмечено уменьшение заболеваемости раком желудка в первом поколении с более значимым снижением во втором и третьем (более чем в 3 раза), приближающимся к уровню заболеваемости в стране. Эти данные позволяют выделить экзогенные факторы риска развития рака желудка.
Однако достоверных данных об этиологии заболевания до сих пор не получено.
К общепризнанным факторам риска развития рака желудка относятся:
— высокое содержание соли в продуктах (соленая и вяленая рыба, различные консерванты);
— высокое потребление нерафинированных жиров;
— низкое потребление молока и молочных продуктов;
— курение (в основном для жителей восточных регионов) в сочетании с употреблением алкоголя;
— употребление горячей пищи;
— высокое содержание афлотоксина в пище;
— нерегулярное питание.
К факторам профилактики риска развития рака желудка относятся высокое содержание в диете молока и молочных продуктов, овощей, фруктов и бобовых культур.
В настоящее время до конца не определено значение наследственных факторов в развитии рака желудка. В то же время можно говорить о генетической предрасположенности, которая увеличивает риск развития РЖ в 2 раза по сравнению с общепопуляционной. Наиболее характерным примером наследственной передачи высокого риска развития РЖ является семья Наполеона Бонапарта, где это заболевание выявлялось во всех поколениях.
По мнению некоторых исследователей, маркером более высокого риска развития рака желудка является группа крови, т.к. отмечается 15–20% увеличение частоты РЖ у людей со II (А) группой крови, что может быть обусловлено сцепленными с ней генетическими факторами.
В то же время окончательного заключения о влиянии генетических факторов на риск развития рака желудка в настоящее время нет.
Наиболее сильным экзогенным фактором риска является диета. Высококалорийная пища с включением животного мяса, копченостей и большим содержанием соли ассоциирована с высоким риском развития рака желудка. В противоположность этому, свежие фрукты, клетчатка и витамины являются защитными факторами (особенно для развития рака желудка интестинального типа). Профилактикой развития диффузного типа рака желудка является высокое содержание в пище витамина C.
Одной из достоверных причин развития рака желудка являются N-нитрозоамины, часто эндогенные. Пусковым моментом патогенеза является снижение кислотности желудочного сока, встречающееся при хроническом гастрите и способствующее развитию патогенной флоры, с увеличением синтеза нитросоединений.
В последнее десятилетие как вероятная рассматривается связь Helicobacter pylori с развитием рака желудка. Особенно сильно эта корреляция проявляется при длительном периоде инфицирования в зонах повышенного риска (Sipponen P., 1995), в старшей возрастной группе и снижается по мере уменьшения уровня инфицирования в популяции (Graham D.Y., 1993; Crespi M., 1996).
Механизм H. pylori-ассоциированного канцерогенеза связан со способностью микроорганизма вызывать выраженный инфильтративный гастрит с пролиферацией интерстициальных клеток. Длительный период воспаления вызывает процессы атрофии и кишечной метаплазии, которую следует рассматривать как предраковые изменения для последующего развития рака желудка кишечного типа. Хотя диффузный тип рака желудка не сочетается с кишечной метаплазией, H. pylori-инфекция обнаруживается при диффузных карциномах в 100% наблюдений, что, скорее, следует рассматривать не как этиологический фактор, а как суперинфекцию при снижении защитных сил слизистой желудка (Solcia E. et al., 1996).
Другим фактором, определяющим взаимосвязь H. pylori и канцерогенеза, является наличие в 60% штаммов микроорганизма cagA-онкогена. Причем штаммы, несущие cagA-онкоген, характеризуются более выраженным гастритом с наличием лимфоидной инфильтрации и более частой малигнизацией (Blaser M.J. et al., 1995).
Проведение эффективной эрадикации Helicobacter pylori инфекции снижает интенсивность атрофического гастрита и пролиферативную активность эпителия, что тормозит метапластические изменения в слизистой желудка, но не влияет на процессы выраженной дисплазии (Cahill R.J. et al., 1995).
Длительный латентный период, проходящий между инфицированием H. pylori и развитием рака желудка, включает в себя большое количество кумулирующих факторов, играющих роль в канцерогенезе.
Еще одним инфекционным агентом, возможно связанным с развитием рака желудка, является вирус Эпштейна—Барр. Опухоли, возникающие на фоне инфицирования этим вирусом, как правило, низкодифференцированные с выраженной лимфоидной инфильтрацией и описываются как лимфоэпителиомаподобный рак. С использованием современных технологий генной инженерии (гибридизации или ПЦР) вирус Эпштейна—Барр был выявлен в 80% опухолей с лимфоидной стромой и в 6–9% низкодифференцированных аденокарцином без лимфоидной инфильтрации (Nakamura S. et al., 1994).
Фоновые заболевания
Рак желудка с повышенной частотой встречается при некоторых заболеваниях желудка, которые следует рассматривать как фоновые:
— хронический атрофический гастрит,
— хроническая язва желудка и культи желудка после дистальной резекции,
— аденоматозные полипы желудка,
— кишечная метаплазия и гиперпластическая гастропатия.
Связь предраковых заболеваний с раком желудка наиболее ярко проявляется высокой частотой его развития на фоне исходных состояний.
Хронический атрофический гастрит (ХАГ)
В течение длительного времени с высокой частотой достоверности связывали хронический атрофический гастрит и рак желудка. Однако в дальнейшем эта последовательность в развитии рака желудка оказалась не столь очевидна, т.к. наличие атрофического гастрита еще не означает, что у пациента обязательно в последующем разовьется рак желудка. Ведь у 80–85% пожилых людей развивается атрофический гастрит той или иной степени выраженности. Однако в последующем рак желудка развивается лишь у единиц. В то же время наличие атрофического гастрита с выраженными изменениями в слизистой желудка является тем фоном, на котором будут происходить неопластические процессы. В странах Европы ХАГ выявляется у 22–37% пациентов РЖ. В Японии ХАГ диагностируется в 94,8% раннего рака желудка, а частота развития распространенного рака желудка у пациентов с ХАГ составляет до 13%.
При ХАГ в слизистой желудка отмечают пролиферацию с изменениями структуры клеток и такими нарушениями генома, как мутация р53 и анеуплоидия. В развитии ХАГ у пациентов с предшествующей резекцией желудка наиболее значимым фактором является рефлюкс с желчью щелочного дуоденального либо кишечного секрета.
В редких наблюдениях ХАГ развивается на фоне аутоиммунного фундус-гастрита, сочетающегося с пернициозной анемией.
Эпителиальные полипы
По своему течению эпителиальные полипы (ЭП) подразделяются на 2 типа:
— неопластические;
— не неопластические.
Не неопластические ЭП также разделяются в зависимости от этиологического фактора на:
— гиперпластические;
— гамартоматозные;
— гетеротопные;
— воспалительные.
Последние не имеют никакого злокачественного потенциала и никогда не трансформируются в злокачественную опухоль.
Гиперпластические полипы являются регенераторным разрастанием слизистой оболочки, что влияет на частоту малигнизации — около 2%.
Также крайне редко отмечается малигнизация в полипах гамартоматозного либо гетеротопного (преимущественно панкреатического) типов. При генетическом типе нарушений с развитием семейного полипоза в проксимальном отделе желудка могут выявляться аденоматозные полипы, при которых также могут быть выявлены генетические изменения (мутация гена аденоматозного полипоза ободочной кишки в 27% случаев). Однако никогда не выявляется мутация генов p53 и K-ras. Именно поэтому такие полипы не рассматриваются как предраковые состояния.
Неопластические эпителиальные полипы — это аденомы слизистой оболочки желудка. Как и не неопластические полипы, их можно разделить на типы, причем деление производится по макроскопической форме роста: плоский и папиллярный. Обычно эти изменения возникают на фоне исходно существующей метаплазии слизистой желудка.
Гистологически плоские аденомы построены из тубулярных структур, состоящих из умеренно диспластических эпителиальных клеток. Папиллярные аденомы из тубуло-вилезных желез, состоящих из умеренно выраженно диспластических клеток.
Частота развития рака на фоне неопластических аденом колеблется в достаточно широких пределах и коррелирует со степенью исходной дисплазии. Так, малигнизация плоских аденом встречается в 6–21% наблюдений, тогда как папиллярные аденомы подвержены малигнизации значительно чаще — в 20–76% случаев (Ming S.C., 1977).
Резекция желудка по поводу доброкачественного заболевания также является предрасполагающим фактором последующего развития рака оставшейся части желудка. Причины таких изменений, отсроченные во времени, до конца не ясны. Однако наиболее вероятным фактором является удаление основной массы париетальных клеток, ответственных за продукцию соляной кислоты. На фоне повышения рН желудочного сока начинают развиваться процессы метаплазии в слизистой оболочке оставшейся части желудка, что можно рассматривать как предраковые изменения. Время развития рака после резекции желудка составляет от 15 до 40 лет.
Длительное время дискутируется вопрос о взаимосвязи хронической язвы желудка и ее трансформации в рак. В начале 50-х гг. ХХ в. многие признавали факт возникновения рака в воспалительно измененных тканях края язвы. Однако последующие скрининговые исследования и результаты хирургического лечения хронических язв позволили отметить, что лишь 10% злокачественных опухолей желудка сочетались с хронической язвой, тогда как в 75% случаев это был первичный рак желудка, протекавший с изъязвлением. В настоящее время связь язвенной болезни желудка и рака желудка не рассматривается как достоверная.
Патоморфологические характеристики рака желудка
Из всех злокачественных заболеваний желудка до 95% составляют аденокарциномы. Кроме аденокарцином, среди злокачественных заболеваний желудка следует выделить:
— плоскоклеточный рак (1%);
— аденоакантому (1%);
— карциноидные опухоли либо эндокринно-клеточный рак (карциноид-аденокарцинома) — (1%);
— различные мезенхимальные опухоли стенки желудка — GIST (лейомиосаркомы, нейрогенные опухоли, шванномы и т.д., от 1 до 3%);
— экстранодулярные лимфосаркомы желудка (как наиболее часто встречающиеся лимфосаркомы ЖКТ).
Следует отметить тенденцию увеличения удельного веса лимфосарком желудка. Такой широкий спектр злокачественной патологии желудка предполагает высокий уровень знаний онколога-клинициста, независимо от его узкой специализации.
На современном этапе знаний простое выделение аденокарциномы желудка является недостаточным. Наиболее удобной является классификация японской ассоциации изучения рака желудка (Japanese Gastric Cancer Association, ЯАРЖ, 1998), согласно которой выделяют:
Дифференцированные аденокарциномы:
— папиллярную аденокарциному (pap);
— высокодифференцированную аденокарциному (tub1);
— умеренно дифференцированную аденокарциному (tub2).
Низкодифференцированную аденокарциному:
— сóлидный тип (por1);
— несóлидный тип (por2);
— перстневидноклеточный рак (sig);
— муцинозную аденокарциному (muc).
Специальные типы опухолей:
— плоскоклеточный рак;
— железисто-плоскоклеточный (диморфный) рак;
— карциноидные опухоли;
— прочие типы (мезенхимальные опухоли, лимфосаркомы и т.д.).
Основным ее достоинством является разделение аденокарциномы желудка на дифференцированную и низкодифференцированную, что может определять течение заболевания и общий прогноз.
В Европе многие используют более простую, однако прогностически ориентированную классификацию, предложенную патологом Laurence в 1953 г. Согласно этой классификации выделяют интестинальный, сóлидный и смешанный типы аденокарцином желудка. Интестинальный тип опухоли соответствует дифференцированным типам по классификации ЯАРЖ, тогда как сóлидный — в основном, низко- и недифференцированным типам опухоли. Смешанный тип, несмотря на черты как дифференцированных, так и низкодифференцированных опухолей по всем параметрам все же более соответствует последнему типу.
Однако морфологические и клинические характеристики рака желудка не исчерпываются лишь гистологическим типом самой опухоли. Помимо морфологических особенностей большую клиническую значимость имеют:
— глубина опухолевой инвазии стенки желудка;
— форма (тип) роста опухоли;
— и, возможно, наиболее важный фактор — распространенность и характеристика лимфогенного метастазирования.
Наибольшее клиническое значение имеет классификация формы роста, предложенная в 1926 г. немецким морфологом Borrmann (Parker A.E., 1935), согласно которой все опухоли желудка разделяются по типу роста на:
1. Грибовидный или полиповидный тип, имеющий экзофитный рост в просвет желудка.
2. Экзофитно-изъязвленный тип опухоли — характеризуется изъязвлением с приподнятыми омозоленными краями, имеющими четкую границу с окружающей слизистой желудка, т.н. блюдцеобразный рак.
3. Язвенно-инфильтративный тип — характеризуется изъязвлением, без четких границ с окружающей слизистой желудка и интрамуральной инфильтрацией желудочной стенки.
4. Диффузно-инфильтративный тип — характеризуется диффузным поражением стенки желудка, зачастую с минимальными изменениями на уровне слизистой оболочки и диффузным поражением остальных слоев стенки желудка по типу пластического линита органа (linitis plastica).
В классификации ЯАРЖ к этим четырем типам роста добавлен пятый, неклассифицируемый тип, сочетающий в себе элементы разных типов роста опухоли.
Следует отметить, что многие авторы особняком выделяю диффузно-инфильтративные формы рака желудка, что обусловлено несколькими причинами.
Во-первых, это длительное бессимптомное или малосимптомное течение, связанное с отсутствием острой манифестации различных осложнений (дисфагия, стеноз выходного отдела, перфорация) и проявляющееся различными формами диспепсии (которые в старых учебниках часто рассматривалось как синдром малых признаков).
Во-вторых, своеобразие рентгено-эндоскопических данных — диффузное изменение стенки желудка с развитием ригидности, циркулярного сужения (желудок изменен по типу кожаного сосуда) (рис. 1), утолщения стенок и плохого расправления складок на фоне инсуфляции воздуха. Своеобразие морфологической картины — гнездное включение опухолевых клеток в виде очагов в слизистую оболочку желудка с диффузной инфильтрацией слоев на фоне выраженной стромальной реакции с развитием интерстициального фиброза. Отличны подходы к тактике хирургического и комбинированного лечения. Однако главным отличием данной формы рака желудка является крайне неблагоприятный прогноз. Абсолютное большинство пациентов поступают на лечение в распространенных стадиях заболевания. Истинно радикальные вмешательства удается выполнить крайне редко, что отражается на отдаленных результатах — 5 лет наблюдения переживает не более 5% пациентов. Основным видом прогрессирования после радикального лечения является интраперитонеальный рецидив в виде канцероматоза брюшины.
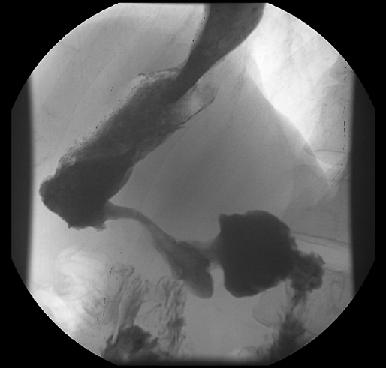
Рисунок 1. Тотальный рак желудка
Локализация опухоли в желудке имеет свои закономерности и некоторую прогностическую значимость.
Наиболее часто встречается рак антрального отдела желудка (рис. 2) и пилорического канала — более 40%.
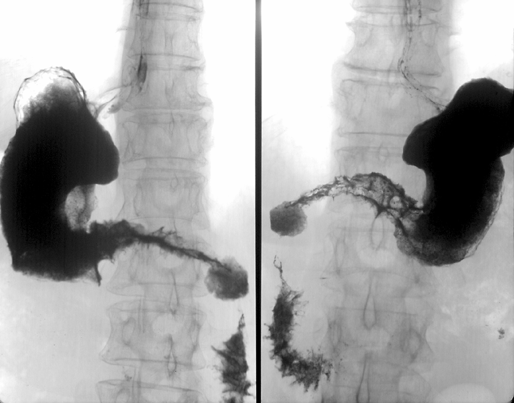
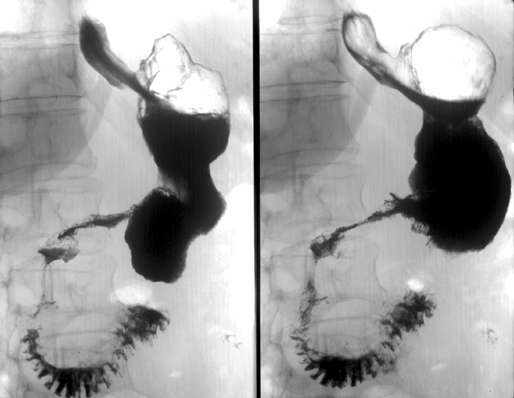
Рисунок 2. Рак антрального отдела желудка
Второй по частоте — рак тела желудка либо антрального отдела с распространением на тело — около 30% наблюдений.
Вдвое реже отмечается рак проксимального отдела желудка, часто с распространением инфильтрации на н/3 пищевода — т.н. кардио-эзофагеальный рак (рис. 3) — его частота не превышает 20%. Следует отметить, что в последние два десятилетия эпидемиологи, в основном в Западном полушарии, отмечают увеличение частоты рака проксимального отдела желудка с распространением на пищевод (рис. 4) и снижение частоты рака дистального отдела желудка (Yoshida S., Yamaguchi H. et al., 1993). Этот феномен до сих пор не нашел достаточного теоретического обоснования, однако, является общепризнанным фактом. В некоторой степени снижение частоты рака дистального отдела желудка может быть связано со снижением уровня инфицированности населения H. pylori (возможный этиологический фактор). Чаще рак желудка возникает на малой кривизне — 20–25% и значительно реже на большой — около 3%. Относительно часто (более 2%) в желудке отмечается мультицентрический рост опухоли, что косвенно подтверждает теорию опухолевого поля.
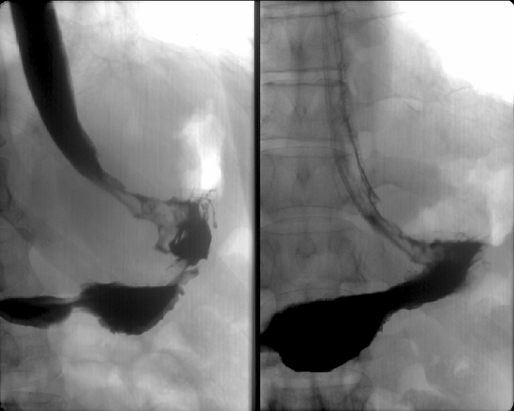
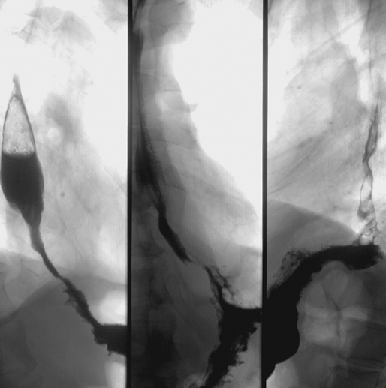
Рисунок 3. Рак проксимального отдела желудка
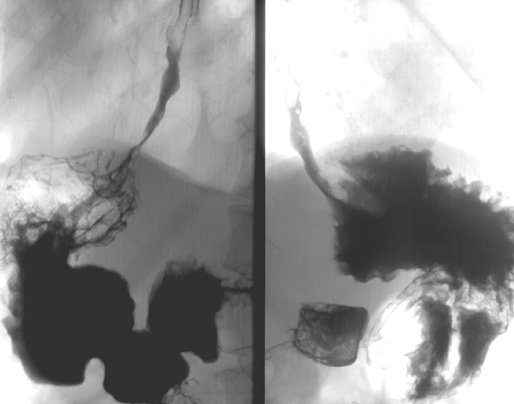
Рисунок 4. Рак проксимального отдела желудка с переходом на пищевод
Согласно большим статистическим исследованиям, более благоприятный прогноз при раке дистального отдела желудка — 5-летняя выживаемость превышает 30%. Промежуточное положение занимает рак тела желудка — выживаемость несколько ниже, чем при раке антрального отдела — от 25 до 30%. Наименее благоприятно протекает рак проксимального отдела желудка, особенно при распространении инфильтрации на пищевод — выживаемость около 20 и 15% соответственно.
Лимфатическая система желудка
Лимфатическая сеть стенки желудка
Лимфатическая система желудка играет важную роль в интрамуральном и лимфогенном распространении РЖ. Сама слизистая оболочка желудка лимфатических сосудов не содержит. Однако подслизистый слой несет в себе широкую лимфатическую сеть, формируя первый лимфатический пояс желудочной стенки. Из него лимфатические капилляры проникают через мышечный слой стенки желудка, формируя широкие лимфатические сплетения межмышечного и субсерозного слоев.
Несмотря на наличие широких лимфатических сплетений подслизистого, межмышечного и субсерозного слоев, у них отсутствует какая-либо автономность лимфооттока от различных отделов желудка: при введении красителей в стенку желудка и окрашивании лимфатической сети визуализируется огромное число анастомозов между лимфатическими сосудами, идущими из различных отделов органа.
Также примерно в 10% случаев выявляются лимфовенозные анастомозы, встречающиеся чаще в области малой кривизны и верхней половины желудка. Связь лимфатической сети желудка и двенадцатиперстной кишки выражена очень слабо. По мере приближения к привратнику лимфатическая сеть желудка истончается и, не доходя 0,5–1,0 см до привратника, лимфатические сосуды чаще всего обрываются. Лишь в единичных случаях наблюдается переход 1–3 тонких лимфатических сосудов субсерозной лимфатической сети желудка на стенку двенадцатиперстной кишки (Печатникова Е.А., 1967). Этот фактор определяет редкое распространение рака желудка на двенадцатиперстную кишку, особенно на ретробульбарные отделы.
Напротив, лимфатическая система пищевода и желудка связана как через прямые лимфатические сосуды зоны пищеводно-желудочного перехода, так и через непрямые, опосредованные лимфатические сосуды, зачастую прерывающиеся в паракардиальных и нижних параэзофагеальных лимфатических узлах. Этим объясняется известный факт значительно более частого распространения опухоли желудка на пищевод по сравнению с переходом ее на двенадцатиперстную кишку.
Париетальные и висцеральные регионарные лимфоузлы желудка
Приоритет разделения лимфатических узлов брюшной полости на висцеральные и париетальные принадлежит Poirier и Cuneo (1902). Париетальные лимфоузлы они выделяли как пояснично-аортальные, которые в свою очередь разделяли на левые и правые околоаортальные, преаортальные и ретроаортальные.
Rоuviere H. представил в 1932 г. наиболее удобную и скрупулезную классификацию лимфатической системы брюшной и грудной полостей (Жданов Д.А., 1945). Он также разделял лимфатические узлы брюшной полости на париетальные и висцеральные. Париетальные или абдоминоаортальные узлы, общее количество которых, по его данным, составляет 40–50, были разделены на преаортальные, левые и правые латероаортальные и ретроаортальные цепи узлов, тогда как висцеральные узлы брюшной полости — на 2 большие группы:
— лимфоузлы по ходу ветвей чревного ствола;
— лимфоузлы, принадлежащие ветвям верхней и нижней брыжеечных артерий.
Классификацию Rоuviere H. впоследствии развили Parker (1935), Жданов Д.А. (1945) и др. Работы этих анатомов по настоящее время являются основополагающими в понимании механизма метастазирования злокачественных опухолей и, в частности, лимфогенного метастазирования рака желудка.
Регионарные висцеральные лимфатические узлы желудка
Согласно исследованиям Rоuviere H. (1932), регионарные висцеральные узлы желудка располагаются вдоль ветвей а. сoeliaca в толще жировой клетчатки.
На сегодняшний день наиболее удачной классификацией регионарных лимфатических узлов желудка, имеющей большое практическое значение, является второе Английское издание, основанное на 13 издании классификации Основных правил исследования и лечения рака желудка, разработанное ЯАРЖ и опубликованное в 1998 г.
Согласно Основным правилам, регионарные лимфатические узлы желудка (см. рис. 5 на цветной вклейке) разделяются на 3 этапа регионарного метастазирования. Такое разделение основано на прогностической значимости поражения различных групп лимфатических узлов в зависимости от локализации первичной опухоли в желудке. Наиболее часто к лимфатическим узлам первого этапа метастазирования относятся перигастральные лимфатические узлы, расположенные в поверхностных связках желудка. В зависимости от локализации эти лимфатические узлы разделяются на 6 групп:
1. Правые паракардиальные лимфатические узлы, расположенные справа от пищевода и пищеводно-желудочного перехода в области диафрагмально-пищеводной связки. Обычно эта группа насчитывает от 2 до 4 лимфоузлов. В них оттекает лимфа от проксимального отдела желудка, правой полуокружности пищеводно-желудочного перехода. Эфферентные сосуды от паракардиальных лимфоузлов соединяются с ближайшими к чревному стволу узлами цепочек, принадлежащих к a. hepatica communis и a. lienalis. Следует особо отметить, что паракардиальные лимфоузлы также напрямую связаны с верхними парааортальными лимфоузлами, расположенными в области пищеводного отверстия диафрагмы и левой диафрагмальной ножки посредством короткого поддиафрагмального лимфатического пути (subphrenic lymphatics).
2. Левые паракардиальные лимфатические узлы, расположенные слева от пищевода и пищеводно-желудочного перехода в области дна желудка. Обычно эта группа насчитывает от 1 до 3 лимфоузлов. В эти узлы оттекает лимфа от зоны пищеводно-желудочного перехода и дна желудка.
3. Лимфатические узлы малой кривизны желудка. Они расположены вдоль малой кривизны в малом сальнике. Наиболее проксимально расположенные лимфоузлы, идущие вдоль дистальных отделов левой желудочной артерии рассматриваются как верхние перигастральные лимфоузлы, хотя в целом эта группа узлов не разделяется на подгруппы.
4. Лимфатические узлы большой кривизны желудка. Эта группа представляет достаточно большое количество узлов, расположенных вдоль большой кривизны по ходу левых и правых желудочно-сальниковых сосудов и коротких артерий желудка, что позволяет разделять эту группу на 3 подгруппы:
— правые лимфатические узлы, расположенные по ходу правой желудочно-сальниковой артерии;
— левые лимфатические узлы, расположенные вдоль левой желудочно-сальниковой артерии от уровня задней артерии желудка и вправо;
— лимфатические узлы, расположенные вдоль коротких артерий желудка в желудочно-селезеночной связке.
5. Супрапилорические лимфатические узлы, расположенные по верхней и задней полуокружности пилорического отдела желудка вдоль правой желудочной артерии и по ходу проксимального отдела желудочно-двенадцатиперстной артерии. Эти узлы расположены частично сверху, частично позади пилорического отдела и включают от 2 до 4 лимфоузлов. В них оттекает лимфа от верхней полуокружности дистального отдела желудка и пилорического канала.
6. Субпилорические лимфатические узлы желудка, расположенные по нижней полуокружности пилорического отдела желудка, по ходу правой желудочно-сальниковой артерии и дистальных отделов желудочно-двенадцатиперстной артерии, в зоне ее ветвления, на передней поверхности головки ПЖЖ. Эта группа насчитывает от 3 до 6 лимфатических узлов. В эти лимфоузлы оттекает лимфа от нижней полуокружности дистального отдела желудка, большой кривизны и пилорического канала.
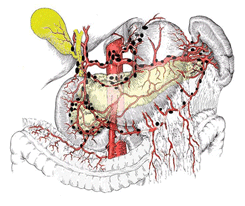
Рисунок 5. Лимфоузлы желудка перигастральные, по ходу чревного ствола и его ветвей
К лимфатическим узлам второго этапа метастазирования относятся узлы, расположенные по ходу чревного ствола и его ветвей: левой желудочной, общей печеночной и селезеночной артерий, а также в воротах селезенки. Некоторые лимфатические узлы из этих групп разделяются на подгруппы в зависимости от их локализации по отношению к поверхности сосуда или к его сегменту.
7. Наиболее простой является группа узлов, расположенных по ходу левой желудочной артерии от ее проксимального отдела до места расположения артерии вдоль малой кривизны. Так как левая желудочная артерия проходит в желудочно-поджелудочной связке, то и лимфатические узлы располагаются в связке, что определяет хирургический доступ при их удалении (либо передний, через малый сальник, либо задний, через большой сальник в полости сальниковой сумки).
8. Лимфатические узлы, расположенные вдоль общей печеночной артерии до уровня отхождения желудочно-двенадцатиперстной артерии. Лимфатические узлы этой группы подразделяются на подгруппы передних и задних узлов, в зависимости от расположения по отношению к артерии. К этим узлам оттекает лимфа от лимфатических узлов малой кривизны желудка и супрапилорических, хотя возможно и непосредственный отток из стенки желудка либо ретроградное их вовлечение из узлов чревной группы, либо узлов, расположенных по ходу левой желудочной артерии.
9. Лимфатические узлы, расположенные вдоль чревного ствола от его отхождения от аорты до уровня деления. Вокруг чревного ствола расположены элементы солнечного сплетения, с приходящими сюда чревными нервами и лимфатическое сплетение. В чревные узлы стекается лимфа из цепочек узлов по ходу аa. gastrica sin., lienalis, hepatica. Из чревного лимфатического сплетения эфферентные лимфатические протоки продолжаются в верхнее парааортальное сплетение, расположенное от уровня аортального отверстия диафрагмы и зоны чревного ствола до уровня нижней полуокружности левой почечной вены.
10. Лимфатические узлы, расположенные вдоль дуги селезеночной артерии в воротах селезенки. Эта группа включает от 3 до 5 узлов, расположенных в воротах органа. В эти узлы оттекает лимфа от перигастральных лимфоузлов в области проксимального отдела желудка, преимущественно от большой кривизны, а также от дистальных узлов, расположенных по ходу селезеночной артерии.
11. Лимфатические узлы, расположенные по ходу селезеночной артерии. Эта группа лимфатических узлов, пожалуй, является наиболее многочисленной. В зависимости от их топического расположения узлы этой группы разделяются на проксимальные, расположенные до зоны отхождения задней артерии желудка, и дистальные после ее отхождения до ворот селезенки. Группа насчитывает от 6 до 10 узлов, располагающихся вдоль ПЖ по ходу селезеночной артерии и частично уходящих за ПЖ в область левой почечной вены, левого надпочечника и его сосудов.
Различные группы лимфатических узлов, даже в пределах одного лимфатического коллектора, либо расположенные в перигастральном коллекторе, могут рассматриваться как следующий или отдаленный этап лимфогенного метастазирования. Это зависит от локализации первичной опухоли в различных отделах желудка и определяется прогностической значимостью метастатического поражения этих коллекторов, т.е. основывается на результатах выживаемости. Такие исследования были проведены в Японии, что и послужило основанием для последнего пересмотра классификации. Так, если в предыдущей классификации были выделены 4 этапа метастазирования N0-N1-N2-N3-N4, то последняя классификация включает лишь 3 этапа N0-N1-N2-N3, что определяется анализом результатов выживаемости, и в первую очередь сравнением результатов при поражении лимфатических узлов 3 и 4 этапов метастазирования.
Клиническая картина рака желудка
Большинство опубликованных работ по раку желудка отмечают длительное бессимптомное течение заболевания с развитием различных проявлений желудочной диспепсии. К этим симптомам большинство авторов относят:
— тяжесть в эпигастрии, усиливающуюся после еды;
— отрыжку;
— железодефицитную анемию легкой или средней степени;
— слабость;
— раннюю утомляемость;
— похудание.
Из данного списка, который, конечно же, является неполным, однозначно сложно судить о заболевании желудка и еще сложнее — о его характере. Поэтому без тщательного клинического обследования нельзя поставить правильный диагноз и определить план лечения. В связи с этим начало проведения консервативной терапии от “хронического гастрита” или “рефлюкс-эзофагита” лишь оттянут время, давая фору заболеванию. Причем у трети пациентов уже на этом этапе заболевание носит распространенный характер, и правильное клиническое обследование может выявить симптомы распространенности:
— метастазы в надключичные лимфоузлы;
— пальпируемую опухоль верхней половины живота;
— асцит.
Сравнительный анализ жалоб и первичных проявлений у пациентов с резектабельным и нерезектабельным раком желудка не выявляет достоверных различий. Единственным достоверным отличием являются дисфагия и симптомы пищеводного рефлюкса у пациентов раком проксимального отдела желудка.
Появление и проградиентное нарастание специфических симптомов может более явно свидетельствовать о поражении желудка злокачественной опухолью, что и предопределяет клинический поиск. Так, появление и нарастание дисфагии свидетельствует о поражении проксимального отдела желудка с вовлечением дистальных отделов пищевода и развитием обструкции последнего. При появлении постоянной тошноты и рвоты, особенно после еды или съеденной накануне пищей, может свидетельствовать об обструкции выходного отдела желудка. Помимо этих осложнений, сопутствующих интрамуральной распространенности опухоли, у пациентов могут манифестировать симптомы, связанные с перигастральной или интраперитонеальной распространенностью опухоли. Так, рак желудка может прорастать поперечно-ободочную кишку с развитием непроходимости на этом уровне. Интраперитонеальная опухолевая диссеминация может вызвать кишечную непроходимость, зачастую на нескольких уровнях как тонкой, так и толстой кишки. Развитие у пациента метастаза Шницлера-Блюма в клетчатку дугласова кармана может вызвать обструкцию толстой кишки.
Однако следует помнить, что появление симптомов осложненного течения заболевания, особенно признаков системной распространенности, свидетельствует о его запущенности и, как правило, о невозможности радикального лечения.
Наиболее часто отдаленные метастазы выявляются в печени — практически в 2 раза чаще, нежели в других, часто поражаемых областях, таких как брюшина и сальники. Другими часто поражаемыми органами также являются легкие, затем надпочечники и кости. В то же время селезенка, несмотря на бытующее представление о ее частом поражении вовлекается в процесс как орган отдаленного метастазирования достаточно редко — менее 10%. Однако, ворота селезенки достаточно часто вовлекаются в процесс за счет лимфогенного метастазирования, что определяет практически облигатное ее удаление в случаях поражения тела и проксимального отдела желудка.
Обоснованное подозрение о распространенности заболевания может быть получено уже на основании клинического обследования пациента. Зонами обязательного тщательного осмотра являются: левая надключичная область (метастаз Вирхова в левые надключичные лимфоузлы) и область пупка (метастаз сестры Джозеф в пупок), что свидетельствует не о лимфогенном, а об интраперитонеальном распространении опухоли. Выявление отдаленных метастазов в этих зонах может быть достаточным для морфологической верификации процесса и начала консервативной терапии.
Рак желудка может проявиться желудочным кровотечением. Следует отметить, что при небольшой кровопотери, которая сопровождается развитием железодефицитной анемии и выявлением скрытой крови в стуле, профузное желудочное кровотечение встречается достаточно редко.
Предоперационное обследование и стадирование
Радикальное лечение рака желудка предусматривает полное удаление первичной опухоли и зон возможного метастатического поражения. На сегодняшний день этому принципу соответствует только хирургическое лечение, которое позволяет добиться полного излечения.
Определяя показания к хирургическому лечению, врач должен руководствоваться объективными данными клинического и физикального обследования пациента, на основании которых производится предоперационное клиническое стадирование заболевания и оценивается функциональная операбельность.
Предоперационное обследование больного раком желудка можно условно разделить на клинико-инструментальное исследование местной и отдаленной распространенности опухолевого процесса, также функциональное и лабораторное исследование состояния органов и систем.
Обязательным следует считать дооперационное морфологическое исследование биоптата, которое в сочетании с характеристикой типа роста опухоли (по классификации Borrmann, 1926) позволяет планировать адекватный объем хирургического вмешательства.
Алгоритм инструментального обследования следует строить на основании знания возможных путей распространения первичной опухоли. Рак желудка характеризуют 4 основные пути распространения:
— рост по протяженности органа с распространением на смежные отделы ЖКТ (пищевод, двенадцатиперстная кишка);
— прорастание стенки желудка с инвазией в окружающие органы (поджелудочная железа, печень, диафрагма, поперечно-ободочная кишка, почки и т. д.);
— лимфогенное метастазирование по экстрамуральным лимфатическим сосудам в зоны регионарного лимфогенного метастазирования с поражением лимфатических узлов и возможной перинодальной опухолевой инвазией клетчатки;
— отдаленное гематогенное метастазирование в органы.
Для исследования характера опухолевой инфильтрации по желудку всем больным выполняются рентгенологическое и эндоскопическое исследования. Только комбинация обоих методов позволяет оценить характер опухолевой инфильтрации по желудку с возможным переходом на смежные структуры ЖКТ по протяжению (пищевод, двенадцатиперстная кишка) и классифицировать тип опухолевого роста, что является интегральным показателем, объединяющим данные рентгенологического и эндоскопического обследования.
Рентгенологическое исследование является основным при определении локализации и протяженности поражения стенки желудка. В процессе рутинного рентгенологического исследования желудка, независимо от локализации первичной опухоли, чрезвычайно важно тщательное исследование всех отделов органа в связи с возможным мультицентрическим характером роста или наличием интрамуральных метастазов.
Согласно классификации ЯАРЖ 1998 г., орган разделяется на 3 отдела: верхнюю, среднюю и нижнюю трети. Детальное разделение желудка на отделы помимо четкого представления об уровне поражения позволяет хирургу оценить топографо-анатомические взаимоотношения и возможные варианты опухолевой инвазии в окружающие структуры, а также до операции характеризовать основное направление лимфогенного метастазирования, что является немаловажным при планировании дальнейшего обследования и хирургического лечения.
Рентгенологическое обследование целесообразно проводить комплексно, используя тугое заполнение и двойное контрастирование. Первый метод наиболее информативен при экзофитных опухолях, второй (включающий сочетанное применение бария с шипучими субстанциями на фоне релаксации стенки желудка с применением глюкагона) — позволяет оценить интрамуральную инфильтрацию желудочной стенки и вовлечение смежных структур (пищевод, двенадцатиперстная кишка) на протяжении. Основным преимуществом метода двойного контрастирования является возможность детального изучения минимальных изменений слизистой (за счет расправления желудка газом), а также — тщательного изучения проксимального отдела желудка, что невозможно при применении лишь тугого заполнения.
Следует отметить, что все больные с выявленными при рентгенологическом исследовании язвами желудка должны обязательно дополнительно проходить эндоскопическое исследование с морфологической верификацией изменений слизистой в области язвы. Суждение о характере язвы лишь на основании данных рентгенологического исследования не может на сегодняшний день рассматриваться как достоверное.
Эндоскопическое исследование является одним из наиболее информативных методов диагностики рака желудка, т.к. при нем определяются:
— граница, характер и форма роста опухоли;
— распространение инфильтрации на пищевод;
— наличие осложнений.
В ряде случаев выполняется хромоэндоскопическое исследование слизистой желудка. Для этого слизистая окрашивается 0,1% раствором индигокармина либо метилтиониния хлоридом. Метод позволяет более детально устанавливать:
— границы инфильтрации даже при эндофитном распространении по подслизистому слою;
— наличие синхронной опухоли и интрамуральных пылевидных метастазов в стенке желудка на уровне подслизистого слоя.
Перспективным в плане комплексной диагностики интрамуральной и лимфогенной распространенности опухолевого процесса является применение эндоскопического ультразвукового исследования (ЭУЗИ). Данный метод аккумулирует в себе возможности эндоскопического и ультразвукового исследований, что позволяет с высокой степенью достоверности определить интрамуральную распространенность процесса, включая:
— глубину опухолевой инвазии в стенку желудка;
— наличие метастатически измененных лимфатических узлов, причем не только перигастральных, но и забрюшинных и даже парааортальных.
Может быть выполнено контролируемое получение пункционного материала из перигастральных лимфоузлов или асцитической жидкости с целью морфологической верификации. Согласно данным Murata Y. et al. (1999), при определении глубины опухолевой инвазии (символ сТ) достоверность составляет 77% для Т1, 56% для Т2, 83% для Т3 и 57% для Т4. Несколько лучшая чувствительность и специфичность отмечены при определении лимфогенных метастазов: соответственно 78% и 85% при общей достоверности метода 82%. По мнению автора, при общей высокой разрешающей способности метода в предоперационном стадировании рака желудка, последний является обязательным при проведении эндоскопических резекций слизистой при раннем раке (наибольшая общая достоверность метода при Т1 — 91%).
Таким образом, на основании рентгенологического и эндоскопического методов возможно получить исчерпывающую информацию об особенностях опухолевого роста внутри желудка и определить:
— локализацию опухоли;
— протяженность поражения;
— анатомическую форму роста с подробным изучением характера изъязвления;
— распространение опухолевой инфильтрации по окружности желудочной стенки, а также переход инфильтрации на пищевод;
— наличие интрамуральных метастазов.
Обязательным методом исследования больных раком желудка является УЗИ органов брюшной полости, забрюшинного пространства. У женщин в стандартное исследование необходимо включать органы малого таза. Метод не является инвазивным, не имеет побочных эффектов, характеризуется высокой чувствительностью (до 96%) и специфичностью (до 87%). В стандартный объем необходимо включать исследование лимфатических узлов шейно-надключичной области.
В последнее время многие авторы публикуют данные о достаточно высокой эффективности применения экстракорпорального УЗИ для оценки глубины инвазии стенки желудка и предоперационного определения символа cT. Метод характеризуется достаточно высокой чувствительностью (76,3%). Наибольшая достоверность отмечается при опухолях, ограниченных слизистой-подслизистым слоем (сТ1) — 87,1%, а также при прорастании серозной оболочки, либо вовлечении окружающих структур (сТ3/Т4) — 76,9%. В случаях, когда глубина инвазии ограничивается мышечной оболочкой, особенно при прорастании до уровня субсерозы, зачастую происходит гипердиагностика глубины инвазии, что отражается на достоверности метода — лишь 51,4%. По мнению многих авторов, экстракорпоральное УЗИ должно использоваться шире с целью дооперационного стадирования интрамуральной распространенности процесса (Natsugoe S. et al., 1996; Uenosono Y. et al., 2001).
Место КТ в предоперационной диагностике и стадировании рака желудка до сих пор остается неопределенным. Однако в последнее время благодаря применению современных спиральных томографов и методов контрастирования (прием пероральных контрастных растворов с одновременным выполнением контрастирования сосудов чревной группы) в сочетании с возможностью построения трехмерного 3D-изображения, отмечено улучшение разрешающей способности метода. Так, согласно данным Cho J.S. (1999), при проведении спиральной КТ и выполнении двухфазного исследования на фоне перорального и в/в контрастирования общая достоверность при определении символа сТ составила 74%. При определении метастазов в лимфатические узлы (согласно автору, критериями поражения лимфатических узлов являются узлы с наименьшим измеряемым диаметром более 8 мм, либо конгломераты узлов до 8 мм в диаметре) чувствительность, специфичность и общая точность составили 84, 41 и 67% соответственно.
Помимо эзофагогастроскопического и рентгенологического исследований из инвазивных методик все большее клиническое применение находит лапароскопия. Обоснованием данного метода как стандартного при проведении предоперационного обследования распространенности и стадирования процесса следует считать высокую частоту интраперитонеальной диссеминации рака желудка, зачастую недиагностированную при неинвазивных методах обследования, а также подозрение на наличие субкапсулярных образований в печени, выявленных при УЗИ и КТ-исследованиях. В последнее время с целью повышения возможностей лапароскопической диагностики широкое применение находит методика лапароскопической ультразвуковой компьютерной диагностики. Благодаря применению УЗИ значительно повышается разрешающая способность метода (чувствительность и специфичность), особенно при исследовании паренхимы печени и состояния забрюшинного пространства.
На сегодняшний день лапароскопическое исследование является обязательным методом в предоперационном стадировании рака желудка и должно рутинно выполняться всем пациентам.
Однако, несмотря на значительное повышение разрешающей способности диагностических процедур, отработку и оптимизацию методик исследования, окончательное заключение об истинной распространенности процесса с возможностью выполнения радикальной операции зачастую удается получить лишь при интраоперационной ревизии.
После всестороннего обследования больного раком желудка с учетом распространенности опухолевого процесса и функциональной переносимости производится отбор пациентов на радикальное хирургическое вмешательство.
Показания к радикальному хирургическому вмешательству:
1. Возможность полного удаления первичной опухоли.
2. Отсутствие отдаленных метастазов и диссеминации процесса по брюшине.
3. Функциональная переносимость вмешательства.
К отдаленным метастазам, помимо выявляемых при обследовании оргáнных метастазов (печень, легкие, кости, почки, надпочечники, головной мозг), также относятся следующие зоны возможного поражения, специфически характерные для рака желудка:
- Метастаз Вирхова (вирховская железа) — метастаз в левые надключичные лимфатические узлы, расположенные между ножек m. sternoclaidomastoideus. Увеличенный размер, форма и специфическая консистенция лимфатических узлов данной группы являются показаниями к выполнению УЗИ шейно-надключичной зоны с последующей пункционной биопсией.
- Метастазы Шницлера — метастазы в параректальную клетчатку. Данное поражение выявляется при исследовании пациента per rectum. В случае возникновения у клинициста подозрения на наличие метастазов Шницлера необходимо выполнение трансректального УЗИ с последующей пункционной верификацией.
- Метастазы Крукенберга* — метастазы в яичники. Данное поражение наиболее часто выявляется при УЗИ брюшной полости. В случае выявления увеличения яичников, либо при прямом подозрении на их поражение, пациенткам выполняется лапароскопическое исследование с визуальной и морфологической оценкой характера процесса.
- Опухолевые отсевы по брюшине, выявляемые при лапароскопическом исследовании.
*Метастазы Крукенберга рассматриваются не как гематогенные или имплантационные, а как лимфогенные метастазы, косвенно свидетельствующие о широком поражении парааортального лимфатического коллектора. Этим также обусловлено обязательное двустороннее поражение яичников. Учитывая такой механизм поражения, метастазы Крукенберга не рассматриваются как противопоказание к хирургическому лечению. Однако у пациенток с такой распространенностью изначально необходимо планировать выполнение расширенной парааортальной лимфодиссекции D3 с двусторонней овариэктомией.
Следует особо отметить, что, с учетом характера заболевания и современной тактики хирургического лечения окончательно уточнить возможность выполнения радикального вмешательства позволяет лишь интраоперационная острая ревизия, т.е. рассечение связочного аппарата с мобилизацией желудка и вовлеченных в процесс структур, визуализация основных сосудов и оценка возможности выполнения моноблочной комбинированной резекции.
Клиническая классификация ЯАРЖ (JGCA, 1998)
С нашей точки зрения, наиболее детальной, а следовательно, и практически ценной является классификация ЯАРЖ, которая позволяет определять тактику лечения, варьируя в спектре: эндоскопические вмешательства (эндоскопические мукозэктомии) — лапароскопические вмешательства — расширенные вмешательства D2–D3 — протоколы комбинированного лечения (с применением неоадъювантной химиотерапии).
Основной ее характеристикой является детальный подход в описании самой опухоли, включая:
— морфологическую классификацию;
— локализацию;
— форму роста;
— глубину инвазии в сочетании с топографическим подходом в классификации регионарных лимфатических коллекторов.
В настоящей классификации именно данные морфологических исследований, выполняемых на всех этапах лечения (особенно пред- и интраоперационные) определяют стадирование и тактику лечения. Процесс стадирования выполняется на всех этапах лечения, что отражается в индексе, располагающемся перед стадией по TNM. Причем стадирование разделяется на следующие типы и не меняется после первичного определения:
— клиническое (c);
— хирургическое (s);
— морфологическое (p);
— окончательное (f).
Как местная, так и системная распространенность первичной опухоли описывается заглавными индексами:
T (tumour) — глубина инвазии первичной опухолью стенки желудка;
N (nodulus) — распространенность лимфогенных метастазов по уровням лимфатических коллекторов;
M (metastasis) — наличие отдаленных органных метастазов.
<
Описание первичной опухоли
Первичная опухоль описывается в зависимости от локализации в различных отделах (третях) стенки желудка:
U (upper third) — проксимальная треть;
M (middle third) — тело;
L (lower third) — антральный отдел;
а также в зависимости от расположения по окружностям стенки:
на передней (ant) или задней (post) стенке;
малой (less) или большой (gre) кривизне.
При циркулярном поражении стенки органа указывается индекс Circ (circumferencial inviolvement).
Глубина инвазии стенки желудка определяется индексом Т. Однако, в связи со значительным возрастанием частоты выявления раннего рака желудка и, следовательно, возможностью эндоскопического лечения, а также расширением показаний к выполнению лапароскопических вмешательств обязательным является дополнение индекса Т данными о глубине прорастания:
— в пределах слизистой — m (mucosa);
— в пределах подслизистого слоя — sm (submucosa);
— до мышечной оболочки — mp (muscularis propria), субсерозно — ss (subserosa);
— с выходом на серозную оболочку — se (serosa exposed);
— и врастанием в окружающие структуры — si (serosa infiltrating).
В классификации приведено разделение опухолей, рассматриваемых как ранний рак желудка, с индексом Т1 и прорастанием подслизистого слоя в зависимости от глубины инвазии на sm1 — <0,5 мм от собственно мышечной оболочки слизистой и sm2 — >0,5 мм. Эти данные играют роль при определении показаний к выполнению эндоскопических вмешательств (эндоскопических мукозэктомий), а также к выполнению открытых операций на желудке после выполнения эндоскопических мукозэктомий, которые рассматриваются в данном случае не как радикальное лечение, а как тотальная биопсия опухоли.
Также необходимо выделить такую особенность, как обязательное исследование всех границ удаленного эндоскопически фрагмента слизистой с очаговым поражением. С этой целью производится морфологическое исследование не только латеральных границ резецированного фрагмента (что определяется согласно классификации как латеральные границы, Lateral margins — LM, но и вертикальных границ, Vertical margins — VM. Это позволяет с высокой надежностью определить глубину опухолевой инвазии. В свою очередь, глубина опухолевой инвазии, превышающая 0,5 мм (sm2), определяет, согласно данным литературы и рекомендациям ЯАРЖ, необходимость выполнения открытого вмешательства.
Другой особенностью данной редакции Основных правил является разработка клинической классификации рака оперированного желудка. Данная классификация включает 3 основные пункта, описывающие анамнез и характер поражения культи желудка:
— причина предшествующей операции на желудке (доброкачественная, злокачественная, неопределенная);
— время, прошедшее после вмешательства (в годах);
— локализация опухоли (анастомоз (A), линия механического шва (S), другая локализация в культе (O), тотальное поражение (T), а также переход на пищевод (E), тощую кишку (J) или дуоденум (D).
Лимфогенные метастазы
В отличие от предыдущих редакций, группировка производится не в 5, а в 4 подгруппы N0-N1-N2-N3, в зависимости от локализации первичной опухоли в желудке и расположения метастазов. В основе разделения лимфатических коллекторов по “этапам метастазирования” лежит совокупность данных анатомо-морфологических исследований по лимфодинамике желудка в норме и патологии и выживаемость в зависимости от их поражения. Разделение по топографическому принципу, лежащее в основе Японской классификации, наиболее достоверно отражает распространенность процесса и позволяет определить стадию и, следовательно, прогноз заболевания.
В классификации ЯАРЖ (1998) градация перигастральных лимфатических узлов строится, прежде всего, на прогностическом значении поражения того или иного лимфоколлектора в зависимости от локализации первичной опухоли. Большинство перигастральных лимфоколлекторов классифицируются как N1. Исключение составляют лишь супра- (№ 5) и субпилорические (№ 6) лимфоколлекторы для рака проксимального отдела желудка; левые паракардиальные (№ 2) лимфоколлекторы для рака тела желудка; правые (№ 1) и левые (№ 2) паракардиальные, по ходу коротких артерий (№ 4sa) и левой желудочно-сальниковой артерии (№ 4sb) лимфоколлекторы для рака антрального отдела желудка. Причем при локализации опухоли в антральном отделе желудка и поражении левых паракардиальных либо лимфоузлов по ходу коротких артерий 5-летняя выживаемость составляет 0%, а эти метастазы классифицируются как М1 (Lym), что достаточно очевидно свидетельствует о прогнозе.
В этой классификации достаточно большую роль играют т.н. “прыгающие” метастазы, т.е. поражение более отдаленных лимфоколлекторов при отсутствии метастазов в более проксимальных лимфоузлах. Даже один “прыгающий” метастаз может кардинальным образом изменить стадию заболевания и прогноз. Прыгающие метастазы также играют важную роль в таком понятии как феномен миграции стадии или феномен Will Rogers’a.
Удобной с точки зрения практического применения является корреляция классификации регионарных лимфатических коллекторов с объемом лимфодиссекции. Причем с учетом прогностической значимости различных лимфоколлекторов, стандартный объем вмешательства должен включать все лимфатические узлы второго этапа метастазирования, т.е. лимфодиссекцию D2. Расширение границ лимфодиссекции может быть обусловлено либо принципиальными положениями (например, в случае диффузно-инфильтративных опухолей типа Borrmann IV), либо наличием метастатически измененных узлов на следующих этапах метастазирования, что определяет прогноз течения заболевания. На сегодняшний день расширение объема лимфодиссекции до D3 следует рассматривать как исследовательский.
Классификация отдаленных метастазов
Наиболее частыми зонами отдаленного метастазирования при раке желудка являются печень и брюшина. Именно этот фактор позволил выделить эти зоны метастазирования в отдельные группы с собственным индексным обозначением. Так, наличие метастазов в печень обозначается как Н1-Н3 (в зависимости от количества и локализации метастазов), отсевы по брюшине классифицируются как Р1-Р3, что позволяет неоднозначно трактовать характер поражения, а, следовательно, планировать возможность комбинированного лечения.
Группировка по стадиям
В настоящей редакции не проводится разделения IV стадии на подгруппы, а все пациенты при наличии метастатического поражения лимфоузлов третьего этапа метастазирования, а также отдаленных метастазов (включая наличие клеток в смывах с брюшины — Cy+) регистрируются в данную группу.
Отнесение пациентов с опухолевыми клетками в смывах с брюшины в группу диссеминированных, с учетом данных нескольких независимых исследований, является новым и определяется, прежде всего, достаточно пессимистическим прогнозом.
Группировка пациентов по стадиям заболевания (табл. 1, 2).
Таблица 1
TNM стадирование рака желудка
| Классификация | Определение |
| Первичная опухоль | |
| Tx | Первичная опухоль не может быть оценена |
| T0 | Нет данных о первичной опухоли |
| Tis | Рак в пределах слизистой |
| T1 | Опухоль врастает в собственную пластинку слизистой или подслизистый слой |
| T2 | Опухоль врастает в собственно мышечный или субсерозный слои |
| T3 | Опухоль прорастает серозную оболочку (брюшину) |
| T4 | Опухоль врастает в окружающие структуры |
| Регионарные лимфогенные метастазы | |
| Nx | Регионарные лимфогенные метастазы не могут быть оценены |
| N0 | Нет регионарных лимфогенных метастазов |
| N1 | Лимфогенные метастазы в 1-6 регионарных лимфоузлах |
| N2 | Лимфогенные метастазы в 7-15 регионарных лимфоузлах |
| N3 | Лимфогенные метастазы более чем в 15 регионарных лимфоузлах |
| Отдаленные метастазы (M) | |
| Mx | Отдаленные метастазы не могут быть оценены |
| M0 | Нет отдаленных метастазов |
| M1 | Есть отдаленные метастазы |
Таблица 2
Распределение по стадиям
| Стадия | Критерий T | Критерий N | Критерий M |
| Tis | N0 | M0 | |
| IA | T1 | N0 | M0 |
| IB | T1 T2 |
N1 N0 |
M0 M0 |
| II | T1 T2 T3 |
N2 N1 N0 |
M0 M0 M0 |
| IIIA | T2 T3 T4 |
N2 N1 N0 |
M0 M0 M0 |
| IIIB | T3 T4 |
N2 N1 |
M0 M0 |
| IV | T1 T2 T3 T4
Любая T |
N3 N3 N3 N1-3
Любая N |
M0 M0 M0 M0 M1 |
Радикальность хирургических вмешательств
В прошлом радикальность лечения определялась совокупностью данных хирургического вмешательства (“визуально” полное удаление первичной опухоли и зон регионарного лимфогенного метастазирования) в сочетании с данными морфологического исследования препарата (отсутствие клеток по линиям резекции). Однако в последнем издании классификации характер выполненного вмешательства определяется как самой первичной опухолью, так и распространенностью лимфогенного метастазирования. Поэтому в классификации произведено разделение характера выполненного вмешательства на:
— радикальные операции (тип А) — отсутствие резидуальной опухоли с высокой вероятностью полного излечения;
— условно-радикальные операции (тип В) — отсутствие резидуальной опухоли, но при вероятности наличия субклинических опухолевых очагов;
— паллиативные операции (тип С) — наличие резидуальной опухоли.
Последний тип операций (тип С) подразделяется на:
— R0 — отсутствие макро- и микроскопической резидуальной опухоли;
— R1 — наличие микроскопической резидуальной опухоли (как правило, по линиям резекции, либо при удалении препарата с наличием периорганного или перинодального опухолевого роста);
— R2 — наличие макроскопической резидуальной опухоли (остаточные опухолевые узлы либо инфильтраты, описанные в протоколе операции).
Характеристики хирургических вмешательств с учетом особенностей первичной опухоли, распространенности лимфогенного метастазирования в сочетании с объемом лимфодиссекции приведены в таблице 3.
Таблица 3
Определение радикальности вмешательства при раке желудка
| Тип | pT | N/D | H | P | M | Линии резекции PM/DM |
| Тип A | T1-T2 | N0/D1-D3 N1/D2-D3 |
H0 | P0 | M0 | — |
| Тип B | T3/T4 | N2/D2-D3 | Отсутствие резидуальной опухоли | — | ||
| Тип C | Наличие резидуальной опухоли | |||||
Отмечается достаточно хорошая корреляция характера выполненного вмешательства и выживаемости (Maruyama K., Sasako M. et al., 1996).
Резюмируя, можно констатировать, что единственно радикальным в лечении рака желудка остается хирургический метод, и от радикализма операции зависит последующий прогноз течения заболевания. В то же время именно адекватное удаление желудка с зонами регионарного лимфогенного метастазирования позволяет выполнять достоверное стадирование распространенности опухоли на момент лечения. Совокупность этих взаимосвязанных факторов позволяет понять, что именно классификация является тем инструментом, который не только механистически определяет стадию заболевания, но позволяет выбрать наиболее обоснованную тактику лечения и прогнозировать последующее течение заболевания. Всем этим характеристикам сегодня отвечает классификация Японской ассоциации по раку желудка (1998), т.к. она является продуктом эволюции взглядов онкологов на проблему лечения рака желудка в сочетании с расширением арсенала методов лечения.
Лечение рака желудка
Основными в лечении рака желудка являются 3 метода, применяемые как в самостоятельном варианте, так и в комбинации:
- Хирургический метод.
- Лучевой метод.
- Химиотерапия.
Выбор наиболее оптимального из них определяется совокупностью распространенности процесса, функциональным состоянием пациента, а также принципиальными положениями той или иной клиники.
Если в процессе обследования выявляется локализованный характер заболевания, то такой пациент является кандидатом на радикальное хирургическое лечение. Однако даже локализованный характер патологии при наличии признаков местного распространения процесса в виде вовлечения окружающих структур, либо широкого лимфогенного метастазирования может служить показанием к проведению комбинированного лечения в различных вариантах:
- Лечение с неоадъювантной химиотерапией.
- Лечение с адъювантной химиотерапией.
- Лечение с периоперационной химиотерапией*.
- Лечение с адъювантной химио- и/или лучевой терапией.
- Хирургическое лечение с проведением гипертермической интраоперационной интраперитонеальной химиотерапии (ГИИХ)** или ранней послеоперационной интраперитонеальной химиотерапии.
- Комбинированное химиолучевое лечение в самостоятельном варианте.
* Послеоперационная химиотерапия проводится у пациентов с выраженным эффектом при проведении предоперационной полихимиотерапии и доказанным патоморфозом в опухоли при морфологическом исследовании удаленного препарата.
** ГИИХ является вариантом комбинированного лечения, когда химиотерапия проводится интраоперационно на фоне гипертермии. Может дополняться проведением ранней послеоперационной интраперитонеальной химиотерапии.
У пациентов с диссеминированными формами рака желудка тактика лечения также зависит от характера и распространенности заболевания. На сегодняшний день большинство онкологов проповедуют консервативную тактику у этой категории пациентов, а хирургический метод используется лишь как средство экстренной помощи при развитии осложнений — перфорации опухоли с развитием разлитого перитонита, полной дисфагии, декомпенсированном стенозе выходного отдела желудка и профузном желудочном кровотечении. Однако накопление позитивного опыта лечения диссеминированных форм свидетельствуют, что активная тактика с проведением хирургического компонента комбинированного лечения может улучшить результаты лечения. Наиболее удовлетворительные результаты при комбинированном лечении диссеминированных форм могут быть получены у пациентов:
— при выполнении расширенных D3 вмешательств у пациентов с метастазами в забрюшинные парааортальные лимфоузлы.
— при наличии солитарных или единичных метастазов в одну долю печени, при выполнении комбинированных резекций.
— при метастазах в яичники (Крукенберга) с выполнением комбинированной надвлагалищной ампутации матки с придатками.
Более подробно описание современных методов лечения рака желудка будет дано в соответствующих разделах главы.
Хирургическая тактика
Хирургический метод остается золотым стандартом в радикальном лечении злокачественных опухолей ЖКТ, позволяющим надеяться на полное выздоровление.
Традиционно, радикальные операции по поводу рака включали обязательное моноблочное удаление регионарных лимфатических узлов. Впервые атлас по хирургической анатомии лимфатической системы желудка и прилежащих органов был опубликован японским исследователем Inoue Y. (1936). Позднее расширенная лимфаденэктомия, как стандартный элемент радикального хирургического лечения рака желудка, широко проповедовалась ведущими хирургами-онкологами из Memorial Sloan Kettering Cancer Center (New York) — McNeer G., Pack T., Sunderland D. (1951). Авторы отработали технические аспекты выполнения расширенных вмешательств при раке желудка со стандартным удалением забрюшинных лимфатических узлов чревного ствола и его ветвей.
Понятие превентивной расширенной лимфодиссекции было впервые введено при хирургическом лечении рака желудка для обозначения операций, сопровождавшихся плановым удалением пораженного органа и зон регионарного метастазирования. На сегодняшний день в литературе широко применяются 2 термина, отражающие характер выполняемых вмешательств. Следует отметить, что термин “лимфодиссекция”, являясь более емким, нежели термин “лимфаденэктомия”, включает моноблочное удаление не только лимфатических узлов, но и всего лимфатического аппарата (лимфатических сосудов и окружающей жировой клетчаткой) в пределах фасциальных футляров.
Концепция превентивного моноблочного удаления зон регионарного метастазирования вместе с первичным очагом при раке желудка связана с именем японского хирурга Jinnai (1962), который на основании своих результатов рассматривал такой объем вмешательства как радикальный. С этого момента расширенная радикальная лимфодиссекция как обязательный интегрированный этап операции стала общепризнанной доктриной хирургического лечения рака желудка в Японии.
В настоящее время, на основании работ ЯАРЖ детально описаны 16 групп регионарных лимфатических узлов, формирующих 3 последовательные (не в истинном понимании последовательности) этапа метастазирования от различных отделов желудка — N1 до N3:
- Первый этап: перигастральные лимфоколлекторы, расположенные в связочном аппарате желудка (№ 1–6).
- Второй этап: забрюшинные лимфатические узлы, расположенные по ходу ветвей чревного ствола (лимфатические узлы по ходу левой желудочной артерии (№ 7), общей печеночной артерии (№ 8a+p), чревного ствола (№ 9), в воротах селезенки (№ 10), по ходу селезеночной артерии (№ 11p+d)).
- Третий этап: лимфатические узлы гепатодуоденальной связки (№ 12a+p+b), ретропанкреатодуоденальные (№ 13), лимфатические узлы по ходу верхней брыжеечной артерии (№ 14a+v), в корне брыжейки поперечно-ободочной кишки по ходу средней ободочной артерии (№ 15), парааортальные лимфоузлы, расположенные на различном уровне брюшной аорты (№ 16a1-a2, b1-b2), а также хиатальные и заднемедиастинальные лимфоколлекторы для рака проксимального отдела желудка с переходом на пищевод.
Для различных локализаций первичной опухоли в желудке лимфатические узлы, даже в пределах одной группы, могут относиться к различным этапам метастазирования, что определяется эмпирически, на основании исследования отдаленных результатов хирургического лечения (Maruyama K. et al., 1993; 1999).
На основании классификации и с учетом исследований по результатам выживаемости (Sasako M. et al., 1995; Aiko T. et al., 1998) вовлечение лимфатических коллекторов N1-N2 рассматривается как регионарное метастазирование, тогда как вовлечение лимфоузлов N3 — как распространенность, соответствующая IV стадии заболевания.
Различные варианты лимфодиссекции нашли свое отражение в классификации объема вмешательства, на основании последнего удаляемого этапа метастазирования (табл. 4).
Таблица 4
Тип хирургического вмешательства
| Тип вмешательства | Объем лимфодиссекции | ||
| N1 | N2 | N3 | |
| Стандартная гастрэктомия (СГ) D1 | + | — | — |
| Стандартная радикальная гастрэктомия (СРГ) D2 (см. рис. 6–14 на цветной вклейке) | + | + | — |
| Расширенная радикальная гастрэктомия (РРГ) D3 (см. рис. 15–17 на цветной вклейке) | + | + | + |

Рисунок 6. Выделена правая желудочная артерия (на лигатуре)
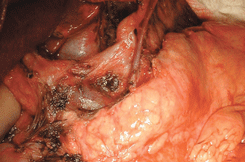
Рисунок 7. Лимфодиссекция зоны чревного ствола (выделены левая желудочная вена и левая желудочная артерия на протяжении)
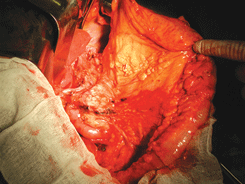
Рисунок 8.Бурсосегментэктомия
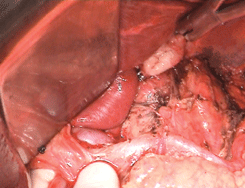
Рисунок 9. Лимфодиссекция печеночно-двенадцатиперстной связки (видны воротная вена и общая печеночная артерия)

Рисунок 10. Окончательный вид послеоперационной раны после лимфодиссекции D2

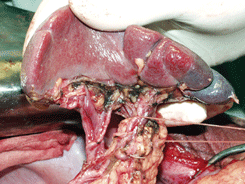
Рисунок 11. Мобилизация панкреато-лиенального комплекса с лимфодиссекцией ворот селезенки

Рисунок 12. Окончательный вид панкреатолиенального комплекса после лимфодиссекции по ходу селезеночных артерии и вены в воротах селезенки
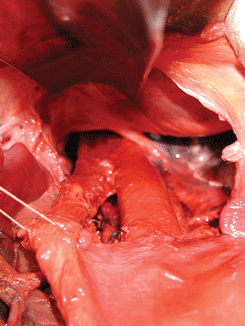
Рисунок 13. Трансхиатальная мобилизация пищевода с лимфодиссекцией заднего средостения
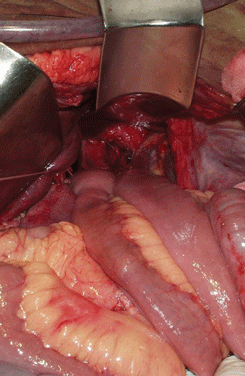
Рисунок 14. Окончательный вид раны после трансхиатальной резекции пищевода и формирования медиастинального пищеводно-кишечного анастомоза

Рисунок 15. Аорто-кавальная лимфодиссекция с визуализацией поясничной вены

Рисунок 16. Окончательный вид раны после забрюшинной парааортальной лимфодиссекции D3 (на лигатуре — левая почечная вена, на турникете — нижняя брыжеечная артерия)
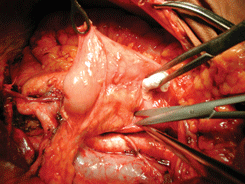
Рисунок. 17. Мобилизация двенадцатиперстной кишки по Кохеру
Следует отметить, что на сегодняшний день данная классификация степени радикальности выполняемой лимфодиссекции применима лишь для японских и нескольких специализированных европейских и американских клиник, т.к. в большинстве публикаций лимфодиссекция D2 уже рассматривается как расширенная.
Впервые сравнительный анализ результатов расширения объема лимфодиссекции на ретроспективном материале был выполнен Mine M., Majima S. et al. (1970): авторы исследования отметили улучшение отдаленных результатов при выполнении расширенной лимфодиссекции, особенно при выявлении лимфогенных метастазов — 21% после лимфодиссекции D2-D3 против 10% после ограниченной диссекции D0-D1.
К началу 90-х гг. XX в. отработка методологических приемов выполнения расширенной лимфодиссекции позволила значительно улучшить отдаленные результаты лечения. Несмотря на расширение объема вмешательства и увеличение резектабельности до 95%, отмечено стабильное снижение послеоперационной летальности до 0,4% (Maruyama K., 1993).
На ежегодном конгрессе ЯАРЖ в 1992 г. были проанализированы отдаленные результаты лечения более 61 тыс. больных раком желудка, получавших хирургическое лечение в 98 институтах страны.
Анализ результатов продемонстрировал, что:
— при I стадии без метастазов в лимфатические узлы наиболее хорошие результаты отмечены в группе стандартных D2 и расширенных D3 радикальных гастрэктомий (соответственно по 92,4%), однако также возможно выполнение радикальной резекции (88,1%). При выполнении стандартной гастрэктомии D1 отмечена наиболее низкая 5-летняя выживаемость — 74,0%;
— при II стадии достоверно лучшие результаты 5-летней выживаемости отмечены при выполнении стандартной и расширенной радикальной лимфодиссекции (соответственно 76,8% и 75,9%), чем при выполнении стандартной гастрэктомии (52,5% и 66,1% соответственно);
— при III стадии более чем двукратное достоверное улучшение 5-летней выживаемости отмечено после стандартных и расширенных радикальных операций (45,7% и 47,7% соответственно), чем после стандартных вмешательств (24,6%);
— при III стадии наиболее хорошие отдаленные результаты отмечены после выполнения расширенных радикальных гастрэктомий D3 (РРГ).
С учетом накопленного опыта ведущих клиник, занимающихся проблемой хирургического лечения рака желудка, в Японии объем лимфодиссекции D2 считается стандартным.
Схожие результаты были получены немецкой группой по изучению рака желудка (German Gastric Cancer Study Group) в проспективном исследовании, включавшем более полутора тысяч пациентов (Siewert J.R. et al., 1993). Критерием выполнения радикальной расширенной операции, по мнению авторов, является удаление более чем 25 лимфатических узлов. Был сделан вывод об эффективности расширенной лимфодиссекции у пациентов II и IIIA стадий. Однако при массивном прорастании серозной оболочки и метастазах в лимфоколлекторы N2 расширенная лимфодиссекция не улучшает отдаленных результатов лечения.
В литературе не опубликованы данные проспективных рандомизированных исследований по отдаленным результатам стандартной и расширенной лимфодиссекции из Японии, т.к., по мнению большинства японских авторов, уменьшение объема лимфодиссекции a priori переводит вмешательство в разряд паллиативного, что неэтично по отношению к пациентам.
На Консенсусной конференции, посвященной проблеме расширенной лимфодиссекции при хирургическом лечении рака желудка (IV Международный конгресс по раку желудка — New York, USA, 2001), большинство участников отмечало улучшение результатов за счет снижения частоты локорегионарного рецидива заболевания и увеличения 5-летней выживаемости. Было отмечено, что при отработке методики непосредственные результаты сопоставимы с результатами стандартных вмешательств, а отдаленные приближаются к данным ЯАРЖ. С учетом накопленного опыта лимфодиссекция D2 является достаточно безопасной процедурой и должна стать обязательным элементом хирургического лечения рака желудка.
Основные принципы выбора метода резекции
Основной целью радикального вмешательства при раке желудка является полное удаление опухоли с учетом возможных местных (интрамуральных) и лимфогенных путей распространения опухолевых клеток. Поэтому при выборе объема планируемого вмешательства необходимо ответить на основные вопросы, определяющие тактику лечения конкретного пациента:
- Является ли хирургическое лечение у данного пациента радикальным.
- Сопоставима ли операционная травма с индивидуальными функциональными возможностями данного пациента.
- Возможна ли послеоперационная реабилитация с удовлетворительным сохранением функции (прием пищи естественным путем, кратность и количество пищи, динамика массы тела).
- Каковы должны быть:
— хирургический доступ с учетом его травматичности, возможности полноценного выполнения резекционного и реконструктивного этапов;
— объем резекции с учетом распространенности процесса по органу и объема удаляемых тканей;
— метод реконструкции для восстановления энтерального питания, а также возможность выполнения повторной операции в случае местного рецидива.
Выбор объема удаления желудка при раке различной локализации
С учетом исследований, проведенных в рамках программы JGCA по путям интрамурального и лимфогенного распространения рака желудка было показано, что при экзофитных локализованных формах роста опухоли желудка (Borrmann-I, II) с целью достижения достоверной радикальности необходимо отступать от края опухоли минимум на 3 см в проксимальном направлении. В то же время при инфильтративных формах роста опухоли (Borrmann-III, IV) необходимо отступать от определяемой границы минимум на 5 см в проксимальном направлении.
Однако даже при возможности рентгенологической, визуальной и пальпаторной оценки проксимальной границы опухоли уровень резекции не должен определяться механистически, исходя из возможности достижения “адекватной” границы, т.к. радикальность вмешательства определяется не только уровнем резекции органа, но и объемом удаления лимфогенных путей метастазирования.
Итак, выбор объема хирургического вмешательства зависит от нескольких взаимосвязанных факторов:
— характера и формы роста первичной опухоли, включая подслизистую инфильтрацию;
— перехода на дистальную треть тела желудка;
— распространенности лимфогенного метастазирования.
Недооценка какого-либо из факторов приведет к выбору неадекватного объема оперативного вмешательства.
На сегодняшний день в большинстве лечебных учреждений при раке дистальной трети желудка наиболее часто выполняется дистальная субтотальная резекция желудка*.
* Необходимо отметить, что в онкохирургии радикальной субтотальной резекцией желудка может считаться лишь удаление 4/5 желудочной стенки с удалением всей малой кривизны до уровня пищеводно-желудочного перехода.
Несмотря на то, что такой объем оперативного вмешательства является более функциональным, нежели гастрэктомия, он имеет строгие показания и не должен применяться в ущерб онкологической радикальности.
Показаниями к выполнению дистальной субтотальной резекции желудка являются:
- Экзофитные формы роста опухоли, без рентгенологических и эндоскопических признаков инфильтративного роста.
- Отсутствие перехода на угол желудка (нижняя треть тела).
- Отсутствие массивного выхода процесса на серозную оболочку желудка.
- Отсутствие мультицентрических очагов опухолевого роста в желудке.
- Отсутствие интраоперационно выявляемых метастатических лимфатических узлов в паракардиальной области, забрюшинном пространстве, особенно по ходу селезеночной артерии, в области чревного ствола, а также в воротах селезенки.
Во всех остальных случаях, с точки зрения онкологической адекватности, необходимо выполнять гастрэктомию с лимфодиссекцией D2.
В ГУ РОНЦ им. Н.Н. Блохина РАМН показанием к выполнению дистальной субтотальной резекции желудка является локальный неинфильтративный тип опухоли (Borrmann-I, II), расположенной в антральном отделе желудка, без перехода на угол желудка (который рассматривается как нижняя треть тела). Во всех случаях инфильтративных опухолей, а также при локализованных экзофитных опухолях с переходом на тело желудка обязательным является выполнение гастрэктомии de principle. Это положение определяет частоту выполнения гастрэктомий при хирургическом лечении рака желудка. Действительно, если учесть, что опухоли тела и проксимального отдела желудка составляют несколько менее 60%, а среди опухолей дистальной трети более половины являются эндофитными и около 10% переходят на угол желудка, то становится понятным, что при лечении рака желудка гастрэктомия должна составлять более 80%.
Другим, не менее важным фактором, нежели интрамуральная распространенность опухолевого процесса, является вовлечение регионарных лимфоколлекторов. Наличие определяемых во время операции метастатических узлов в связочном аппарате желудка, особенно в паракардиальной области справа и слева, в бассейне по ходу селезеночной артерии (№11), а также в воротах селезенки (№10), при опухолях антрального отдела (даже небольших экзофитных без инфильтративного роста), должно склонять чашу весов в пользу выполнения гастрэктомии.
Она должна сочетаться в этих случаях с обязательной спленэктомией и по показаниям с резекцией поджелудочной железы, вплоть до субтотальной резекции.
Аналогичный подход к выполнению более функциональных резекций необходимо использовать и при раке проксимального отдела желудка. Следует помнить, что опухоли этой локализации чаще, чем рак тела и антрального отдела желудка, характеризуются экзофитной формой роста. Но этот фактор не следует рассматривать как определяющий при выборе объема резекции. Более важными с прогностической точки зрения являются:
- Наибольший размер опухоли.
- Выход процесса на серозную оболочку.
- Наличие лимфогенных метастазов.
Исследования рака проксимального отдела желудка, проведенные в Национальном институте рака (Токио) показали, что проксимальная субтотальная резекция желудка может быть выполнена лишь у пациентов при размерах опухоли до 4 см в наибольшем измерении, локализующихся в проксимальном отделе без распространения на верхнюю треть тела желудка.
Причем обязательной является резекция неизмененной визуально и пальпаторно стенки желудка на 2 см дистальнее определяемой границы опухоли при поверхностностелящемся характере роста, на 3 см при экзофитном и на 5 и более см при эндофитном и смешанном типах роста. Эти границы являются допустимыми при выполнении радикальной операции.
Крайне важным прогностическим фактором является выход процесса на серозную оболочку желудка. Исследования, проведенные японскими авторами, а также опыт работы ГУ РОНЦ им. Н.Н. Блохина РАМН (Германов А.Б., 1998) позволяют с высокой степенью достоверности отметить, что при выходе процесса на серозную оболочку желудка необходимым минимальным объемом операции является комбинированная гастрэктомия со спленэктомией с обязательным выполнением лимфодиссекции D2.
Другим фактором, определяющим противопоказание к выполнению проксимальной субтотальной резекции желудка являются метастазы в лимфатические узлы, расположенные вдоль правой половины большой кривизны желудка, а также супра- и субпилорические. Эти группы лимфоколлекторов следует рассматривать как второй этап лимфогенного метастазирования и, следовательно, подлежащие удалению. Поэтому пальпаторное обнаружение увеличенных лимфатических узлов этих групп при интраоперационной ревизии требует выполнения расширенной гастрэктомии с моноблочным удалением всего связочного аппарата желудка.
В случаях распространенного опухолевого процесса, при выполнении заведомо паллиативного вмешательства с функциональных позиций оправданным следует считать выполнение проксимальной резекции желудка как более щадящей.
Методы реконструкции после гастрэктомии
Наряду с отработкой вариантов расширенных вмешательств, актуальной является разработка физиологических методов восстановления непрерывности кишечной трубки.
Основными положениями, которым необходимо следовать, являются возможность наиболее физиологического восстановления кишечного тракта, либо минимизация такого фактора, как рефлюкс-эзофагит.
В настоящее время после длительного этапа отработки в клинической практике широко используются 3 основные методики реконструкции после гастрэктомии:
- Петлевая пластика, зачастую сочетающаяся с формированием кишечного резервуара (типа Hunt-Lawrence-Rodino).
- Формирование эзофаго-энтероанастомоза на отключенной петле по методу Ру (Roux-en-Y reconstruction).
- Включение в пищеварительный тракт сегментов тонкой или толстой кишки (интерпозиция) на сосудистой ножке, с восстановлением естественного пассажа пищи по двенадцатиперстной кишке либо с созданием тонкокишечного резервуара.
Выбор метода пластической реконструкции зависит в первую очередь от радикальности выполненного вмешательства, а также от индивидуальных особенностей строения брыжейки у каждого пациента и, зачастую, от личных пристрастий хирурга.
- При соблюдении всех признаков радикальности возможно выполнение реконструкции с интерпозицией сегментов кишки на ножке с включением двенадцатиперстной кишки либо формирование тонкокишечных резервуаров.
- При выполнении условно-радикальной операции с учетом распространенности заболевания возможно выполнение реконструкции по Ру либо выполнение петлевой пластики.
- При выполнении паллиативного вмешательства единственно оправданным с точки зрения безопасности и прогнозируемого периода жизни является выполнение петлевой впередиободочной пластики.
Заключение
Таким образом, на основании опыта хирургического лечения рака желудка и анализа непосредственных и отдаленных результатов можно констатировать, что:
— рак желудка характеризуется ранним лимфогенным метастазированием в регионарные лимфатические узлы уже при прорастании опухоли в подслизистый слой, появлением “прыгающих” метастазов в лимфатические коллекторы 2 и 3 этапов метастазирования;
— достоверное стадирование распространенности процесса возможно лишь при выполнении лимфодиссекции D2 (минимально допустимый объем диссекции) с обязательным исследованием удаленного препарата на основании схемы этапности лимфогенного метастазирования различных отделов желудка;
— отработка технических элементов расширенных операций, а также оптимизация ведения послеоперационного периода позволяют значительно снизить послеоперационные осложнения и летальность в группе расширенных операций;
— увеличение объема хирургического вмешательства за счет расширения границ выполняемой диссекции позволяет улучшить отдаленные результаты, преимущественно за счет локализованных стадий заболевания.
Все вышеизложенные факты позволяют рассматривать операции в объеме D2 как стандартные вмешательства в хирургическом лечении рака желудка.
Рак проксимального отдела желудка
Несмотря на стойкое снижение заболеваемости раком желудка в целом в последние годы большинство канцер-регистров отмечают рост частоты аденокарциномы зоны пищеводно-желудочного перехода.
В США частота аденокарциномы проксимального отдела желудка и зоны пищеводно-желудочного перехода увеличивается так интенсивно, как ни одна другая форма опухоли: если в 1960 г. больные раком проксимального отдела желудка составляли лишь 16%, то к началу 80-х — уже 44%, а к концу 90-х — более 60% от всех заболевших раком желудка (Blot W.J. et al., 1991; 1999). Такая же тенденция отмечена в Великобритании, Германии, Нидерландах, на Тайване. По итогам большого проспективного исследования, проведенного немецкими медиками, больные раком проксимального отдела желудка в целом и раком кардии в частности составили 21,5 и 13,9% среди мужчин и соответственно 19,8 и 8,9% среди женщин.
Однако удельный вес аденокарциномы зоны пищеводно-желудочного перехода также увеличивается за счет рака проксимального отдела желудка с вовлечением дистальных отделов пищевода. Несмотря на близость локализации, а также единое морфологическое строение, эти опухоли, зачастую классифицируемые в одной группе, имеют принципиальные особенности. С точки зрения эпидемиологии, аденокарцинома пищевода с распространением на желудок и аденокарцинома проксимального отдела желудка с переходом на пищевод характеризуются достаточно явными различиями.
Общепризнанные факторы риска развития рака проксимального отдела желудка не отличаются от факторов риска развития рака желудка в целом (см. выше).
Предраковые изменения (ХАГ, дисплазии) при аденокарциномах кардии встречаются достаточно редко, если не сказать, что они практически отсутствуют. Это отличает опухоли данной локализации от рака антрального отдела желудка.
По мнению большинства исследователей, аденомы, локализующиеся в зоне кардии, никогда не малигнизируются, поэтому их также не следует рассматривать как предраковые состояния.
Рак проксимального отдела желудка с переходом на пищевод характеризуется своеобразием течения, отличным от рака дистального отдела и тела желудка, и от рака дистальной части пищевода с переходом на желудок и требует иной тактики хирургического лечения.
К раку проксимального отдела желудка относят опухоли с исходной локализацией в верхней трети желудка ( в том числе субкардии и кардии), с возможным переходом инфильтрации на розетку кардии и пищевод. При этом уровень проксимальной границы опухоли в пищеводе не имеет решающего значения.
Макроскопически кардиальный отдел желудка — это зона слизистой, не имеющая складчатости. Микроскопически кардия несет характерные разветвленные и тубулярные железы, выделяющие нейтральный секрет и окрашивающиеся специфическим красителем Alcain Blue при кислой реакции (рН 2,5–3) в синий цвет.
Такое определение кардии достаточно ограниченно. Однако зачастую многие морфологи рассматривают эту зону лишь с позиций наличия переходной “пищеводно-желудочной зоны” и включают в нее дистальный отдел пищевода, зону пищеводно-желудочного перехода и зону кардии.
Рак кардиального отдела желудка — это обычно большая опухоли, занимающая весь проксимальный отдел. Она характеризуется различными формами роста от экзофитного до язвенно- или диффузно-инфильтративного. Часто инфильтрация распространяется на дистальные отделы пищевода.
Микроскопически строение опухоли также может быть полиморфным — от высокодифференцированного рака с наличием слизеобразования, что встречается достаточно часто, до низкодифференцированных и недифференцированных форм. Преобладают опухоли, прорастающие собственно мышечную оболочку стенки желудка с вовлечением серозной оболочки. С высокой частотой определяются метастатически измененные лимфатические узлы. Ранний рак проксимального отдела желудка диагностируется достаточно редко. Поэтому частота выявления лимфогенных метастазов высокая — от 20–30% при прорастании подслизистого и мышечного слоев до 60–90% при выходе процесса на серозную оболочку и прорастании в окружающие структуры.
Эндоскопически со стороны слизистой кардиальному отверстию соответствует Z-образная линия, являющаяся границей между многослойным плоским эпителием пищевода и однослойным многорядным железистым эпителием желудка. Зона Z-образной линии достаточно вариабельна и может определяться до 2 см — как выше, так и ниже пищеводно-желудочного перехода. Характерные морфологические признаки слизистой оболочки кардии прослеживаются ниже Z-образной линии.
В связи с частым вовлечением в процесс пищевода, в литературе такие опухоли наиболее часто характеризуют как “кардиоэзофагеальный рак” (КЭР). Согласно нозологической классификации ВОЗ, кардиоэзофагеальный рак выделен в самостоятельное заболевание и под ним понимают злокачественное поражение желудка и пищевода в пределах 5 см от зоны кардиоэзофагеального перехода — как в проксимальном, так и в дистальном направлениях.
Несмотря на то, что в международной классификации злокачественных опухолей по системе TNM отсутствует такое понятие, как КЭР, среди клиницистов этот термин имеет широкое распространение и у нас в стране, и за рубежом.
Можно отметить, что выделение рака желудка с распространением на пищевод в отдельную группу оправдано с нескольких позиций. Именно с момента распространения на пищевод рак проксимального отдела желудка приобретает биологические и онкологические черты рака пищевода:
— повышается тенденция к широкому лимфогенному метастазированию;
— возможно появление “прыгающих” метастазов не только в забрюшинные, парааортальные, но также и в медиастинальные и шейно-надключичные лимфоузлы (которые, согласно номенклатуре TNM для рака желудка, следует рассматривать как отдаленные — М1 (lym);
— появляется вероятность высокого поражения пищевода и появления интрамуральных “пылевидных” метастазов в пищеводе.
Наиболее удачным примером попытки создать универсальную классификацию для аденокарциномы зоны пищеводно-желудочного перехода является классификация, предложенная Siewert J.R. et al. (1987). В основу этой классификации положены два принципа, объединенные вместе: гистологическая структура опухоли — аденокарцинома + ее локализация (зона пищеводно-желудочного перехода). Авторы выделяют 3 типа опухоли с учетом локализации эпицентра новообразования (рис. 18):
I тип — аденокарцинома дистального отдела пищевода, эпицентр которой расположен от 1 до 5 см выше зоны пищеводно-желудочного перехода (Z-линии). Этот тип опухоли наиболее часто возникает на фоне цилиндроклеточной метаплазии в дистальном отделе пищевода (пищевод Барретта) и зачастую инфильтрирует зону пищеводно-желудочного перехода сверху вниз.
II тип — истинная аденокарцинома зоны пищеводно-желудочного перехода (истинный рак кардии), чей эпицентр расположен в пределах 1 см выше или 2 см ниже Z-линии.
III тип — аденокарцинома с локализацией основного массива опухоли в субкардиальном отделе желудка, от 2 до 5 см ниже Z-линии.
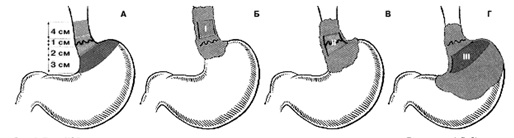
Рисунок 18. Типы рака пищеводно-желудочного перехода по классификации J.R. Siewert (1987):
А — Анатомические ориентиры зоны пищеводно-желудочного перехода; Б — тип I; В — тип II; Г — тип III
Эпидемиологические исследования Kodera et al. (1999) показывают неодинаковую частоту выявления различных типов опухолей в Восточном и Западном полушариях. Так I тип, превалируя у мужчин, практически не встречается в Восточных странах, тогда как на Западе отмечается крайне быстрый рост данной патологии.
Морфологические особенности: при I типе опухоли обычно выявляется умеренно дифференцированная аденокарцинома, тогда как при II и, особенно, III типах преобладают низко — и недифференцированные опухоли, обычно имеющие сóлидный тип роста.
Также отмечаются выраженные различия в лимфооттоке, обусловленные особенностями регионарных лимфатических бассейнов. Этот фактор является кардинальным, определяющим, согласно данной классификации, алгоритм хирургического лечения.
Так, при раке нижнегрудного отдела пищевода лимфоотток направлен в обе стороны, как в оральном направлении, в сторону лимфоколлекторов средостения и шейно-надключичной области, так и в каудальном -в сторону лимфоколлекторов брюшной полости и забрюшинного пространства. В то же время при раке кардии и субкардии основной лимфоотток направлен в сторону лимфатических узлов забрюшинного пространства и верхней парааортальной области.
Существенные различия частоты выявления микрометастазов в лимфатических узлах отмечаются уже при ранних формах опухоли. Так если при I типе опухоли частота выявления микрометастазов не превышает 7%, то при II и III типах опухоли этот показатель возрастает до 24%. Наиболее часто лимфогенное метастазирование наблюдается у больных кардио-эзофагеальным раком III типа (83%), реже — у больных раком I и II типов — 67 и 63% соответственно. Помимо широкого лимфогенного метастазирования в брюшной полости, рак проксимального отдела желудка характеризуется метастазированием в медиастинальные лимфатические узлы. Частота сочетанного метастатического поражения лимфатических узлов брюшной полости и средостения крайне высока (57–90%). Для кардио-эзофагеального рака с прорастанием желудочной стенки (pT3) характерно лимфогенное метастазирование в лимфатические узлы по ходу селезеночной артерии (№11) и в области чревного ствола (№9), а также в средостении, в области бифуркации (№107). Нередко наблюдаются метастазы в лимфатические узлы шейно-надключичной области.
Это обосновывает выполнение трехзональной цервико-абдомино-медиастинальной лимфодиссекции. Однако подобные операции не могут быть пока рекомендованы для широкого клинического применения нигде, кроме крупных специализированных центров.
Частота поражения медиастинальных лимфоузлов зависит от уровня поражения пищевода — чем он выше, тем чаще выявляются метастазы в медиастинальных лимфоузлах — опухоль приобретает характеристики рака пищевода.
В зависимости от типа опухоли предложена различная хирургическая тактика. Так, в случае аденокарциномы дистальной трети пищевода, возникающей наиболее часто на фоне пищевода Барретта, предлагается выполнять трансхиатальную субтотальную резекцию пищевода с заднемедиастинальной лимфодиссекцией и формированием анастомоза на шее. При опухолях II и III типов необходимым объемом вмешательства является чрезбрюшинная гастрэктомия D2 с трансхиатальной резекцией вовлеченных отделов пищевода и выполнением лимфодиссекции заднего средостения.
На сегодняшний день, учитывая достаточную простоту представленной классификации, а также ее рекомендательный характер, регламентирующий тактику хирургического лечения, на согласительной конференции Международной Ассоциации по Раку Желудка (IGCA) и Международного Общества по Заболеваниям Пищевода (ISED) в 2000 г. классификация J.R. Siewert рекомендована экспертной комиссией как базовая для применения при аденокарциноме зоны пищеводно-желудочного перехода.
В литературе опубликовано несколько классификаций рака кардии, принятых в Японии. Наиболее простой и удобной является классификация Nishi (1987), согласно которой истинный рак кардиального отдела желудка — это опухоль, по гистологическому строению соответствующая аденокарциноме, эпицентр которой локализуется в пределах 2 см. как в оральном, так и в аборальном направлениях от зоны пищеводно-желудочного перехода либо Z-образной линии. При такой локализации опухоли большинство японских авторов рассматривают как операцию выбора гастрэктомию, выполняемую из комбинированного абдомино-торакального доступа (типа Ohsawa-Garlock). Выполняется стандартный объем абдоминальной лимфодиссекции D2 с удалением медиастинальных лимфоколлекторов до уровня бифуркации трахеи.
Литература
Blot W.J. et al. ...JAMA.- 1991.- 265.- P. 1287–1289.
Blot W.J. et al. ...Semin. Oncol.- 1999.- 26.- P. 2–8.
Siewert J.R. et al. …Kardiakarzinom: Versuch einer therapeutisch relevanten Klassifikation. Chirurg 1987.- 58.- P. 25–34.
Заключение
На сегодняшний день рак желудка остается одной из наиболее актуальных проблем современной онкологии. Это обусловлено как частотой выявления заболевания, так и разнообразием клинических проявлений и вариантов течения. Несмотря на некоторые успехи в ранней диагностике, абсолютное большинство пациентов попадают на лечение уже в местнораспространенной или даже диссеминированной фазе заболевания.
Клиническая онкология располагает достаточно широким спектром методов лечения, которые могут использоваться как в самостоятельном варианте, так и в комбинации: хирургический метод, комбинация хирургического лечения с пред- или послеоперационной химио- или лучевой терапией, интраоперационная лучевая или интраперитонеальная химиотерапия, аддитивная иммунотерапия и др. Однако, несмотря на это, а также на некоторый прогресс самих этих методов, выживаемость больных далека от желаемой и за последнее столетие улучшилась лишь незначительно. Все это дает широкие перспективы применению новых методов лечения (таких как генетическая терапия, применение специфических вакцин, основанных на собственных антигенах опухолевых клеток и т.д.), а также их комбинаций. И если основным методом лечения, как и сто лет назад, остается хирургический, позволяющий на ранних стадиях заболевания излечить пациентов, то системное воздействие на опухоль требует дальнейшего совершенствования.
Литература
Германов А.Б. Расширенные и расширенно-комбинированные операции при раке проксимального отдела желудка: Дис. ... докт. мед. наук.- М., 1998.
Жданов Д.А. Хирургическая анатомия грудного протока и главных лимфатических коллекторов и узлов туловища.- Горький, 1945.
Aiko T. et al. ...Gastric Cancer.- 1998.- V. 1.- P. 25–31.
Blaser M.J. et al. ...Cancer Research.- 1995.- V. 55.- P. 2111–2115.
Borchard F. Precancerouse conditions and lesions of the stomach/Ed. by Rugge M. et al. Gastric cancer and precancerouse lesions.- Milan: Edizioni Unicopi, 1986.- P. 175–210.
Cahill R.J. et al. ...Digestive Disorders Science.- 1995.- V. 40.- P. 1627–1641.
Cho J.S. Recent progress of preoperative staging in gastric cancer: CT scans/III International gastric cancer congress, Seoul, Korea, 1999. Monduzzi Editore, 1999.- V. 1.- P. 105–108.
Crespi M. et al. ...Scand. J. Gastroent.- 1996.- V. 31.- P. 1041–1046.
Graham D.Y. et al. ...Hepatogastroenterology.- 1993.- V. 105.- P. 279–282.
Inoue Y. ...Jpn. j. anat.- 1936.- V. 9.- P. 35–117.
Japanese gastric cancer association. Japanese classification of gastric carcinoma.- 2-nd English edition.- Gastric cancer.- 1998.- V. 1.- P.10–25.
Jinnai D. et al. ...Geka Chiryo.- 1962.- V. 7.- P. 316–324.
Maruyama K. et al. Effectiveness of systemic lymph node dissection in Gastric cancer surgery: Gastric cancer.- Ed. by Nishi M. et al.- Springer-Verlag, Tokyo, 1993.- P. 293–306.
Maruyama K. et al. ...Semin. Oncol.- 1996.- P. 360–368.
Maruyama K. et al. ...Surgical Therapy.- 1996.- V. 75.- P. 277–282.
Maruyama K. et al. ...Lungenbeck’s arch. surg.- 1999.- V. 384.- P. 149–157.
McNeer G. et al. ...Ann. Surg.- 1951.- V. 134.- P. 2–7.
McNeer G. et al. ...Cancer.- 1951.- V. 4.- P. 957–967.
Mine M. et al. ...Surgery.- 1970.- V. 68.- P. 753–758.
Ming S.C. The classification and significance of gastric polyps/ Ed. By Yardley J.H. et all. The gastrointestinal tract.-Baltimor: Williamson and Wilkins, 1977.- P. 149–175.
Murata Y. et al. Recent progress in staging gastric cancer by endoscopic ultrasonography/III International gastric cancer congress, Seoul, Korea, 1999. Monduzzi Editore, 1999.- V. 1.- P. 109–114.
Natsugoe S. et al. ...Endoscopy.- 1996.- V. 28.- P. 750–754.
Parker A.E. ...Amer. J. Anat.- 1935.- V. 56.- P. 409–445б.
Rоuvieгe H. Anatomie des lymphatiques de l’homme.- Paris, 1932.
Sano T. et al. For the Gastric cancer surgical study group of the japan clinical oncology group (JCOG). Randomised controlled trial to evaluate para-aortic lymphadenectomy for gastric cancer (JCOG 9501)/IV International gastric cancer congress, Abstructs, S 45.- P. 663.
Sasako M. et al. ...Br. J. Surg.- 1995.- V. 82.- P. 346–351.
Sasako M. et al. Gastric Cancer.- Oxford University Press, Oxford, 1997.
Sawai K. et al. ...J. Surg. Oncology.- 1994.- V. 56.- P. 221–226.
Siewert J.R. et al. ...Br. J. Surg.- 1993.- V. 80.- P. 1015–1018.
Solcia E. et al. ...Am. J. Surg. Pathol.- 1996.- V. 20 (suppl. 1).- P. 8–22.
Uenosono Y. et al. Extracorporeal ultrasonography is useful to evaluate preoperative staging in gastric cancer/IV International gastric cancer congress, 2001, New York, USA.- Manduzzi Editore, 2001.- P. 807–810.
Описание проверено экспертом
Оцените статью:
- Рак желудка
- Стенозирующий рак желудка
- Диссеминированная аденокарцинома желудка
- Метастатический рак желудка
- Опухоли желудка
Рак желудка: онкология, которой чаще всего болеют в России
Рак желудка возникает при повреждении слизистой оболочки, что приводит к опухоли. Лечение зависит от стадии и может включать хирургию, химио- и лучевую терапию.
Опубликовано на сайте: 16.07.24 | Обновлено на сайте: 16.07.24
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
злокачественное новообразование желудка
Рак желудка или пищеводно-желудочного перехода,



