D50 Железодефицитная анемия, МКБ-10
- D50.0 Железодефицитная анемия вторичная вследствие потери крови (хроническая)
- D50.1 Сидеропеническая дисфагия
- D50.8 Другие железодефицитные анемии
- D50.9 Железодефицитная анемия неуточненная
Отредактировано: 25.04.2025
Железодефицитная анемия
Определение
Железодефицитная анемия (ЖДА) – это многофакторное заболевание, характеризующееся снижением содержания железа в сыворотке крови, костном мозге и тканевых депо, в результате чего нарушается образование гемоглобина и эритроцитов, развивается гипохромная анемия и трофические расстройства в тканях [1].
Степень тяжести анемии определяется по концентрации гемоглобина в периферической крови [1]:
- более 90 г/л – легкая;
- 90-70 г/л – средняя;
- менее 70 г/л – тяжелая.
Этиология и патогенез

У женщин детородного возраста железодефицитная анемия чаще всего формируется на фоне обильных менструаций, беременности, родов (особенно повторных) и периода грудного вскармливания [1].
У мужчин и женщин после наступления менопаузы основным этиологическим фактором становится хроническая кровопотеря из желудочно-кишечного тракта. Однако снижение запасов железа возможно и при отсутствии явных кровотечений – в фазу активного роста у детей, при соблюдении растительной диеты, после оперативных вмешательств на желудке или кишечнике, а также при нарушении абсорбции железа, характерном для пациентов с воспалительными заболеваниями кишечника. Также ЖДА может развиться у доноров, многократно сдающих кровь в течение продолжительного времени, и у пациентов с хронической болезнью почек, находящихся на программном гемодиализе (в среднем теряется 30-40 мл крови в неделю через диализный контур) [3-5].
В педиатрической практике наиболее частыми причинами формирования ЖДА являются:
- низкие запасы железа у новорожденного,
- алиментарный дефицит на фоне несбалансированного рациона,
- повышенная потребность в железе, связанная с интенсивным ростом,
- избыточные потери железа, превышающие физиологическую норму.
Общий пул железа в организме взрослого человека составляет примерно 3-4 грамма. Большая часть железа находится в циркулирующих эритроцитах, в миоглобине, в составе металлопротеинов (в том числе ряда ферментов), а также в формах хранения и транспорта [2].
У мужчин запасы железа оцениваются примерно в 10 мг/кг и локализуются преимущественно в моноцитарно-макрофагальной системе (печень, селезенка, костный мозг). У женщин запасы железа меньше и зависят от интенсивности менструаций, беременностей, родов и поступления железа с пищей. Запасы железа составляют резерв, который используется при повышенной потребности в синтезе гемоглобина (острая кровопотеря, рост у детей и подростков, беременность и лактация, лечение эритропоэтином) [2].
_1.png)
Источник: Auerbach M. [и др.]. Causes and diagnosis of iron deficiency and iron deficiency anemia in adults [Электронный ресурс] // UpToDate. URL: https://www.uptodate.com/contents/causes-and-diagnosis-of-iron-deficiency-and-iron-deficiency-anemia-in-adults/print (Дата обращения: 11.04.2025).
Дефицит железа развивается в три стадии, что отражается в изменении лабораторных показателей [2]. Эти стадии определяются степенью истощения сначала запасов железа, а затем железа, доступного для синтеза гемоглобина. В итоге, если отрицательный баланс железа сохраняется, развивается анемия с образованием железодефицитных эритроцитов.
Первая стадия – полное истощение запасов железа без анемии.
- На этом этапе еще достаточно железа из «лабильного пула» (ежедневный оборот эритроцитов) для поддержания нормального синтеза гемоглобина.
- Однако человек становится уязвимым к развитию анемии при дальнейших потерях железа.
- Даже при отсутствии анемии, крайне низкие значения ферритина могут сопровождаться жалобами на повышенную утомляемость и снижение физической выносливости.
Вторая стадия – дальнейшая потеря железа приводит к анемии, которая изначально нормоцитарная с нормальным абсолютным количеством ретикулоцитов.
Типичные лабораторные показатели на этой стадии:
- Низкий уровень ферритина и сывороточного железа (Fe).
- Повышенный уровень трансферрина (Tf; общая железосвязывающая способность – ОЖСС).
- Низкая насыщенность трансферрина железом (Fe/ОЖСС, %).
- Повышенная ненасыщенная железосвязывающая способность (НЖСС = ОЖСС – Fe).
Третья стадия – при более выраженном дефиците развивается классическая гипохромная (сниженный MCH) и микроцитарная (сниженный MCV) анемия.
- Ретикулоцитарный ответ при дефиците железа отсутствует, поэтому количество ретикулоцитов остается неадекватно низким (хотя может находиться в нормальном диапазоне).
- Сопутствующие состояния (например, дефицит витамина B12) могут маскировать микроцитоз.
Физиологические компенсаторные механизмы при дефиците железа: повышение выработки эритропоэтина, снижение синтеза гепсидина (при отсутствии воспаления или почечной недостаточности).
Различают два типа дефицита железа:
- Абсолютный дефицит железа – отсутствие или значительное снижение запасов железа в моноцитарно-макрофагальной системе (костный мозг, печень, селезенка).
- Функциональный дефицит железа (железоограниченный эритропоэз) – железо присутствует в организме, но его мобилизация для эритропоэза нарушена.
- Анемия хронических заболеваний (анемия воспаления) – основной механизм: блок высвобождения железа из макрофагов из-за воспаления и повышенного уровня гепсидина.
- Стимуляция эритропоэза (например, при лечении эритропоэз-стимулирующими агентами – ЭСА) – запасы железа есть, но его мобилизация недостаточна для поддержания ускоренного эритропоэза.
Клиническая картина
Клиническая картина ЖДА включает гипоксический и сидеропенический синдромы.
Гипоксический синдром обусловлен недостаточным кислородным обеспечением тканей и включает неспецифические симптомы, общие для всех анемий [1-2]:
- бледность,
- усиленное сердцебиение,
- шум в ушах,
- головная боль,
- слабость.
Сидеропенический синдром связан непосредственно с дефицитом железа и проявляется трофическими нарушениями [1-2]:
- извращения вкуса (пикацизм) – тяга к несъедобным веществам (мел, лед, сырое мясо и др.),
- изменение кожи и ее придатков (сухость кожи, выпадение волос, койлонихии – ломкость, поперечная исчерченность ногтей),
- поражение слизистых оболочек (ангулярный стоматит, атрофический глоссит, жжение языка),
- диспептический синдром.
Менее известные клинические проявления железодефицита [1-2]:
- невротические реакции и неврастения,
- снижение работоспособности мышц и общей толерантности к физической нагрузке,
- нарушение метаболических процессов в миокарде,
- нарушение периферического кровообращения (снижение периферического сопротивления и венозного тонуса, уменьшение функциональных резервов артериол) и микроциркуляции,
- постепенное нарастание явлений миокардиодистрофии и симпатикотонии в вегетативной регуляции сердечной деятельности.
Со стороны желудочно-кишечного тракта возможно развитие хронического гастрита и синдрома мальабсорбции. Также возможно развитие повышенного всасывания токсичных металлов (кадмий) из-за дефицита железа в кишечнике [1].
ЖДА усугубляет гериатрические синдромы [1]:
- старческая астения,
- саркопения,
- падения и переломы,
- деменция.
Диагностика
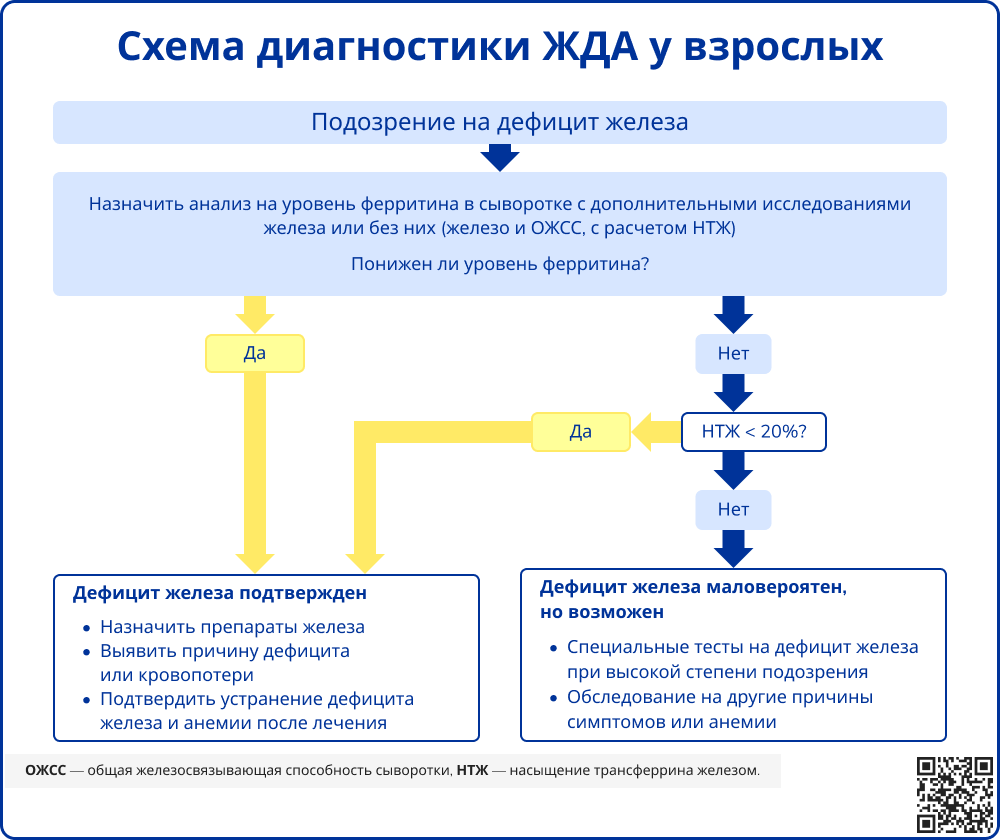
Железодефицитная анемия диагностируется на основании типичных клинических проявлений и гематологических изменений при подтвержденном лабораторно абсолютном дефиците железа [1-2].
Физикальное обследование
Основными проявлениями сидеропенического синдрома являются изменения кожи (пигментации цвета кофе с молоком) и слизистых оболочек (заеды в углу рта), изменения ногтей (ломкость, мягкость, поперечная исчерченность, вогнутость) и волос (ломкость, тусклость, раздваивание кончиков, алопеция). Также могут наблюдаться гипотония (мышечная, артериальная), изменения обоняния (пристрастие к запахам лака, красок, ацетона, выхлопных газов автомобиля) и вкуса (пристрастие к мелу, глине, сырым продуктам) [1-2].
Основные проявления анемического синдрома, обусловленного развитием гипоксии, включают [1-2]:
- слабость, головную боль, головокружение,
- плохую переносимость физических нагрузок,
- снижение аппетита,
- снижение работоспособности, внимания, обучаемости,
- бледность кожных покровов и видимых слизистых оболочек,
- тахикардию, систолический шум.
Лабораторные диагностические исследования
Для подтверждения диагноза рекомендуется оценка следующих лабораторных показателей:
- Общий (клинический) анализ крови
Общий анализ крови включает:
- определение уровня гематокрита, эритроцитов и ретикулоцитов,
- расчет среднего содержания гемоглобина в эритроците (MCH) и средней концентрации гемоглобина в эритроцитарной массе (MCHC),
- оценку среднего объема эритроцитов (MCV).
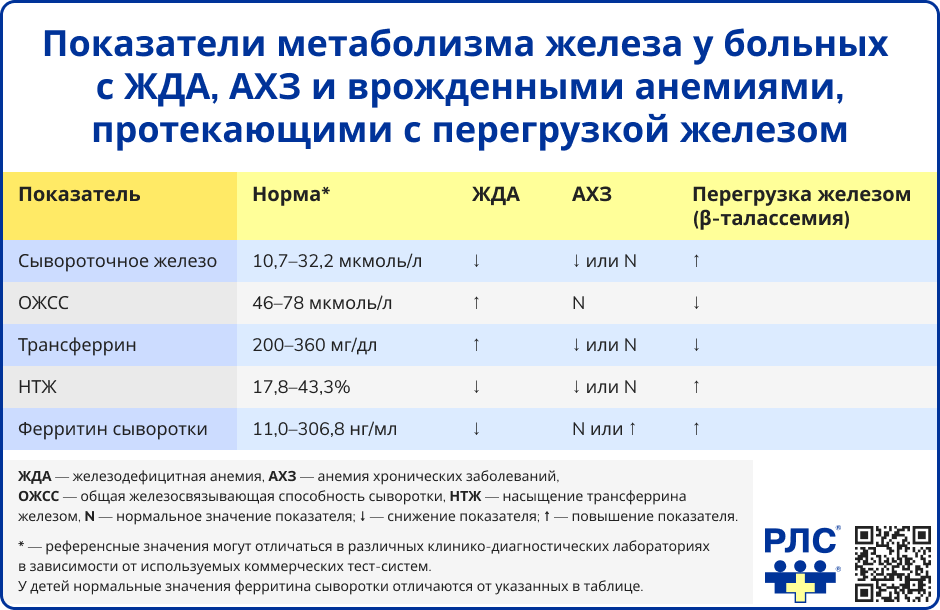
При ЖДА наблюдается снижение уровней гемоглобина, гематокрита, а также показателей MCH, MCHC и MCV. Количество эритроцитов, как правило, остается в пределах нормы. Ретикулоцитоз, как диагностический признак, не является типичным, но может отмечаться при наличии кровопотерь.
Ключевыми морфологическими признаками ЖДА выступают гипохромия эритроцитов и анизоцитоз с преобладанием микроцитов.
Современные гематологические анализаторы предоставляют дополнительные параметры, такие как Ret-He (гемоглобин ретикулоцитов) и HYPO-He (доля гипохромных эритроцитов). Показатель Ret-He менее 30,6 пг и HYPO-He выше 5% указывают на дефицит железа [5].
- Сывороточные показатели обмена железа
Включают измерение уровня ферритина, трансферрина, общей железосвязывающей способности сыворотки (ОЖСС), а также концентрации сывороточного железа и степени насыщения трансферрина железом (НТЖ). Эти параметры необходимы для верификации абсолютного дефицита железа.
ЖДА характеризуется снижением уровня ферритина, что указывает на истощение запасов железа, а также повышением ОЖСС и концентрации трансферрина. Как правило, также отмечаются сниженные уровни сывороточного железа и коэффициента насыщения трансферрина. Однако нормальные или даже завышенные значения этих показателей не исключают ЖДА, так как они могут быть искажены из-за приема препаратов железа, мясной диеты или недавнего переливания эритроцитсодержащих компонентов (в пределах 10-14 дней до анализа), что рекомендуется учитывать при интерпретации результатов [6].
- Биохимический анализ крови
Биохимический анализ крови проводится для установления этиологии анемического синдрома и выявления сопутствующих заболеваний. Оцениваются уровни общего белка и альбумина как индикаторы белково-синтетической функции печени, что важно для корректной трактовки показателей железообмена.
При дифференциальной диагностике с гемолитическими анемиями исследуются концентрации общего, прямого и непрямого билирубина, а также активность лактатдегидрогеназы (ЛДГ). Для исключения цитолитического синдрома определяются уровни аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ). При подозрении на анемию, связанную с хронической болезнью почек, проводят оценку содержания креатинина и мочевины в крови. Также обязательным является общий анализ мочи для исключения гематурии как возможной причины дефицита железа [7].
На практике чаще всего возникает необходимость дифференциальной диагностики между ЖДА и анемией хронических заболеваний (АХЗ).
Ориентироваться позволяют клиническое состояние пациента и базовые лабораторные показатели, отражающие функции печени и почек. Дополнительную диагностическую ценность представляет определение уровня С-реактивного белка (СРБ) и расчет параметра Delta-He (разность между содержанием гемоглобина в ретикулоцитах и зрелых эритроцитах), автоматически вычисляемого гематологическими системами. Для АХЗ характерны отрицательные значения Delta-He и повышенные концентрации СРБ [8].
- Поиск причин дефицита железа
Поиск причин ЖДА включает:
- Подробный сбор анамнеза (особенности диеты, анамнез желудочно-кишечных или аномальных маточных кровотечений, донаций крови, прием НПВС и т.д.);
- У женщин – оценка менструального цикла;
- У всех пациентов – обследование ЖКТ (ФГДС, колоноскопия) для исключения кровопотери;
- Тесты на целиакию;
- Анализ на H. pylori.
Источник: Auerbach M. [и др.]. Causes and diagnosis of iron deficiency and iron deficiency anemia in adults [Электронный ресурс] // UpToDate. URL: https://www.uptodate.com/contents/causes-and-diagnosis-of-iron-deficiency-and-iron-deficiency-anemia-in-adults/print (Дата обращения: 11.04.2025).

Источник: Auerbach M. [и др.]. Causes and diagnosis of iron deficiency and iron deficiency anemia in adults [Электронный ресурс] // UpToDate. URL: https://www.uptodate.com/contents/causes-and-diagnosis-of-iron-deficiency-and-iron-deficiency-anemia-in-adults/print (Дата обращения: 11.04.2025).
Лечение
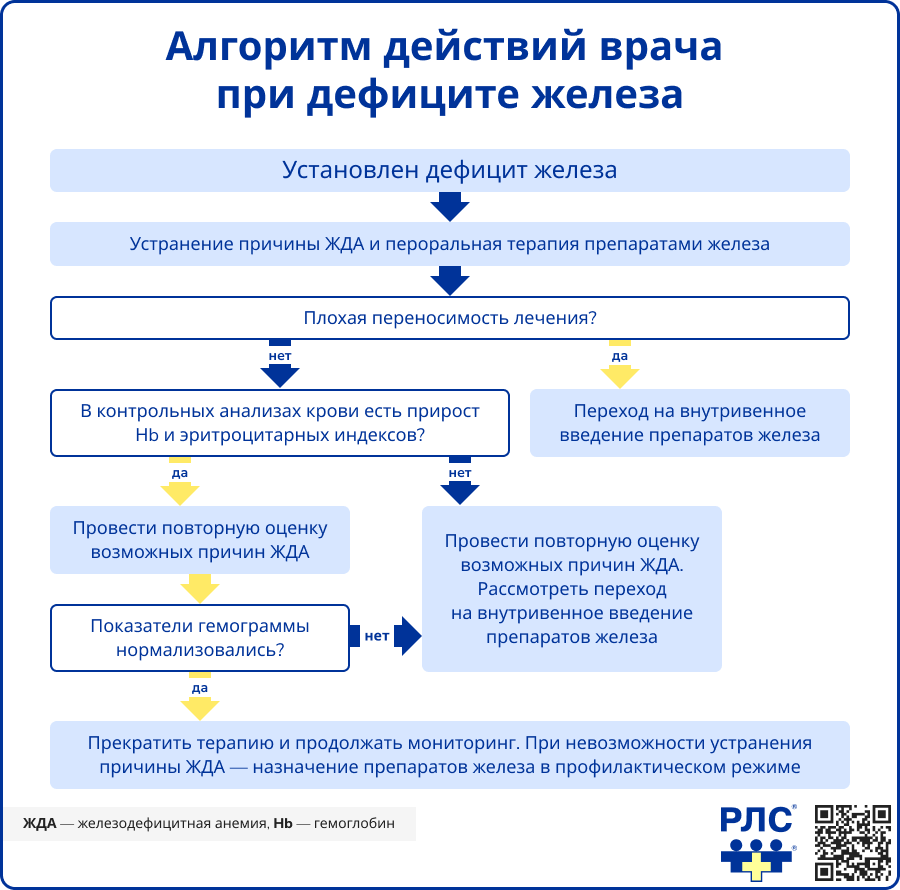
Терапия ЖДА направлена на устранение дефицита железа в объеме, достаточном для нормализации уровня гемоглобина (у женщин – 120-140 г/л, у мужчин – 130-160 г/л) и восполнения тканевых запасов железа, что подтверждается достижением уровня сывороточного ферритина более 40-60 нг/мл.
При латентном дефиците железа цель лечения заключается в нормализации содержания железа в тканях (достижение концентрации ферритина не ниже 40-60 нг/мл) и устранении симптомов сидеропенического синдрома [1].
Лечение пероральными препаратами железа
Пациентам с ЖДА легкой и средней степени тяжести рекомендуется назначение пероральных форм двух- или трехвалентного железа. Выбор дозы и продолжительности курса лечения осуществляется индивидуально с учетом возраста пациента, массы тела и клинических особенностей течения заболевания. Результаты рандомизированных исследований последних лет показали, что эффективность препаратов двух- и трехвалентного железа сопоставима [5-8].
Согласно рекомендациям Всемирной организации здравоохранения, оптимальная суточная доза железа для лечения ЖДА составляет 120 мг, а для профилактики дефицита железа – 60 мг. Клинически доказано, что использование низкодозовых схем лечения – короткими курсами по две недели ежемесячно или с чередованием дней приема (через день в течение месяца) – демонстрирует сопоставимую эффективность при значительно меньшей частоте побочных эффектов по сравнению с ранее применявшимися высокодозовыми режимами (прием 2-3 раза в сутки) [9].
Продолжительность терапии зависит от выраженности железодефицита и составляет от одного до трех месяцев.
Порядка 20% пациентов сообщают о развитии таких побочных эффектов, как запор или диарея, которые устраняются при помощи симптоматической терапии. Диспептические жалобы (включая тошноту и дискомфорт в эпигастрии) можно снизить путем приема препаратов железа во время еды или путем снижения дозировки. Использование доз, превышающих 120 мг в сутки, сопровождается более высоким риском развития нежелательных реакций со стороны желудочно-кишечного тракта.
Лечение парентеральными препаратами железа
Введение препаратов трехвалентного железа внутривенно рекомендуется в следующих клинических ситуациях:
- при выраженной ЖДА, когда уровень гемоглобина составляет менее 70 г/л,
- при продолжающейся кровопотере,
- при отсутствии эффективности, плохой переносимости либо наличии противопоказаний к приему пероральных форм препаратов железа,
- при нарушениях всасывания, вызванных ранее проведенной обширной резекцией кишечника, воспалительными заболеваниями ЖКТ (при язвенном колите, болезни Крона), а также при синдроме мальабсорбции,
- у пациентов с хронической почечной недостаточностью в преддиализной или диализной стадии,
- при наличии хронической сердечной недостаточности,
- при необходимости экстренного восполнения дефицита железа [5],
- при подготовке к хирургическому вмешательству, если выявлена анемия тяжелой степени или предполагаемый срок до операции составляет менее 6 недель, для быстрой коррекции анемического синдрома и снижения риска постоперационных осложнений, связанных с гипоксией [10],
- у пожилых пациентов с ЖДА в сочетании с синдромом старческой астении – для нормализации гемоглобина и улучшения общего функционального состояния [11, 12].
Продолжительность лечения подбирается индивидуально, исходя из тяжести дефицита железа, возраста и массы тела пациента.
Внутривенное введение препаратов железа может сопровождаться рядом побочных эффектов: в редких случаях (менее 1% пациентов) возможно развитие анафилактоидных реакций; при длительном применении – перегрузка железом; в отдельных ситуациях – токсические эффекты, обусловленные запуском перекисного окисления липидов из-за свободных ионов железа.
В ранний послеоперационный период рекомендуется соблюдать осторожность при назначении внутривенных форм железа, поскольку анемия в это время чаще имеет воспалительный характер и сопровождается функциональным дефицитом железа. Введение препаратов оправдано только при достоверно подтвержденном абсолютном дефиците железа и при отсутствии признаков инфекции.
Внутримышечное введение железа не применяется, так как связано с низкой терапевтической эффективностью и высоким риском осложнений: локальный гемосидероз, инфильтраты, формирование абсцессов и даже развитие миосаркомы в месте инъекции.
Переливание крови (гемотрансфузия)
Гемотрансфузионная терапия проводится по показаниям, в основном у пациентов с тяжелой степенью ЖДА, а также при наличии сопутствующих сердечно-сосудистых заболеваний, когда сохраняется риск декомпенсации на фоне выраженной анемии [13].
Мониторинг эффективности лечения препаратами железа на этапе лечения
Контроль эффективности лечения ЖДА проводится на основании анализа клинической картины и динамики лабораторных показателей [1].
В процессе терапии целесообразно осуществлять лабораторный контроль, включающий:
- общий анализ крови с определением гематокритного показателя,
- подсчет количества эритроцитов,
- оценку ретикулоцитарного ответа,
- анализ эритроцитарных индексов (MCV, MCH, MCHC),
- определение уровня ферритина в сыворотке,
- измерение концентрации сывороточного трансферрина,
- оценку ОЖСС,
- определение уровня сывороточного железа,
- расчет степени насыщения трансферрина железом.
Улучшение общего состояния пациентов обычно наблюдается спустя 5-6 суток после начала приема препаратов железа. Рост ретикулоцитов фиксируется через 8-12 дней, а увеличение концентрации гемоглобина становится заметным через 2,5-3 недели, достигая нормальных значений в течение месяца или позднее.
После завершения основного этапа лечения рекомендуется ежемесячно контролировать уровень гемоглобина в течение как минимум одного года, чтобы своевременно определить необходимость поддерживающего приема препаратов железа.
При отсутствии положительной динамики на фоне корректной терапии необходимо исключить железодефицитную анемию, резистентную к лечению препаратами железа (iron-refractory iron deficiency anemia, IRIDA) – редкое наследственное заболевание с аутосомно-рецессивным механизмом передачи [14].
Лечение ЖДА у детей
Лечение ЖДА у детей имеет ряд особенностей, которые следует учитывать в лечебном протоколе [74-76]. В частности, лечение детей препаратами двухвалентного железа часто сопровождается побочными реакциями и низкой приверженностью к лечению, из-за чего следует отдавать предпочтение препаратам трехвалентного железа [8, 15]. Прием последних ассоциируется с высокой (до 100%) приверженностью к лечению, незначительным количеством (6,3%) нежелательных явлений и высокой эффективностью лечения [8].
У детей доза препаратов железа зависит от возраста и составляет 3 мг/кг в сутки у детей до трех лет, у детей старше трех лет – 45-60 мг в сутки, у подростков – до 120 мг в сутки.
Лечение ЖДА у беременных
При легкой и средней степени ЖДА на ранних сроках беременности (I и II триместры) рекомендуется назначать пероральные препараты двух- или трехвалентного железа в дозе от 60 до 100 мг элементарного железа в день в зависимости от срока беременности и степени тяжести анемии [16-18].
При латентном дефиците железа (сывороточный ферритин менее 30 нг/мл) в начале беременности рекомендуется прием 60 мг элементарного железа в день из-за повышенной потребности в железе во время беременности [19].
Всем беременным с анемией после нормализации концентрации гемоглобина рекомендуется продолжить прием пероральных препаратов двух- или трехвалентного железа в течение, по крайней мере, трех месяцев для восполнения запасов железа в организме [18, 20].
Пациенткам с ЖДА во II-III триместре беременности рекомендуется назначение парентеральных препаратов трехвалентного железа при анемии средней и тяжелой степени, непереносимости или неэффективности терапии пероральными препаратами железа [16, 18]. Доза парентерального препарата трехвалентного железа рассчитывается с учетом дефицита железа и массы тела женщины.
Переход на парентеральный препарат трехвалентного железа показан в следующих случаях:
- отсутствие ответа на терапию пероральным препаратом железа (повышение концентрации гемоглобина менее чем на 10 г/л через 4 недели терапии),
- плохая комплаентность или непереносимость пероральных препаратов железа (нежелательные явления со стороны ЖКТ),
- тяжелая, прогрессирующая ЖДА,
- необходимость быстрого лечения анемии (например, срок беременности более 34 недель, отказ от гемотрансфузии).
Доказана высокая эффективность и безопасность высокодозных парентеральных препаратов трехвалентного железа [21, 22]. Внутривенные препараты железа не рекомендуется назначать одновременно с пероральными препаратами железа или при наличии активной инфекции.
Противопоказания для терапии парентеральными препаратами железа:
- анемии, не связанные с дефицитом железа,
- анафилактическая реакция на парентеральный препарат железа в анамнезе,
- I триместр беременности,
- активная острая или хроническая инфекция,
- хроническое заболевание печени.
Проведение гемотрансфузионной терапии рекомендовано беременным при наличии выраженных симптомов анемии или снижении концентрации гемоглобина менее 70 г/л, а также беременным с сопутствующей сердечно-сосудистой патологией, если есть риск декомпенсации состояния на фоне анемии [23, 24]. Также переливание эритроцит содержащих компонентов должно быть предусмотрено у женщин с риском дальнейшего кровотечения, нарушениями сердечной деятельности или при наличии симптомов, требующих немедленного лечения.
Лечение ЖДА у родильниц
Родильницам с легкой и средней степени тяжести послеродовой анемии, у которых гемодинамика стабильна и у которых отсутствуют или слабо выражены симптомы анемии, рекомендуется назначать пероральные препараты двухвалентного железа или пероральные препараты трехвалентного железа от 40 до 100 мг элементарного железа в день в течение трех месяцев [17, 18, 20]
Назначение парентеральных препаратов трехвалентного железа рекомендовано родильницам с анемией тяжелой степени, а также тем, у которых неэффективна терапия пероральными препаратами железа или имеется непереносимость пероральных препаратов железа [18, 25].
Доказана высокая эффективность и высокий профиль безопасности парентеральных форм трехвалентного железа. Доступная в настоящее время информация свидетельствует в пользу назначения внутривенных высокодозных препаратов железа родильницам с тяжелой анемией [26].
Список литературы
- Клинические рекомендации Национального гематологического общества, Национального общества детских гематологов, онкологов, Российского общества акушеров-гинекологов, Общероссийской общественной организации «Российское научное медицинское общество терапевтов», Ассоциации специалистов и организаций лабораторной службы «Федерация лабораторной медицины», Общероссийской общественной организации «Российская ассоциация геронтологов и гериатров», Ассоциации «Эндоскопическое общество «РЭндО», Российского общества профилактики неинфекционных заболеваний «Железодефицитная анемия», М.: 2024.
- Auerbach M. [и др.]. Causes and diagnosis of iron deficiency and iron deficiency anemia in adults [Электронный ресурс] // UpToDate. URL: https://www.uptodate.com/contents/causes-and-diagnosis-of-iron-deficiency-and-iron-deficiency-anemia-in-adults/print (Дата обращения: 11.04.2025).
- Идельсон Л.И., Воробьев П.А. Железодефицитные анемии // Руководство по гематологии. Под ред. В.И. Воробьева. Москва, Ньюдиамед, 2005. P. 171–190.
- Воробьев А.И., Рациональная фармакотерапия заболеваний системы крови / Воробьев А.И., Аль-Ради Л.С., Андреева Н.Е. и др.; Под общей ред. А.И. Воробьева - М.: Литтерра 2009. - 688 с. No Title.
- Camaschella C. Iron deficiency // Blood. 2019. Vol. 133, № 1. P. 30–39.
- Baker R.D., Greer F.R. Diagnosis and Prevention of Iron Deficiency and Iron-Deficiency Anemia in Infants and Young Children (0-3 Years of Age) // Pediatrics. 2010. Vol. 126, №5. P. 1040–1050
- Toblli J., Brignoli R. Iron (III)-hydroxide Polymaltose Complex in Iron Deficiency Anemia // Arzneimittelforschung. 2011. Vol. 57, № 06. P. 431–438.
- Ожегов Е.А., Тарасова И.С., Ожегов А.М. и др. Сравнительная эффективность двух терапевтических планов лечения железодефицитной анемии у детей и подростков // Вопр. гематологии/онкологии и иммунопатологии в педиатрии. — 2005. — Т. 4, №1. — С. 14-19.
- Vos T. et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016 // The Lancet. 2017. Vol. 390, № 10100. P. 1211–1259.
- Muñoz M. et al. International consensus statement on the peri-operative management of anaemia and iron deficiency // Anaesthesia. 2017.
- Liu L.H. et al. Impacts of multi-morbidity, hemoglobin levels, and frailty on functional disability of older adult residents of long-term care facilities: A structural equation analysis // Geriatr Gerontol Int. 2021. Vol. 21, № 6.
- Hong C.-T. et al. Association Between Anemia and Dementia: A Nationwide, Populationbased Cohort Study in Taiwan // Curr Alzheimer Res. 2020. Vol. 17, № 2.
- Goddard A.F. et al. Guidelines for the management of iron deficiency anaemia // Gut. 2011. Vol. 60, № 10. P. 1309 LP – 1316.
- Tchou I. et al. Haematologic data, iron parameters and molecular findings in two new cases of iron-refractory iron deficiency anaemia // Eur J Haematol. 2009. Vol. 83, № 6. P. 595–602.
- Ожегов Е.А. Оптимизация лечения железодефицитной анемии у детей и подростков: Автореф. дис. канд. мед. наук. 2005. 23 p.
- Клинические рекомендации МЗ РФ "Нормальная беременность " 2020 РОАГ https://roag-portal.ru › clinical_ recommendations.
- Коноводова Е.Н., С.В.Н., Б.В.А., и соавт. Диагностика, профилактика и лечение железодефицитных состояний у беременных и родильниц. Клинический протокол // Акушерство и гинекология. 2012. Vol. 4(2). P. 3–9.
- Muñoz M. et al. Patient blood management in obstetrics: Prevention and treatment of postpartum haemorrhage. A NATA consensus statement: A multidisciplinary consensus statement // Blood Transfusion. 2019. Vol. 17, № 2.
- Anemia in Pregnancy: ACOG Practice Bulletin, Number 233 // Obstetrics and Gynecology. 2021. Vol. 138, № 2.
- World health organisation. Guideline: iron supplementation in postpartum women. // Geneva: WHO. 2016.
- Froessler B. et al. Treatment of iron deficiency and iron deficiency anemia with intravenous ferric carboxymaltose in pregnancy // Arch Gynecol Obstet. 2018. Vol. 298, № 1.
- Jose A. et al. Comparison of ferric Carboxymaltose and iron sucrose complex for treatment of iron deficiency anemia in pregnancy- randomised controlled trial // BMC Pregnancy Childbirth. 2019. Vol. 19, № 1.
- Аксельрод Б. и соавт. Клиническое использование эритроцитсодержащих компонентов донорской крови Национальные Клинические рекомендации // Гематология и трансфузиология. 2018. Vol. № 4. P. 372–435.
- Karpati P.C.J. et al. High Incidence of Myocardial Ischemia during Postpartum Hemorrhage // Anesthesiology. 2004. Vol. 100, № 1.
- Holm C. et al. Single-dose intravenous iron infusion or oral iron for treatment of fatigue after postpartum haemorrhage: a randomized controlled trial // Vox Sang. 2017. Vol. 112, № 3
- Sultan P. et al. Oral vs intravenous iron therapy for postpartum anemia: a systematic review and meta-analysis // American Journal of Obstetrics and Gynecology. 2019. Vol. 221, № 1.
Описание проверено экспертом
Статьи по теме Лабораторная диагностика
Болезни в статье:
- N18 Хроническая почечная недостаточность
- K29 Гастрит и дуоденит
- K90.0 Целиакия
- K51 Язвенный колит
- K50 Болезнь Крона [регионарный энтерит]
- I50.0 Застойная сердечная недостаточность
Оцените статью:
- Анемия железодефицитная
- Железодефицитные анемии
- Железо/фолиеводефицитная анемия
- Недостаток железа в пище
- Анемии вследствие нарушений синтеза гемоглобина и обмена железа
Ферритин: что это и как он влияет на наше здоровье
Ферритин — это белок, основной функцией которого является накопление железа в организме. При помощи анализа крови на ферритин можно судить о запасах железа.
Опубликовано на сайте: 01.06.23 | Обновлено на сайте: 08.12.23
Витамин С: зачем он нужен и в чем его польза?
Болгарский перец, шпинат или цитрусы? Узнайте, какие продукты действительно богаты витамином С и почему он так важен.
Опубликовано на сайте: 17.03.25 | Обновлено на сайте: 18.03.25
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).



 (1).png)

