D25 Лейомиома матки, МКБ-10
- D25.0 Подслизистая лейомиома матки
- D25.1 Интрамуральная лейомиома матки
- D25.2 Субсерозная лейомиома матки
- D25.9 Лейомиома матки неуточненная
Отредактировано: 05.07.2024
Миома матки
Определение и классификация
Миома матки (лейомиома, фиброид) – доброкачественная моноклональная опухоль, происходящая из гладкомышечных клеток тела или шейки матки [1].
Понятие «моноклональная» в определении этого заболевания означает, что опухоль развивается из единственной клетки-предшественника [2]. При этом необходимо помнить, что миома «всегда является множественной», т.е. обнаружение одной миомы свидетельствует о наличии и потенциальном росте других миом, хотя бы микроскопических и недоступных инструментальной визуализации.
Общепринятой является классификация миомы по FIGO в зависимости от локализации относительно слоёв стенки матки [3].
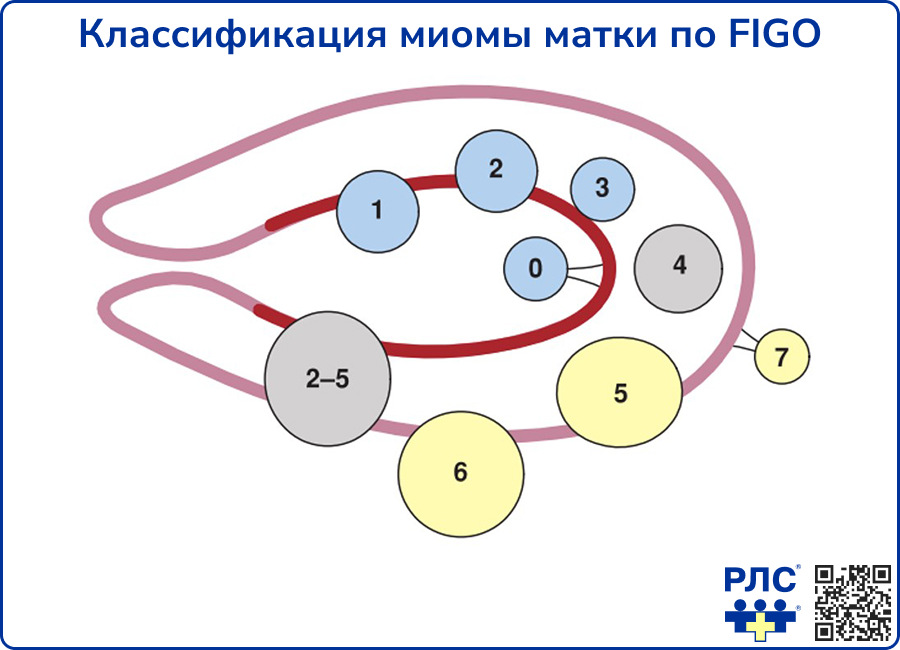
Источник: Barbara L. Hoffman, John 0. Schorge, Lisa M. Halvorson, Cherine A. Hamid, Marlene M. Corton, Joseph I. Schaffer. Williams Gynecology, 4th edition изд. New-York: McGraw Hill Professional, 2020.

К типу 8 относятся миомы, находящиеся вне миометрия: шеечные, паразитирующие, миомы широкой связки и т.п. [2].
Паразитирующая миома – миома, которая получает кровоснабжение от смежных органов и со временем теряет связь с маткой.
Этиология и патогенез
Происхождение клетки-предшественницы миомы матки объясняют две теории:
1) Повреждение в онтогенезе как следствие длительного нестабильного периода эмбриональных гладкомышечных клеток;
2) Повреждение в репродуктивном периоде, как следствие многократно повторяющихся гипертрофии и отторжения эндометрия [4].
В патогенезе роста миоматозных узлов ключевую роль играет воздействие эстрогенов и прогестерона. Прогестерон вступает в качестве основного митогена для клеток миомы, тогда как эстрогены, в том числе эстрадиол, потенцируют его действие, увеличивая концентрацию рецепторов к прогестерону типов A и B [1, 2]. Для клеток миомы характерна повышенная плотность рецепторов к эстрогенам и прогестерону в сравнении с окружающим миометрием [5, 6].
Клетки миомы матки отличаются от нормальных клеток миометрия также повышенным ответом на действие факторов ангиогенеза, как за счёт увеличения концентрации рецепторов, так и посредством формирования особых каскадов молекулярного ответа. Показано увеличение плотности рецепторов сосудисто-эндотелиального фактора роста (VEGF) в клетках миомы [7]. Обнаружена активация каскада митоген-активируемых протеинкиназ под действием эпидермального фактора роста (EGF), нехарактерная для нормальных клеток миометрия и приводящая к полиплоидизации гладких миоцитов [8]. К факторам роста, стимулирующим пролиферацию миомы, относятся также инсулиноподобный факторы роста (IGF), фактор, индуцируемый при гипоксии (HIF), фактор роста фибробластов, тромбоцитарный фактор роста, ангиотензин, оксид азота, интерлейкин-8 (IL-8), матриксные металлопротеиназы [1]. Клетки миомы, помимо повышенной чувствительности к перечисленным субстанциям, способны к их аномально высокой продукции. Таким образом, по мере роста миоматозный узел формирует собственную специфическую аутокринно-паракринную регуляцию, постепенно снижающую зависимость опухоли от гормональной стимуляции [4].
Роль наследственности подтверждается существованием «семейных форм» миомы матки. Склонность к образованию миомы связывают с хромосомными перестройками, приводящими к повышенной экспрессии гена HMGA2, который подавляет гены p16Ink4a и p19(p14)Arf, обладающие антипролиферативной активностью [1, 9]. Также обнаружены соматические мутации в экзоне 2 гена MED12, кодирующего РНК-полимеразу [10].
Факторы риска развития миомы матки соотносятся с теориями этиологии и патогенеза этого заболевания:
- раннее менархе, отсутствие родов в анамнезе и поздний репродуктивный возраст, возможно, сопряжены с бóльшим количеством менструальных циклов в течение жизни, т.е. с большей частотой гипертрофии гладких миоцитов, повышающей риск их повреждения;
- ожирение, приём тамоксифена и комбинированные оральные контрацептивы (КОК) изменяют гормональный баланс, в т.ч. могут влиять на локальные воздействия эстрогенов и прогестерона на клетки миометрия, приводя к росту миоматозного узла;
- высокий паритет сопровождается многократной гиперплазией миометрия в течение беременности, а также потенциальным повреждением миоцитов при аномалиях роста плаценты или во время родов;
- менопауза связана одновременно с изменением гормональной регуляции и накопительным действием повреждающих факторов в течение жизни женщины;
- курение и воспалительные процессы нарушают синтез факторов ангиогенеза, изменение баланса которых может ускорять рост миомы.

Источник: Климашевский В.Ф., Туркевич Е.А. Морфологическая классификация сарком тела матки. Практ онкол 2008; 9: 3: 125— 131.
Миома отличается экспансивным ростом: прилежащие к опухоли ткани растягиваются и подвергаются атрофии, в результате чего формируется соединительнотканная капсула, чётко отграничивающая узел от миометрия.
Для миомы характерна относительная недостаточность кровотока в опухоли, приводящая к ишемии. Часто в миоматозном узле развивается некроз с различными вариантами последующего замещения гладкомышечной ткани. Возможны гиалиноз миомы, образование кальцификатов, кист, гематом, замещение жировой тканью. Перечисленные изменения, обнаруженные при гистологическом исследовании, считаются вариантами нормы [2].
При субмукозном расположении миомы ишемия узла нарушает локальную регенерацию эндометрия, что может увеличивать объём и продолжительность менструальных кровотечений. Аномальные маточные кровотечения (АМК) при миоме матки также связывают с изменением синтеза провоспалительных цитокинов и вазодилататоров, увеличением площади эндометрия и нарушением венозного оттока [2].
Слабым кровоснабжением объясняется склонность миомы матки к «паразитированию». Повышенный синтез факторов неоангиогенеза приводит к росту сосудов к миоме матки от прилежащих органов, включая брюшину и сальник. По мере роста миомы в направлении более обильного кровотока сосудистая ножка, связывающая опухоль с маткой, может подвергаться атрофии.
Рост миоматозного узла влияет на локальную нейроэндокринную регуляцию миометрия и эндометрия за счёт механической деформации стенки матки и формирования специфического биохимического окружения. Эти изменения повышают синтез факторов воспаления в эндометрии, снижая вероятность успешной имплантации. Деформация полости матки из-за роста миомы также препятствует нормальному развитию беременности. Наличием миомы матки обусловлена незначительная доля случаев бесплодия (1-3%) [2]. При этом наиболее доказанной является ассоциация бесплодия с субмукозным расположением узла. Миома матки рассматривается как причина бесплодия только в тех случаях, когда исключены другие возможные механизмы его развития [11].
Клиническая картина
В большинстве случаев миома матки персистирует бессимптомно и становится случайной находкой при плановом обследовании.
Возможные клинические проявления миомы матки:
- аномальные маточные кровотечения – чаще всего увеличение продолжительности и объёма менструации;
- хроническая тазовая боль;
- дисменорея;
- нарушение функции смежных органов: дизурия, запоры;
- диспареуния;
- бесплодие (считается симптомом миомы матки при исключении других причин);
- невынашивание беременности [1, 2].
Острой болью проявляются, как правило, осложнения заболевания: острые нарушения кровотока в миоматозном узле, перекрут сосудистой ножки, рождающаяся миома [4].
Диагностика
Физикальное обследование
Общий осмотр пациента не позволяет выявить специфических признаков миомы матки. При развитии железодефицитной анемии как осложнения миомы матки возможно обнаружение характерных изменений кожи, волос и ногтей.
При гинекологическом осмотре:
- если миоматозный узел расположен в области шейки и перешейка, возможны смещение и деформация шейки матки, видимые при осмотре в зеркалах;
- бимануальное исследование в ряде случаев помогает определить увеличение матки (в неделях беременности), размер и расположение миоматозных узлов.
Лабораторные исследования
- Общий анализ крови,
- Биохимический анализ крови,
- Гемостазиограмма.
Лабораторные исследования не позволяют диагностировать миому матки, но необходимы для выявления и оценки тяжести осложнений, включая анемию и нарушение кровоснабжения в узле.
Инструментальные исследования

Лечение
Консервативное лечение
Консервативное лечение показано пациенткам при бессимптомном течении миомы матки, небольших размерах узла (менее 12 недель), отсутствии быстрого роста и осложнений.
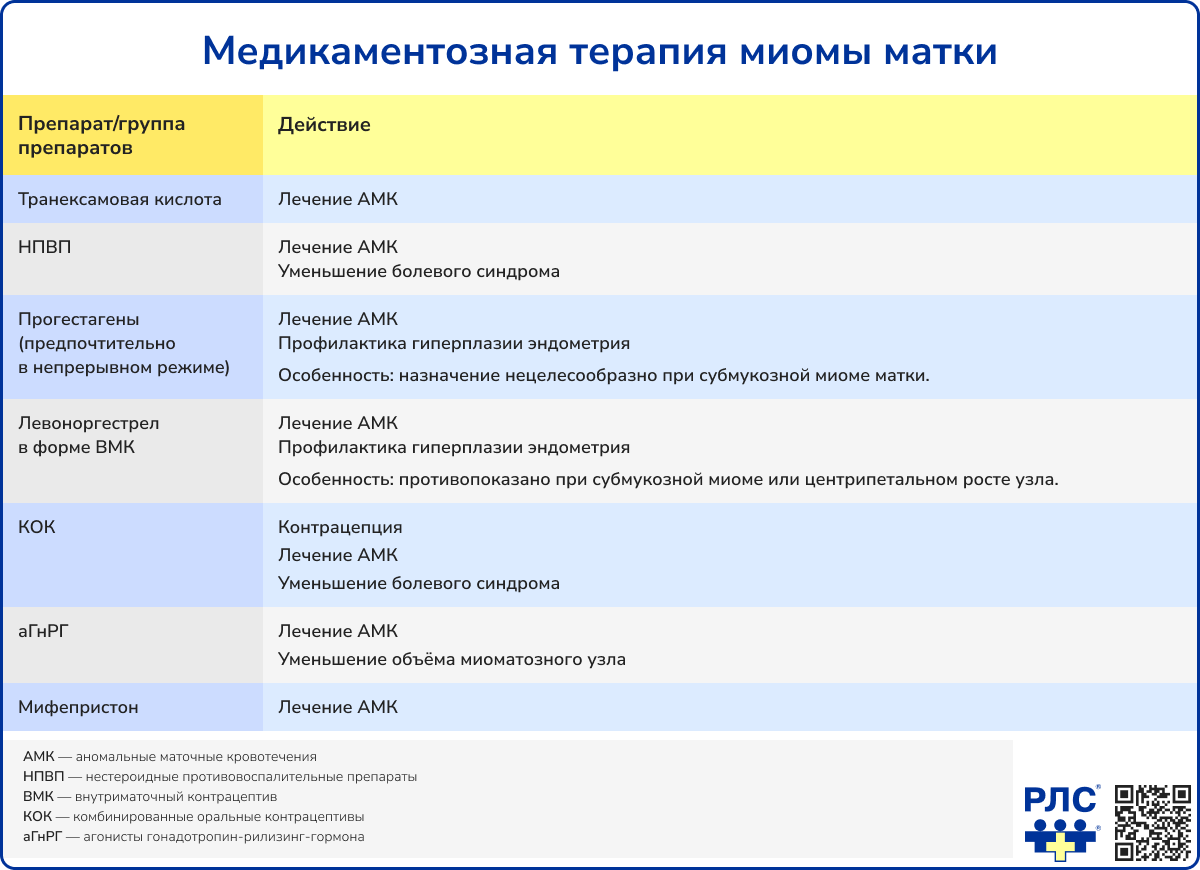
Эффективность медикаментозной терапии оценивают каждые 3 месяца и при отсутствии эффекта заменять препарат [1].
Лечение агонистами гонадотропин-рилизинг гормона (аГнРГ) не проводится более 6 месяцев либо дополняется add-back терапией, т.к. длительная гипоэстрогения в результате приёма этой группы препаратов приводит к потере минеральной плотности костной ткани. АГнРГ могут быть назначены на 3 месяца в качестве подготовки к хирургическому лечению миомы матки для снижения кровопотери и продолжительности операции [1]. Нежелательный эффект предоперационного применения аГнРГ заключается в уменьшении выраженности капсулы, что затрудняет вылущивание узла [12].
Хирургическое лечение
Показания для хирургического лечения миомы матки:
- АМК, приводящие к анемии,
- хроническая тазовая боль, снижающая качество жизни,
- симптомы сдавления смежных органов (нарушения мочеиспускания и дефекации и т.п.),
- размер опухоли более 12 недель беременности,
- рост опухоли со скоростью более 4 недель беременности за 1 год,
- рост опухоли в постменопаузе,
- субмукозное расположение миомы,
- субсерозная миома на сосудистой ножке,
- межсвязочное или низкое (шеечное, перешеечное) расположение миомы,
- бесплодие или невынашивание беременности при исключении других причин,
- признаки нарушения кровообращения в миоматозном узле (отёк, некроз, гиалиноз).
Поскольку миома матки всегда является множественной опухолью, единственный радикальный метод лечения – тотальная гистерэктомия. Допустима субтотальная гистерэктомия после исключения патологии шейки матки, однако этот вариант не имеет доказанных преимуществ [13]. Гистерэктомия предлагается только пациенткам, реализовавшим репродуктивную функцию и не планирующим беременности в будущем [1].
Пациенткам, планирующим беременность, в качестве хирургического лечения рекомендована миомэктомия. Вмешательство проводят в I фазу менструального цикла, в 5-14 день. Допустимо удаление миоматозного узла лапароскопическим, лапаротомическим, трансвагинальным и гистероскопическим доступом.

У пациенток с высоким операционным риском или желающих сохранить матку в качестве альтернативы хирургическому лечению возможно выполнение эмболизации маточных артерий (ЭМА). Нежелательно использовать этот метод для лечения женщин, впоследствии планирующих беременность, особенно в позднем репродуктивном возрасте, т.к. ЭМА снижает овариальный резерв, вероятность успешного зачатия и вынашивания [14]. Частота неблагоприятных исходов беременности после ЭМА ниже, чем после миомэктомии [15].
Органосберегающим методом лечения миомы также является абляция фокусированным ультразвуком под контролем МРТ (MRgFUS). Данных об особенностях назначения MRgFUS недостаточно. Целесообразность проведения MRgFUS в конкретной клинической ситуации, наличие условий и противопоказаний для вмешательства определяет врач акушер-гинеколог.
Список литературы
- РОАГ. Клинические рекомендации “Эндометриоз”. 2020.
- Barbara L. Hoffman, John 0. Schorge, Lisa M. Halvorson, Cherine A. Hamid, Marlene M. Corton, Joseph I. Schaffer. Williams Gynecology, 4th edition изд. New-York: McGraw Hill Professional, 2020.
- Munro M.G. et al. The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions //International Journal of Gynecology & Obstetrics. – 2018.
- Савельева Г.М. и др. Национальное руководство //Акушерство–М.: Гэотар-Медиа. – 2015.
- Grings A.O. et al. Protein expression of estrogen receptors α and β and aromatase in myometrium and uterine leiomyoma //Gynecologic and obstetric investigation. – 2012. – Т. 73. – №2. – C. 113-117.
- lshikawa H., Ishi K., Serna V.A., et al: Progesterone is essential for maintenance and growth of uterine leiomyomata. Endocrinology 151(6):2433, 2010.
- Plewka D, Morek M, Bogunia E, Waloszek J, Plewka A. Expression of VEGF isoforms and their receptors in uterine myomas. Ginekol Pol. 2016;87(3):166-77. doi: 10.17772/gp/60979. PMID: 27306124.
- Ren Y, Yin H, Tian R, Cui L, Zhu Y, Lin W, Tang XD, Gui Y, Zheng XL. Different effects of epidermal growth factor on smooth muscle cells derived from human myometrium and from leiomyoma. Fertil Steril. 2011 Oct;96(4):1015-20. doi: 10.1016/j.fertnstert.2011.07.004. Epub 2011 Aug 6. PMID: 21821245.
- Markowski DN, Helmke BM, Belge G, Nimzyk R, Bartnitzke S, Deichert U, Bullerdiek J. HMGA2 and p14Arf: major roles in cellular senescence of fibroids and therapeutic implications. Anticancer Res. 2011 Mar;31(3):753-61. PMID: 21498692.
- Osinovskaya N. S. et al. Frequency and spectrum of MED12 exon 2 mutations in multiple versus solitary uterine leiomyomas from Russian patients //International journal of gynecological pathology. – 2016. – Т. 35. – №. 6. – С. 509-515.
- American Society fOr Rqroduaive Medicine: Remon! of myomas in U)'IIlptomatic; parlc.au to improve; fenility :u1dlor roduc;c; miscarriage rau:: a guideline. Pertil Swrll108(3):416, 2017.
- Shah N, Egbase E, Sideris M, Odejinmi F. What happens after randomised controlled trials? Uterine fibroids and ulipristal acetate: systematic review and meta-analysis of "real-world" data. Arch Gynecol Obstet. 2021 May;303(5):1121-1130. doi: 10.1007/s00404-020-05918-3. Epub 2021 Jan 2. PMID: 33389100.
- Mas A. et al. Updated approaches for management of uterine fibroids //International journal of women’s health. – 2017 – Т. 9 – С. 607.
- Worldwide A. A. M. I. G. AAGL practice report: practice guidelines for the management of hysteroscopic distending media:(replaces hysteroscopic fluid monitoring guidelines. J Am Assoc Gynecol Laparosc. 2000; 7: 167–168.) //Journal of minimally invasive gynecology. – 2013 – Т. 20 – №. 2 – С. 137-148.
- SOGC clinical practice guideline, The Management of Uterine Leiomyomas, No. 318.
Описание проверено экспертом
Статьи по теме Акушерство и гинекология
- Аномальные маточные кровотечения
- Дисменорея
- Эндометриоз
- Преэклампсия
- HELLP-синдром
- Синдром предменструального напряжения
- Аменорея и олигоменорея
- Менопауза и климактерический синдром
- Синдром поликистозных яичников
- Инфекции мочевыводящих путей при беременности
- Хламидийная инфекция
- Гонококковая инфекция
- Урогенитальный трихомониаз
- Синдром гиперстимуляции яичников
- Акушерская тромбоэмболия
- Врожденная дисфункция коры надпочечников
- Полипы эндометрия
- Доброкачественная дисплазия молочной железы
- Воспалительные заболевания молочных желез
Болезни в статье:
- E66 Ожирение
- N92 Обильные, частые и нерегулярные менструации
- N97 Женское бесплодие
- R10.2 Боли в области таза и промежности
- N94.5 Вторичная дисменорея
- N94.1 Диспареуния
- N96 Привычный выкидыш
- D50.0 Железодефицитная анемия вторичная вследствие потери крови (хроническая)
Фармгруппы в статье:
Оцените статью:
- Фиброма матки
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
лейомиома матки
новообразование половых органов
новообразование матки
миома матки, миома матки больших размеров, лейомиома матки, миома матки, несовместимая с беременностью, Новообразования половых органов, диагностированные или подозреваемые новообразования половых органов, подозреваемый рак половых органов, опухоли матки, Фиброзная опухоль матки, несовместимая с беременностью,


