- Эпидемиология
- Морфологическая классификация
- Метастазирование
- TNM классификация рака почки
- Факторы прогноза
- Клинические проявления рака почки
- Диагностика и стадирование рака почки
- Хирургическое лечение локализованного рака почки
- Лимфаденэктомия при раке почки
- Хирургическое лечение рака почки с опухолевым тромбозом почечной и нижней полой вены
- Осложнения радикальной нефрэктомии
- Органосохраняющее лечение при раке почки
- Общие положения
- Осложнения
- Хирургическое лечение солитарных и единичных метастазов рака почки
- Хирургическое лечение местных рецидивов после нефрэктомии
- Лекарственное лечение метастатического рака почки
- Химиотерапия
- Гормональная терапия
- Иммунотерапия
- Заключение
C64 Злокачественное новообразование почки, кроме почечной лоханки, МКБ-10
Отредактировано: 02.04.2024
д.м.н. Матвеев В.Б.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Эпидемиология. Морфологическая классификация. TNM классификация рака почки. Факторы прогноза. Клинические проявления рака почки. Диагностика и стадирование рака почки. Хирургическое лечение локализованного рака почки. Органосохраняющее лечение при раке почки. Хирургическое лечение солитарных и единичных метастазов рака почки. Лекарственное лечение метастатического рака почки. Лучевая терапия при костных метастазах рака почки. Бисфосфонаты
Эпидемиология
Несмотря на огромное количество исследований, посвященных раку почки, этиология этой формы опухолей до сих пор не ясна. Однако выделено несколько групп факторов риска, способствующих развитию данного новообразования.
Рак почки занимает 10-е место по уровню заболеваемости среди злокачественных новообразований. С 1992 по 1998 г. заболеваемость данным видом опухоли в России возросла с 6,6 до 9,0 на 100 тыс. населения. Данные о смертности при раке почки в нашей стране отсутствуют. В США в течение 1998 г. было зарегистрировано 30 тыс. новых случаев заболевания, при этом опухоль почки послужила причиной смерти 12 тыс. человек.
Пол и возраст
Заболеваемость почечно-клеточным раком зависит от возраста и достигает максимума к 70 годам. Мужчины страдают данной патологией в 2 раза чаще, чем женщины.
Курение
На сегодняшний день доказано, что курение табака является одним из наиболее значимых факторов риска развития различных злокачественных новообразований. Риск появления опухоли почки у курильщиков обеих половых групп возрастает с 30 до 60% по сравнению с некурящим населением. При отказе от курения вероятность развития заболевания снижается. По данным ряда когортных международных исследований, в течение 25 лет после отказа от курения риск появления рака почки снижается на 15%.
Ожирение
В большинстве исследований подтверждено неблагоприятное влияние чрезмерной массы тела на вероятность развития рака почки. Ожирение приводит к увеличению частоты заболеваемости почечно-клеточным раком на 20%. Колебания веса, а также значительное увеличение массы тела у взрослых являются независимыми факторами риска развития данной патологии. Механизм влияния ожирения на развитие рака почки до сих пор не ясен. Возможно, это связано с увеличением концентрации эндогенных эстрогенов и/или с биологической активностью инсулиноподобных факторов роста.
Артериальная гипертензия
В нескольких эпидемиологических исследованиях было отмечено увеличение риска развития рака почки у больных артериальной гипертензией на 20%. Остается открытым вопрос, является ли причиной развития почечно-клеточного рака собственно гипертензия или развитие опухоли потенцируется применением разнообразных гипотензивных препаратов.
Лекарственные препараты
Многие авторы связывают появление почечно-клеточного рака с использованием диуретических препаратов. Риск развития данной патологии у больных, получавших мочегонные средства по различным показаниям, составляет более 30%. Было установлено, что в значительной степени риск развития рака почки увеличивают препараты, содержащие амфетамин. В литературе имеются немногочисленные сообщения о том, что вероятность заболевания опухолью почки увеличивает прием фенацетин-содержащих анальгезирующих средств.
Заболевания почек
В больших эпидемиологических исследованиях не было выявлено достоверного увеличения частоты заболеваемости раком почки у больных мочекаменной болезнью и пациентов с кистами почек. Отмечен повышенный риск развития почечно-клеточного рака при терминальной стадии хронической почечной недостаточности.
Сахарный диабет
В ряде работ отмечено увеличение заболеваемости почечно-клеточным раком у больных, страдающих сахарным диабетом. Однако показатели смертности от рака почки в данной группе аналогичны таковым в популяции. Тесная взаимосвязь между сахарным диабетом, ожирением и гипертензией затрудняет оценку истинного влияния каждого из этих заболеваний на частоту развития опухолей почки.
Репродуктивные и гормональные факторы
Потенциальное патогенетическое значение гормональных факторов в развитии рака почки доказано на животных моделях. В здоровой и малигнизированной тканях почки животных моделей выявлены рецепторы половых гормонов. Получены данные о возможности развития эстроген-индуцированной аденомы и карциномы почки у хорьков.
Питание
В эпидемиологических исследованиях отмечена корреляция частоты возникновения рака почки с употреблением мяса, растительных продуктов, а также маргарина и масла. Однако достоверного влияния конкретных продуктов питания на заболеваемость почечно-клеточным раком не выявлено. Возможно, патогенетическое значение имеют не сами исходные продукты, а вещества, выделяющиеся при приготовлении пищи. Доказанным канцерогенным эффектом обладают пиролизисные составляющие, в частности, гетероциклические амины, вырабатывающиеся при высокотемпературной обработке мяса. Употребление овощей и фруктов, по данным большинства авторов, способствует снижению риска развития рака почки. Влияние употребления алкоголя, кофе и чая на заболеваемость опухолями почки не изучено.
Профессия
Почечно-клеточный рак не является профессиональным заболеванием. Однако опубликованы данные о повышенном риске развития данной патологии у лиц, занятых на ткацком, резиново-каучуковом, бумажном производстве, имеющих контакт с промышленными красителями, нефтью и ее производными, промышленными ядохимикатами и солями тяжелых металлов.
Морфологическая классификация
В основе традиционных классификаций рака почки лежат особенности морфологии клетки и клеточного ядра. Современные классификации учитывают данные морфологических, цитогенетических и молекулярных исследований и выделяют 5 видов рака почки:
- Светлоклеточный — 60–85%.
- Хромофильный (папиллярный) — 7–14%.
- Хромофобный — 4–10%.
- Онкоцитарный — 2–5%.
- Рак собирательных протоков — 1–2%.
О прогностической значимости различных вариантов почечно-клеточного рака будет сказано ниже.
Метастазирование
Рак почки метастазирует гематогенным и лимфогенным путем. На момент установления диагноза метастазы обнаруживаются у 25% пациентов. Выживаемость данных больных составляет от 6 до 12 мес, и только 10% переживают 2 года. Приблизительно у 30–50% больных в различные сроки после нефрэктомии появляются метахронные метастазы. Прогноз последней группы несколько лучше, однако 5-летняя выживаемость не превышает 9%. По данным Saitoh et al. (1982), наиболее частыми локализациями множественных метастазов являются легкие — 76%, лимфатические узлы — 64%, кости — 43%, печень — 41%, ипсилатеральный и контралатеральный надпочечник 19% и 11,5%, контралатеральная почка 25%, головной мозг 11,2%. Солитарные метастазы или метастатическое поражение только одного органа имеют место только в 8–11% случаев.
Говоря о течении метастатической болезни при раке почки, нельзя не упомянуть о случаях спонтанной регрессии и стабилизации. Спонтанная регрессия отмечается у 0,4–0,8% больных раком почки. Это касается в подавляющем большинстве случаев регрессии легочных метастазов. Стабилизация болезни, определяемая как отсутствие роста и появления новых метастазов, наблюдается у 20–30% больных. С такой же частотой отмечается стабилизация болезни (отсутствие роста первичной опухоли) у больных раком почки без метастазов. Этот феномен должен учитываться при решении вопроса о хирургическом или системном лечении больных с высоким риском, которые в действительности могут прожить дольше без всякого лечения.
TNM классификация рака почки
Почечно-клеточный рак характеризуется весьма вариабельным клиническим течением, что обусловлено генетической гетерогенностью и морфологическим разнообразием данной группы опухолей.
В настоящее время в России, как и во многих странах, используется TNM классификация, предложенная Международным противораковым союзом, подробно освещающая степень распространенности опухолевого процесса с целью определения лечебной тактики.
TNM клиническая классификация почечно-клеточного рака (2002)
Критерий Т (первичная опухоль):
Тх — первичная опухоль не может быть оценена;
Т0 — нет данных о первичной опухоли;
Т1 — опухоль не более 7 см в наибольшем измерении, ограниченная почкой;
T1a — опухоль до 4 см;
T1b — опухоль 4–7 см;
Т2 — опухоль более 7 см в наибольшем измерении, ограниченная почкой;
Т3 — опухоль распространяется в крупные вены, или инвазирует надпочечник, или окружающие ткани, но не выходит за пределы фасции Герота;
Т3а — опухолевая инвазия надпочечника или паранефральной клетчатки в пределах фасции Герота;
Т3b — опухоль распространяется в почечную вену или нижнюю полую вену ниже диафрагмы;
Т3с — опухоль распространяется в нижнюю полую вену выше диафрагмы или инвазирует ее стенку;
Т4 — опухоль распространяется за пределы фасции Герота.

Рисунок 1. Схематическое изображение стадий T1 и T2

Рисунок 2. Схематическое изображение стадий T3a и T3b
Критерий N (регионарные лимфатические узлы):
Nх — регионарные лимфатические узлы не могут быть оценены;
N0 — нет метастазов в регионарных лимфатических узлах;
N1 — метастаз в одном регионарном лимфатическом узле;
N2 — метастазы более, чем в одном регионарном лимфатическом узле.
Критерий М (отдаленные метастазы):
Мх — отдаленные метастазы не могут быть оценены;
М0 — нет отдаленных метастазов;
М1 — отдаленные метастазы.
Критерии pTNM (патологоанатомическая классификация):
pT, pN и pM критерии соответствуют T, N и М критериям.
Критерий G (гистопатологическая градация):
Gх — степень дифференцировки не может быть оценена;
G1 — высоко дифференцированная опухоль;
G2 — умеренно дифференцированная опухоль;
G3–4 — низко дифференцированная/недифференцированная опухоль.
Таблица 1
Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия III | T1 | N1 | M0 |
| T2 | N1 | M0 | |
| T3 | N0, N1 | M0 | |
| Стадия IV | T4 | N0, N1 | M0 |
| любая T | N2 | M0 | |
| любая T | любая N | M1 |
Факторы прогноза
Клинические факторы
Одним из важнейших направлений современной онкоурологии является выделение факторов, позволяющих составить индивидуальный прогноз и определить оптимальную тактику лечения больных раком почки.
По данным ряда авторов, прогностически неблагоприятным являются:
- Общее тяжелое состояние больного.
- Наличие клинических симптомов заболевания на момент установления диагноза.
- Снижение массы тела более, чем на 10%.
Напротив, возраст, пол и национальность не влияют на прогноз.
В ряде исследований продемонстрировано достоверное неблагоприятное влияние на выживаемость увеличения скорости оседания эритроцитов (СОЭ), повышенный уровень сывороточных гаптоглобина, ферритина, C-реактивного белка, орозомукоида, альфа1-антитрипсина, ИЛ–6.
У больных диссеминированным почечно-клеточным раком прогностическое значение имеют:
- Анемия.
- Гиперкалиемия.
- Гипоальбуминемия.
- Повышение уровня щелочной фосфатазы сыворотки крови.
Показано влияние на исход заболевания уровня следующих факторов: хромогранина А, нейронспецифической энолазы (NSE), ракового антигена 125 (СА125), опухоль-ассоциированного ингибитора трипсина (TATI) и эндогенного эритропоэтина (ЭП). В настоящее время проводятся исследования, посвященные изучению генетических маркеров в крови и моче, которые могут позволить составить индивидуальный прогноз больных раком почки.
Патоморфологические факторы
Стадия опухолевого процесса (Т), отражающая анатомическую распространенность новообразования, является наиболее значимым фактором прогноза при раке почки. Пациенты с опухолью, ограниченной почкой, имеют лучший прогноз. Инвазия за пределы капсулы Герота (T3a) уменьшает выживаемость на 27%, наличие опухолевого тромбоза почечной и нижней полой вен (T3b-c) — на 40% (табл. 2, рис. 3).
Таблица 2
Выживаемость 2507 больных раком почки в зависимости от стадии T (Давыдов М.И., Матвеев В.Б., собственные данные)
| Стадия T | 5-летняя выживаемость, % |
| I | 75,8 |
| II | 66,8 |
| IIIa | 39 |
| IIIb-c | 25,7 |
| IV | 14,3 |

Рисунок 3. Выживаемость 2507 больных раком почки в зависимости от стадии T (Давыдов М.И., Матвеев В.Б., собственные данные)
Инвазия в коллатеральные вены и капилляры также является неблагоприятным фактором прогноза.
Наличие метастазов в лимфатические узлы у больных раком почки ассоциировано с крайне плохим прогнозом: 5 лет переживают от 5 до 30% пациентов (рис. 4).
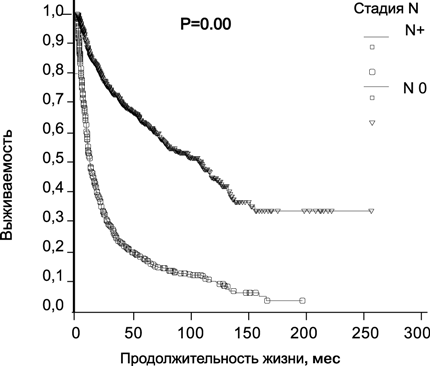
Рисунок 4. Выживаемость 2507 больных раком почки в зависимости от стадии N (Давыдов М.И., Матвеев В.Б., собственные данные)
Появление отдаленных метастазов резко ухудшает прогноз при раке почки. 5-летняя выживаемость больных диссеминированным раком почки составляет 14,6%, что достоверно меньше, чем в группе пациентов с локализованной опухолью (57,3%) (р=0,0000) (рис. 5).
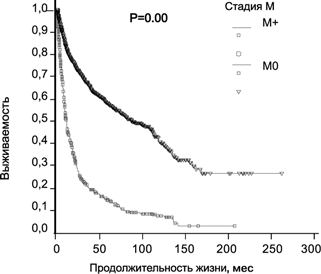
Рисунок 5. Выживаемость 2507 больных раком почки в зависимости от стадии M (Давыдов М.И., Матвеев В.Б., собственные данные)
При наличии отдаленных метастазов стадия Т почечно-клеточного рака прогностического значения не имеет.
Бóльшая продолжительность жизни при диссеминированном почечно-клеточном раке наблюдается при метахронном появлении метастазов и солитарных опухолевых очагах, локализующихся в одном органе. Одним из наиболее важных прогностических факторов является возможность радикального удаления всех определяемых метастазов.
Гистопатоморфологические признаки
Большинство современных гистологических классификаций принимают во внимание морфологические признаки клеточного ядра, которые являются независимыми факторами прогноза, занимающими второе место по значимости после стадии заболевания. 5-летняя выживаемость пациентов с опухолями G1 составляет 76%, G2 — 72%, G3 — 51%, G4 — 35%.
Плоидность ДНК коррелирует с целлюлярной кинетикой почечно-клеточного рака: в диплоидных опухолях отмечается более низкий уровень фракции клеток, находящихся в S-фазе, а также более продолжительное время удвоения опухоли, чем в анеуплоидных клонах, что ассоциировано с благоприятным прогнозом.
На выживаемость больных раком почки влияет митотический индекс. Выявлено, что при наличии менее 1 фигуры митоза на 10 полей зрения при малом увеличении 10-летняя выживаемость составляет 67%, более 1 — 16%.
Генетические факторы
Как было отмечено выше, современные классификации рака почки учитывают не только морфологические, но и цитогенетические особенности опухоли, обуславливающие различное клиническое течение.
Традиционный (не папиллярный) рак составляет 75% всех эпителиальных опухолей почки и характеризуется наличием делеции хромосомы 3р. Только в опухолях данного типа имеет место мутация гена VHL. Данный тип рака почки имеет более высокий метастатический потенциал и отличается худшей выживаемостью по сравнению с папиллярной и хромофобной формами.
При папиллярной форме рака почки обычно выявляется комбинация трисомий по 7; 17; 3q; 8; 12; 16 и 20 хромосомам, а также утрата Y-хромосомы. Папиллярная карцинома часто бывает двухсторонней и мультифокальной, ассоциирована с лучшей выживаемостью, чем традиционный, но худшей, чем хромофобный тип опухоли.
Для хромофобного рака характерно уменьшение количества хромосом в сочетании с гетерозиготностью по хромосомам 1; 2; 6; 10; 13; 17; 21; X и гипоплоидным содержанием ДНК. Данная форма почечно-клеточного рака имеет низкий метастатический потенциал. Выживаемость больных хромофобными опухолями больше, чем в группе пациентов с папиллярной и традиционной формами рака почки.
Рак собирательных протоков является редкой опухолью, составляющей 1–2% всех случаев почечно-клеточного рака. Рак собирательных протоков является очень агрессивной опухолью с высоким метастатическим потенциалом.
Таким образом, генетические альтерации детерминируют туморогенез и степень злокачественности опухолевого процесса при различных формах почечно-клеточного рака.
Факторы регуляции клеточного цикла
В ряде исследований отмечено прогностическое значение изменений, происходящих в системе регуляции клеточного цикла в процессе развития опухоли. Система регуляции клеточного цикла представлена особыми протеинами (циклины, циклин-зависимые киназы (CDK), CDK-ингибиторы и специфические фосфорилированные и нефосфорилированные субстраты). Белки-регуляторы клеточного цикла являются продуктами экспрессии протоонкогенов. Трансформация протоонкогена в онкоген является одной из ключевых аберраций туморогенеза, приводящей к нарушению регуляции клеточного цикла, обуславливающему повреждение механизмов контроля за клеточным ростом, пролиферацией и апоптозом.
Факторы ангиогенеза
Ангиогенез является важнейшим фактором, определяющим прогрессию опухоли и оказывающим существенное влияние на прогноз больных почечно-клеточным раком. Увеличение новообразования более, чем на 1 мм, требует появления новых сосудов. Существенную роль в туморогенезе играет сосудистый эндотелиальный фактор роста — VEGF. В настоящее время проводятся исследования, посвященные изучению прогностической роли других факторов — ФНО-альфа, основного фактора роста фибробластов (bFGF) и ингибиторов ангиогенеза (ангиостатина, ФНО-бета).
Клинические проявления рака почки
Классическая триада симптомов, описываемая ранее при раке почки у 15% больных (боль, макрогематурия и пальпируемая опухоль), в настоящее время встречается редко. В большинстве случаев заболевание протекает бессимптомно.
Клинические проявления возникают в основном на поздних стадиях. Среди местных симптомов наиболее часто отмечаются боль и гематурия. Боли в пояснице и животе возникают при инвазии или компрессии растущей опухолью окружающих структур, а также при почечной колике, обусловленной окклюзией мочеточников сгустками крови. Острая боль может быть следствием кровоизлияния в опухоль или ее разрыва с формированием забрюшинной гематомы. Прощупываемая опухоль — третий местный симптом рака почки, который бывает положительным у 12–15% пациентов на момент установления диагноза. Появление варикоцеле отмечают до 3,3% больных.
Артериальная гипертензия — непостоянный симптом (вызываемый сдавлением сегментарных артерий, окклюзией мочеточника, метастазами в головной мозг, формированием артериовенозных шунтов или повышенной секрецией опухолью ренина) наблюдается у 15% больных раком почки.
Синдром сдавления нижней полой вены (отеки ног, варикоцеле, расширение подкожных вен живота, тромбоз глубоких вен нижних конечностей, протеинурия) развивается у 50% больных при опухолевом тромбозе НПВ или при компрессии НПВ опухолью и увеличенными лимфатическими узлами.
Рак почки характеризуется большим разнообразием паранеопластических синдромов, наблюдаемых более, чем у половины больных. Одной из функций нормальной почечной паренхимы является продукция различных биологически активных веществ (ЭП, ренин, ПГ, простациклины, тромбоксаны, образование активной формы витамина D). Наличие опухоли может приводить к повышенной секреции вышеуказанных субстанций либо к продукции других гормонов, таких как паратгормон, инсулин, глюкагон, человеческий ХГ. В результате у пациентов могут возникать артериальная гипертензия, эритроцитоз, гиперкальциемия, гипертермия и др. Появление вышеуказанных симптомов может быть единственным проявлением заболевания и должно настораживать врача в отношении возможного опухолевого поражения почек. После радикального удаления опухоли паранеопластические проявления, как правило, исчезают, но могут возникнуть вновь при развитии местного рецидива или отдаленных метастазов. Таким образом, клинические проявления паранеопластического синдрома могут быть использованы для мониторинга заболевания.
Редкой формой паранеопластического синдрома является амилоидоз (1,7%). Сохраняющийся после нефрэктомии амилоидоз является крайне неблагоприятным фактором прогноза.
До сих пор непонятным остается возникновение в ряде случаев печеночной недостаточности при отсутствии метастатического поражения печени. При этом у больных раком почки отмечается гипоальбуминемия, повышение щелочной фосфатазы (ЩФ), лейкопения, лихорадка, возможно появление очагов некроза печеночной паренхимы (синдром Штафера). Восстановление функции печени после нефрэктомии является благоприятным прогностическим признаком.
Особенное место в клинической картине рака почки занимают симптомы, обусловленные метастазированием, т.к. более 25% больных на момент установления диагноза уже имеют отдаленные метастазы. Первыми проявлениями поражения легких являются кашель и кровохарканье. Костные метастазы могут манифестировать болевым синдромом, развитием патологических переломов, компрессией спинного мозга, появлением пальпируемой опухоли. Поражение головного мозга сопровождается быстрым появлением и нарастанием неврологической симптоматики. Множественные метастазы в печень могут проявляться желтухой.
Общие симптомы: анемия, высокая СОЭ, потеря аппетита, похудание, слабость — являются признаками поздних стадий заболевания.
Диагностика и стадирование рака почки
В результате появления современных неинвазивных диагностических методов, таких как УЗКТ, РКТ, МРТ, алгоритм обследования больных раком почки изменился. Наиболее часто опухоль почки обнаруживают при УЗКТ, выполняемой по поводу другого заболевания. Несмотря на высокую диагностическую ценность УЗКТ, последняя всегда должна быть дополнена РКТ, которая является основным методом диагностики объемных образований почки (рис. 6).
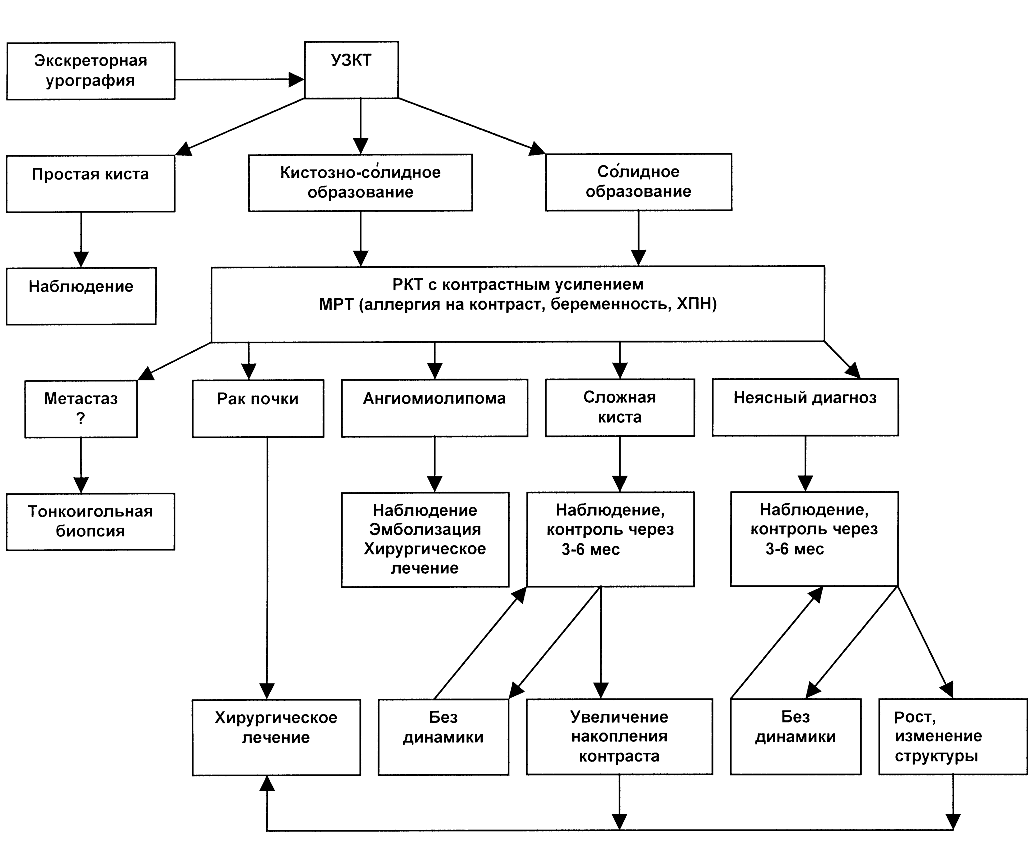
Рисунок 6. Алгоритм диагностики опухолей почки
Ангиография и выделительная урография уже не являются рутинными методами обследования больных локальным раком почки и не используются часто. В комплекс обязательных обследований для диагностики и стадирования входят РКТ, УЗКТ, рентгенография легких. Радиоизотопное сканирование скелета показано при наличии болей в костях и повышении ЩФ (рис. 7).

Рисунок 7. Алгоритм стадирования рака почки
МРТ выполняется больным с аллергией на йодсодержащие контрастные вещества, хронической почечной недостаточностью, опухолевым тромбозом НПВ, а также для подтверждения наличия костных метастазов. Радионуклидная ренография выполняется для оценки функционального состояния пораженной и здоровой почек, что может иметь большое значение при решении вопроса о тактике лечения.
Экскреторная урография
Процедура ранее традиционно применялась для выявления опухолей почек и оценки функции контралатеральной почки. Характерными признаками объемного образования считаются:
— увеличение размеров;
— деформация контуров;
— наличие кальцификатов;
— деформация чашечно-лоханочной системы;
— “ампутация” одной или нескольких чашечек;
— медиализация мочеточника.
Если диагноз опухоли почки был установлен при УЗКТ или РКТ, экскреторная урография не дает дополнительной информации для стадирования. Однако процедура показана больным с макрогематурией для проведения дифференциального диагноза с папиллярными образованиями верхних мочевыводящих путей.
УЗКТ, УЗКТ почек с использованием 3,5 и 5-MHz линейных датчиков
Методика позволяет не только диагностировать объемное образование почки, но и провести дифференциальный диагноз между простой кистой, комплексной кистой и сóлидной опухолью. Другими достоинствами метода являются его низкая стоимость, отсутствие побочных эффектов и возможность использования в скрининговых программах, целесообразность которых пока не доказана. Недостатками УЗКТ являются зависимость результатов от квалификации врача, недостаточно хорошая визуализация у тучных больных и при большом скоплении газа в кишечнике. Точность УЗКТ в выявлении малых (<3 см) опухолей почки составляет 79% по сравнению с 67% при использовании экскреторной урографии. Дифференциальный диагноз между опухолью менее 3 см в диаметре и ангиомиолипомой невозможен в 32% случаев. Использование Доплеровского датчика позволяет определить гиперваскуляризацию, более характерную для злокачественной опухоли, однако данный критерий не является надежным, т.к. до 20% раков почки гипо— или аваскулярны. Бесспорными достоинствами метода являются: возможность интраоперационной диагностики распространенности опухоли при выполнении резекции почки, определения протяженности опухолевого тромбоза НПВ, оценки распространенности поражения печени (рис. 8).

Рисунок 8. Ультразвуковая томограмма больного с внутрипредсердным опухолевым тромбом. Стрелки указывают на тромб
РКТ
В настоящее время является основным методом визуализации объемных образований почки. Точность РКТ в диагностике рака почки достигает 95%. РКТ довольно четко выявляет наличие венозной инвазии. Обычно рак почки визуализируется как мягкотканный узел, деформирующий корковый слой и проникающий в околопочечное пространство или полость лоханки. Контуры узла могут быть как четкими, ровными, так и нечеткими, волнистыми или бугристыми. В зависимости от степени васкуляризации опухоли ее внутренняя структура может быть различной: повышенной или пониженной плотности.
Как крупные, так и небольшие опухоли (1,5–2,0 см в диаметре) могут иметь некротические зоны и подвергаться кистозной трансформации, что обычно отчетливо отображается при РКТ. Внутренняя структура таких кистозных образований чаще всего неоднородна. Капсула подобных “кист” неравномерно утолщена, внутри нее или по ее поверхности могут определяться кальцинаты. Следует отметить, что при МРТ кальцинаты не визуализируются. Выявление кальцинатов в капсуле кистозных образований почек является настораживающим симптомом, часто свидетельствующим о наличии опухолевого процесса.
В/в контрастирование, несомненно, повышает диагностическую ценность РКТ в случаях, когда характер выявляемых образований или причина деформации почки не ясны. Если обнаруживаемое образование имеет иную степень контрастирования, чем смежная, внешне не измененная паренхима почки, это следует расценивать как признак опухолевого процесса.
Дифференциальная диагностика доброкачественных и злокачественных опухолей обычно невозможна, за исключением почечной ангиомиолипомы, патогномоничным признаком которой является наличие жировых включений.
Увеличение размеров, дефекты заполнения почечной вены указывают на ее вовлечение в опухолевый процесс. Одновременное контрастное усиление опухоли и крови в НПВ ограничивает использование РКТ для выявления венозной инвазии. Общая точность РКТ в диагностике опухолевого тромбоза составляет от 68 до 95% (рис. 9).
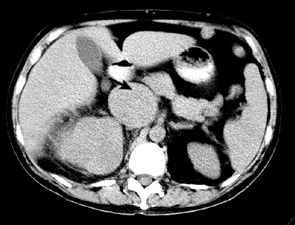
Рисунок 9. КТ больного раком правой почки с опухолевым тромбозом НПВ. Стрелка указывает на резко расширенную НПВ
МРТ
МРТ занимает важное место в диагностике объемных образований почек. Особенно это касается обследования больных с выраженным нарушением почечной функции, аллергическими реакциями на йодсодержащие контрастные растворы, противопоказаниями к ионизирующему излучению. Возможность получения многопланового изображения в различных плоскостях имеет большое значение для определения происхождения первичной опухоли, когда данные РКТ неоднозначны. Несмотря на высокую разрешающую способность, возможность многоплановой визуализации и оценки васкуляризации без контрастного усиления, применение МРТ в выявлении и диагностике малых опухолей почек ограничено из-за близкой интенсивности сигнала нормальной почечной паренхимы и рака почки в обоих Т1 и Т2 режимах. Тем не менее при использовании различных режимов точность МРТ в выявлении опухолей почки не уступает РКТ. Бесспорным достоинством МРТ является возможность хорошей визуализации протяженных трубчатых структур, таких как НПВ, что имеет огромное значение у больных с опухолевым тромбозом НПВ. Даже при полной окклюзии НПВ возможна четкая визуализация опухолевого тромба и точное определение его протяженности без применения контрастирования (рис. 10).

Рисунок 10. МРТ больного с опухолевым тромбом, достигающим правого предсердия. Стрелкой показана верхняя граница тромба
На сегодняшний день МРТ является методом выбора в диагностике опухолевого тромба и определения его верхней границы. Противопоказаниями к проведению МРТ являются клаустрофобия, наличие у больного пейсмекера, металлических протезов, хирургических металлических скрепок. Дополнительным ограничением является высокая стоимость метода.
АГ
АГ, ранее являвшаяся ведущим методом диагностики опухолей почек, в настоящее время выполняется только в случаях, когда требуется точная информация о количестве почечных артерий, сосудистой архитектонике почки, а также при подозрении на заинтересованность магистральных сосудов. Показаниями к АГ являются:
- Планируемая резекция почки.
- Опухоль почки больших размеров.
- Опухолевый тромбоз НПВ (рис. 11).
- Планируемая эмболизация почечной артерии.
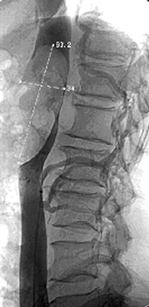
Рисунок 11. Кавограмма больного с опухолевым тромбом, достигающим диафрагмы
Наиболее важные лабораторные параметры у больных раком почки включают определение гемоглобина и СОЭ (прогностические факторы), креатинина (функциональное состояние почек), ЩФ (метастазы в печень, кости), сывороточного кальция (гиперкальциемия).
Хирургическое лечение локализованного рака почки
Хирургический подход и по сей день остается единственно эффективным в лечении рака почки. Роль хирургии за последние годы значительно изменилась по отношению как к локализованным формам, так и к диссеминированным. С одной стороны, значительно возросли показания к резекции почки в начальных стадиях болезни, с другой — в связи с появлением схем адъювантной иммунотерапии — увеличилась роль хирургии в лечении больных с метастазами и местнораспространенными формами опухолевого процесса.
Основной метод лечения рака почки — радикальная нефрэктомия, которая получила всеобщее признание после того, как в 1963 г. Robson опубликовал сравнительно хорошие результаты хирургического лечения. Принципы выполнения радикальной нефрэктомии мало изменились и включают:
— раннюю перевязку почечной артерии и вены;
— удаление почки вне фасции Герота вместе с окружающей паранефральной клетчаткой;
— удаление ипсилатерального надпочечника;
— выполнение регионарной лимфаденэктомии.
Наиболее важным аспектом является удаление почки вне фасции Герота, т.к. инвазия последней отмечается в 25% случаев. Современные исследования показали, что рутинное удаление надпочечника не всегда целесообразно, за исключением случаев, когда опухоль находится в верхнем полюсе или имеется субтотальное поражение почки. Несмотря на то, что лимфаденэктомия обеспечивает более точное стадирование, ее лечебная значимость остается спорной.
Показания к нефрэктомии
1. Радикальная нефрэктомия остается методом выбора в лечении локальных форм рака почки. Роль резекции почки при здоровой контралатеральной почке до конца не определена. Большинство исследователей склоняются к правомочности резекции при размерах опухоли не более 3–5 см.
2. Радикальная нефрэктомия показана больным раком почки с опухолевой инвазией почечной и нижней полой вены.
3. Радикальная нефрэктомия выполняется пациентам с солитарными метастазами в сочетании с одномоментной или последовательной резекцией последних.
4. Паллиативная нефрэктомия показана больным диссеминированным раком почки для уменьшения интоксикации, снижения интенсивности болевого синдрома, купирования профузной макрогематурии, а также пациентам, получающим лечение модификаторами биологического ответа.
При выполнении нефрэктомии по поводу рака почки предпочтение должно отдаваться трансперитонеальным доступам, среди которых наиболее универсальным является срединная лапаротомия. При больших опухолях верхнего полюса и планируемой резекции печени удобными являются односторонний или двухсторонний (Шеврона) подреберный доступ. В ряде случаев возможно применение торакоабдоминального доступа. Главными требованиями при любом доступе остаются быстрый выход на сосудистую ножку и возможность моноблочного экстрафасциального удаления почки с паранефральной клетчаткой.
Лимфаденэктомия при раке почки
Локализация лимфогенных метастазов
Распределение лимфогенных метастазов определяется особенностями лимфооттока. При наличии опухоли правой почки поражаются ретрокавальные, аортокавальные, латерокавальные и прекавальные лимфоузлы. Перекрестное метастазирование отмечается редко и практически всегда сочетается с наличием гомолатеральных лимфогенных метастазов.
Метастазы опухолей левой почки преимущественно локализуются в парааортальных лимфоузлах, поражение аортокавальных и контралатеральных лимфатических узлов отмечается редко. Иногда при отсутствии метастазов в регионарных лимфоузлах выявляется поражение отдаленных лимфоузлов.
Границы лимфаденэктомии
Лимфаденэктомия при раке почки подразумевает удаление всей жировой клетчатки с лимфатическими узлами, окружающей ипсилатеральные магистральные сосуды, от уровня ножек диафрагмы непосредственно ниже уровня отхождения верхней брыжеечной артерии, до бифуркации аорты и НПВ (рис. 12).
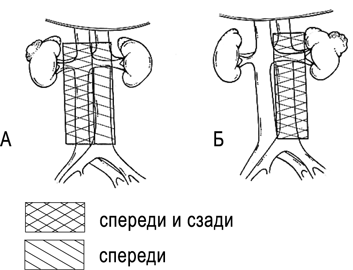
Рисунок 12. Границы расширенной лимфаденэктомии при раке правой (A) и левой (Б) почек
Клиническое значение лимфаденэктомии
Наличие метастазов рака почки в лимфатические узлы является одним из наиболее значимых неблагоприятных факторов прогноза. Появление регионарных метастазов снижает выживаемость больных до 5–30%. Теоретически удаление пораженных лимфатических узлов может улучшить результаты хирургического лечения.
Аляев Ю.Г. (1989) показал четкую корреляцию между стадией Т и наличием метастазов в лимфатических узлах. В связи с улучшением ранней диагностики рака почки частота обнаружения метастазов в неизмененных лимфоузлах уменьшилась с 30%, в наблюдениях времен Робсона, до 3,3%. Следовательно, клиническая значимость лимфодиссекции при раке почки значительно уменьшилась, по крайне мере, эпидемиологически. К сожалению, критериев отбора пациентов, которым показана лимфодиссекция, не существует. Основными аргументами в пользу выполнения лимфаденэктомии остаются точное стадирование и уменьшение частоты местных рецидивов. Для ответа на вопрос, улучшает ли расширенная лимфаденэктомия выживаемость больных раком почки, требуется завершение больших рандомизированных исследований (протокол EORTC № 30881).
Хирургическое лечение рака почки с опухолевым тромбозом почечной и нижней полой вены
Термин “венозная инвазия” означает распространение опухоли по просвету сосудов (продолженный рост) без обязательного прорастания сосудистой стенки. Синонимом понятия “опухолевая инвазия” является термин “опухолевый тромбоз”. Рак почки имеет тенденцию к формированию опухолевых тромбов с распространением последних по почечной и НПВ вплоть до правого предсердия. Венозная инвазия встречается у 4–10% больных, у 60% которых тромб распространяется выше устьев печеночных вен.
Опухолевый тромб чаще исходит из правой почки, что, возможно, связано с меньшей длиной правой почечной вены. Данные дооперационного обследования могут указывать на ретроградное распространение тромба по НПВ. Как правило, эта часть тромба представлена свернувшимися кровяными сгустками, а не опухолью. Опухолевый тромб может распространяться не только по почечной и НПВ, а также по печеночным, надпочечниковым и гонадным венам.
В зависимости от протяженности и отношения к печеночным венам выделяют 4 вида опухолевых тромбов НПВ:
— периренальные;
— субпеченочные;
— внутрипеченочные (ретропеченочные);
— надпеченочные.
Первые три вида относят к группе поддиафрагмальных тромбов. Надпеченочные, или наддиафрагмальные, тромбы подразделяют на внутриперикардиальные и внутрипредсердные. Уровень распространения тромба является важным фактором при выборе метода хирургического лечения.
Основным отличием тромбэктомии от просто радикальной нефрэктомии является необходимость мобилизации, контроля и резекции НПВ. Удаление тромба при его распространении на правое предсердие особенно опасно, и при некоторых видах тромбоза требуется кардиопульмональное шунтирование, гипотермия с остановкой кровообращения.
У больных без отдаленных метастазов радикальная нефрэктомия с тромбэктомией обеспечивает 5-летнюю выживаемость от 47 до 64%. Наличие метастазов в лимфатических узлах и отдаленных метастазов значительно ухудшают выживаемость, в то время как уровень распространения опухолевого тромба достоверно не влияет на прогноз. Следовательно, активный хирургический подход к больным с опухолевым тромбозом НПВ является эффективным методом лечения, а радикальное удаление тромба любой протяженности дает шанс на выздоровление большинству больных.
Осложнения радикальной нефрэктомии
Послеоперационные осложнения отмечаются у 2% больных.
Неспецифические осложнения
Включают острый инфаркт миокарда, сердечную недостаточность, нарушения мозгового кровообращения, тромбоэмболию ветвей легочной артерии, пневмонию, ателектазы, тромбофлебиты. Частота осложнений может быть значительно уменьшена при соблюдении определенных правил предоперационной подготовки, профилактике гипотензии во время операции, проведении адекватной заместительной инфузионной терапии, дыхательной гимнастики, ранней активазации, бинтовании нижних конечностей.
Специфические осложнения
Редким послеоперационным осложнением является формирование свища поджелудочной железы — как следствие ее повреждения во время операции. Послеоперационный период обычно сопровождается клиникой панкреатита и выделением сока поджелудочной железы по страховому дренажу. Отделяемое дренажа должно быть исследовано на содержание панкреатической амилазы. При неадекватном дренировании возможно скопление жидкости в забрюшинном пространстве с формированием панкреатической псевдокисты или абсцесса, которые визуализируются на РКТ и УЗКТ. Большинство фистул при хорошем дренировании закрываются самостоятельно.
Парез кишечника после нефрэктомии, как правило, разрешается на 3–4 сутки. Прием жидкости per os следует начинать после активизации перистальтики и самостоятельного отхождения газов. В редких случаях требуется установка назогастрального зонда.
Вторичное кровотечение сопровождается клиникой геморрагического шока, болью и пальпируемым вздутием живота, выделением крови по дренажу. Источником могут служить сосуды почечной ножки, надпочечника, брыжейки или незамеченные повреждения селезенки и печени. В подавляющем большинстве случаев для остановки кровотечения требуется релапаротомия.
Острая почечная недостаточность может развиться у больных после нефрэктомии, особенно после операций по удалению опухолевых тромбов, требующих пережатия контралатеральной почечной вены. Как правило, функция оставшейся почки восстанавливается, однако часто требуется перевод больного на временный гемодиализ.
Органосохраняющее лечение при раке почки
Показания
Резекция почки является методом выбора в случае двухстороннего опухолевого поражения или при единственной функционирующей почке. Показания к резекции могут быть расширены при наличии сопутствующей патологии (сахарный диабет) и патологических процессов в контралатеральной почке (мочекаменная болезнь, хронический пиелонефрит, нефросклероз). В редких случаях резекция почки выполняется при переходно-клеточном раке собирательной системы и при опухоли Вильмса, когда крайне необходимо сохранение функционирующей паренхимы.
В последние годы показания к органосохраняющему лечению еще более расширились в связи с ранней выявляемостью опухолей почки, когда их размеры не превышают 3–5 см. Предварительные результаты исследований, сравнивающих резекцию при здоровой контралатеральной почке и нефрэктомию, говорят о правомочности органосохраняющего подхода при небольших размерах опухоли и локализации, удобной для резекции.
Общие положения
Варианты органосохраняющего хирургического лечения при раке почки:
- Энуклеация опухоли.
- Клиновидная резекция почки.
- Резекция полюса почки.
- Геминефрэктомия.
- Экстракорпоральная резекция с аутотрансплантацией почки.
При любом виде резекции необходимо соблюдение следующих общих принципов:
— контроль за почечными сосудами;
— минимальное время ишемии;
— удаление опухоли в пределах здоровых тканей;
— герметичное ушивание вскрытой собирательной системы почки;
— тщательный гемостаз;
— укрывание дефекта почечной паренхимы мышечно-фасциальным, жировым или брюшинным лоскутом.
При планировании резекции почки большое значение имеет выполнение селективной почечной артериографии, за исключением случаев небольших опухолей, расположенных в области одного из полюсов почки. Знание сосудистой архитектоники почки, расположения главной почечной артерии и ее ветвей позволяют удалить опухоль с наименьшей кровопотерей и с сохранением максимального объема функционирующей паренхимы.
Осложнения
После резекции почки в основном связаны с техническими особенностями проведения хирургического вмешательства — мобилизацией почечных сосудов, длительностью их пережатия, объемом удаляемой почечной паренхимы, реконструкцией чашечно-лоханочной системы. Риск развития осложнений при периферически расположенных опухолях малого размера, как правило, незначителен. Наиболее частыми осложнениями являются:
— вторичное кровотечение;
— формирование мочевого свища;
— стриктура мочеточника, плохая функция резецированной почки;
— инфекционные осложнения.
Профилактикой мочевых свищей является тщательное ушивание вскрытой чашечно-лоханочной системы. Большинство свищей закрываются спонтанно, однако в некоторых случаях требуется установка мочеточникового стента. Инфекционные осложнения после резекции почки обычно разрешаются самостоятельно при адекватном дренировании и отсутствии мочевой инфекции. Одновременное выполнение нефрэктомии и резекции контралатеральной почки или симультанного органосохраняющего лечения с обеих сторон опасны в отношении развития острой почечной недостаточности (ОПН). Исключениями являются периферически расположенные опухоли малого размера, при которых риск развития осложнений, как правило, незначителен, что оправдывает в некоторых случаях выполнение одномоментных операций.
Хирургическое лечение солитарных и единичных метастазов рака почки
Солитарные метастазы рака почки или метастатическое поражение только одного органа имеет место только в 3–11% случаев. Частота появления солитарных метастазов в различных органах отличается от распределения множественных. Наиболее часто поражаются легкие (30%), кости (15%), лимфатические узлы (14%), ЦНС (8%), печень (5%), надпочечник (2,7%), контралатеральная почка (1,4%), кожа (1,4%).
Целесообразность хирургического подхода к больным метастатическим раком почки до недавнего времени ставилась под сомнение, однако современные исследования показали: удаление солитарных и единичных метастазов существенно улучшает выживаемость и, что не менее важно, качество жизни больного. В первую очередь, это относится к пациентам с поражениями скелета и головного мозга. Резекция костных поражений выполняется для коррекции и предотвращения патологических переломов, сохранения двигательной активности, устранения болей. Активный хирургический подход более показан молодым пациентам с метастазами в трубчатых костях, при наличии патологических переломов или при угрозе их появления. Объем вмешательства варьирует и может заключаться в кюретаже со стабилизацией, резекции кости, резекции кости/сустава с эндопротезированием или просто стабилизации при планировании в дальнейшем проведения лучевой терапии. Одним из наиболее трагичных осложнений метастазов в позвоночник является развитие компрессии спинного мозга. Как первоочередной метод лечения должна рассматриваться хирургическая декомпрессия с последующим лучевым воздействием. 5— и 10-летняя выживаемость после резекции солитарных костных метастазов составляет 35 и 17% соответственно.
Метастазы в головной мозг приводят к развитию неврологической симптоматики в 98% случаев. Удаление последних сопровождается практически полным симптоматическим выздоровлением и, соответственно, крайне значимым улучшением качества жизни. Радикальное хирургическое удаление метастазов из головного мозга увеличивает среднюю продолжительность жизни с 1 до 24 мес. При этом 12% больных живут более 5 лет после операции.
При наличии бессимптомных единичных или солитарных метастазов в легкие, печень, надпочечник, контралатеральную почку хирургическое лечение показано при возможности полного удаления первичной опухоли, отсутствии других локализаций и проявлений метастатической болезни, ограниченном и доступном для полного хирургического удаления количества поражений. У правильно отобранной группы больных хирургическая резекция метастазов позволяет продлить жизнь до 5 и более лет. Прогностически благоприятными являются:
— локализация метастазов только в одном органе;
— возможность полного удаления впервые возникших поражений;
— безрецидивный период после нефрэктомии более 24 мес;
— солитарный характер поражений.
Таким образом, в настоящее время появилась необходимость подразделять больных с метастазами рака почки на подгруппы в зависимости от наличия или отсутствия определенных прогностических факторов. Кроме того, учитывая паллиативную направленность большинства операций по удалению метастазов рака почки, большое значение приобретает прогнозирование ожидаемой продолжительности жизни и степени возможного паллиативного эффекта от планируемого хирургического лечения. Это, в свою очередь, позволит оптимизировать проводимую терапию. С учетом данных прогностических факторов бóльший процент больных могут быть переведены в группу агрессивного хирургического лечения — в комбинации с иммунотерапией или без нее.
Хирургическое лечение местных рецидивов после нефрэктомии
Местные рецидивы в ложе удаленной почки встречаются редко, в 2–14% случаев. Причины их появления — нерадикальный характер нефрэктомии и наличие метастазов в регионарных лимфатических узлах. Наиболее эффективным методом лечения, учитывая резистентность рака почки к химио— и лучевой терапии, остается хирургическое лечение. Преимущества комбинированного лечения, включающего различные варианты до-, интра— и послеоперационной лучевой терапии спорны.
Местные рецидивы в ложе удаленной почки биологически ведут себя так же, как метастазы, и несут в себе риск местного прогрессирования и генерализации процесса. По этой причине сочетание хирургического метода с терапией модификаторами биологического ответа теоретически может улучшить результаты лечения.
Агрессивный хирургический подход к больным с местным рецидивом часто требует резекции соседних органов, и объем операции, как правило, не ограничивается удалением рецидива, что обуславливает высокий процент послеоперационных осложнений. Тем не менее удовлетворительные показатели 5-летней выживаемости (37,7%) оправдывают проведение расширенных оперативных вмешательств у отобранной группы больных.
Лекарственное лечение метастатического рака почки
Химиотерапия
Рак почки является опухолью, не чувствительной к системной химиотерапии. Биологическим основанием этому служит гиперэкспрессия гена множественной лекарственной устойчивости MDR–1 — мембранного гликопротеина Р–170, обеспечивающего выведение цитотоксических агентов и их метаболитов из опухолевой клетки.
В исследованиях, посвященных изучению эффективности различных химиопрепаратов, применявшихся как в монорежиме, так и в комбинации с другими цитотоксическими агентами, получены более чем скромные результаты: общая эффективность лечения не превышала 4–6%.
Обобщив результаты II фазы 83 исследований, проведенных с 1983 по 1993 г., Yagoda A. (1995) оценил эффективность более 30 цитостатических агентов, применявшихся у 4093 больных диссеминированным почечно-клеточным раком. При этом выявлено, что средняя частота достижения объективного ответа на лечение препаратами растительного происхождения (винбластином, этопозидом, виндезином, винорелбином, паклитакселом, доцетакселом) не превышала 3% (от 0 до 6,4%). Средняя эффективность антрациклинов составила 2,9%, алкилирующих агентов — 2,6%, пиримидинов — 12%. Таким образом, все предлагавшиеся до сегодняшнего дня схемы химиотерапии продемонстрировали свою несостоятельность при диссеминированном раке почки.
Гормональная терапия
Обнаружение эстрогенных рецепторов в почечно-клеточных опухолях явилось основанием для проведения исследований, посвященных изучению эффективности гормональных препаратов при диссеминированном раке почки. Вопреки ожиданиям применение прогестинов (медроксипрогестерон), антиэстрогенов (тамоксифен) и антиандрогенов (флутамид) не привело к улучшению результатов лечения. По данным ряда авторов, средняя эффективность лечения тамоксифеном составляет 6,9% (от 5 до 12%), и большинство исследователей считают гормональную терапию рака почки практически неэффективной.
Иммунотерапия
Факты спонтанной регрессии метастазов, а также обнаружение в периферической крови цитолитических Т-лимфоцитов послужили теоретической основой того, чтобы расценить почечно-клеточный рак как иммуногенную опухоль, лечение которой может быть основано на модуляции иммунитета.
Иммунотерапия в настоящее время играет ведущую роль в лечении распространенных форм рака почки. Выделяют следующие иммунотерапевтические подходы:
1) неспецифическая иммунотерапия с использованием цитокинов (интерфероны, интерлейкины) и других модификаторов биологических реакций;
2) адоптивная клеточная иммунотерапия с применением аутолимфоцитов (ALT), лимфокин-активированных киллеров (ЛАК), туморинфильтрирующих лимфоцитов (TIL);
3) специфическая иммунотерапия (вакцинотерапия, терапия МКА);
4) генная терапия;
5) миниаллогенная трансплантация стволовых клеток.
Интерфероны в режиме монотерапии
Интерфероны (ИФ) имеют множество биологических свойств, в т.ч. способность повышать иммуногенность опухоли, ингибировать ангиогенез, индуцировать иммунный ответ как прямым воздействием, так и посредством запуска цитокинного каскада. Они обладают непосредственным цитотоксическим действием на опухолевые клетки.
В настоящее время ИФ-бета и ИФ-гамма не входят в стандартные схемы лечения диссеминированного рака почки. Интерферон альфа является одним из препаратов выбора в терапии данной категории пациентов.
Несмотря на достаточный опыт применения интерферона альфа при диссеминированном раке почки, оптимальные дозы и режимы его введения еще не определены. Ряд исследований показал, что применение разовых доз интерферона альфа менее 3 млн МЕ снижает эффективность терапии, а увеличение разовой дозы данного цитокина более 10 млн МЕ не дает никаких преимуществ.
В/м и п/к пути введения препарата предпочтительнее в/в инфузии, в связи с тем, что терапевтическая концентрация интерферона альфа в организме поддерживается более длительное время.
Побочные эффекты, отмечаемые при применении интерферона альфа, см. в описаниях препаратов и действующих веществ в главе “Лекарственные средства, применяемые в онкологической практике”.
Средняя частота полных и частичных ремиссий при использовании интерферона альфа составляет 2,2% (0–2,5%) и 11,2% (0–25%) соответственно. По данным метаанализа, проведенного Savage P.D. (1995), средняя эффективность интерферона альфа равна 15%.
Основные представители интерферонов:
— рекомбинантный интерферон альфа–2а;
— рекомбинантный интерферон альфа–2б;
— интерферон альфа из нормальных человеческих лейкоцитов.
Дозы интерферонов (альфа, альфа–2а и альфа–2б) варьируют от 3 до 18 млн МЕ/сут п/к или в/м.
<
Наиболее частые режимы введения
По 3–6 млн МЕ ежедневно 2 нед или 3 раза в неделю 3–4 нед.
Начиная со 2 недели, возможно увеличение разовой дозы до 9–18 млн МЕ/сут.
Интерлейкин–2 человека рекомбинантный в монорежиме
ИЛ–2 — цитокин, продуцируемый Т-лимфоцитами. ИЛ–2, связываясь с рецепторами мембран Т-, В— лимфоцитов и моноцитов, регулирует многие иммунные процессы, в т.ч. стимуляцию Т-лимфоцитов, ЛАК, индукцию секреции ИФ и других лимфокинов, активацию макрофагов и NK-клеточной цитотоксичности.
Широкое применение интерлейкина–2 человека рекомбинантного начато после публикации результатов двух больших клинических исследований. В работе Fisher (1997) 255 пациентов получали интерлейкин–2 человека рекомбинантный в дозе 600000–720000 МЕ/кг 15-минутными в/в инфузиями каждые 8 ч в течение 5 дней; аналогичный цикл повторялся через 5–9 дней; интервал между курсами — 1,5–2,5 мес. Общая эффективность составила 15% при частоте полных и частичных ремиссий 7% и 8% соответственно. Rosenberg (1998) вводил интерлейкин–2 человека рекомбинантный по аналогичной схеме 227 больным. Полная и частичная регрессия опухоли достигнуты в 9,3% и 9,7% случаев соответственно. При этом у 80% пациентов, достигших полной ремиссии, не отмечено прогрессирования заболевания в течение 3 лет.
Применение высоких доз интерлейкина–2 человека рекомбинантного при болюсном или длительном в/в введении ассоциировано с выраженной токсичностью. Гипотензия отмечается у 57–74%, диспноэ — у 10–17%, развитие почечной недостаточности — у 10–14%, печеночной недостаточности — у 19–21%, ишемия миокарда, миокардит — у 28–32%, аритмия — у 5–14%, нейротоксичность — у 28–32%, инфекционные осложнения — у 3–6%, тромбоцитопения — у 21–29% больных. Летальность достигает 1–4%.
Токсичность терапии ИЛ–2 снижается при п/к пути введения цитокина. По данным 9 исследований, включивших 1714 пациентов, средняя эффективность ИЛ–2 при п/к введении составляет 18% (от 13,5 до 18,5%), средняя продолжительность лечебного эффекта — 9–31 мес.
Интерлейкин–2 человека рекомбинантный используется в дозах от 60000 до 600000 МЕ/кг каждые 8 ч в виде в/в инфузии, болюсного в/в введения, п/к введения.
Частота побочных эффектов интерлейкина–2 человека рекомбинантного уменьшается при редукции дозы препарата. Ряд работ показал одинаковую частоту достижения объективных ответов при использовании высоких (720000 МЕ/кг) и низких (72000 МЕ/кг) доз интерлейкина–2 человека рекомбинантного, при значительно меньшей токсичности во второй группе.
У больных раком почки с легочными и медиастинальными метастазами возможно применение ингаляционных форм интерлейкина–2 человека рекомбинантного. Аэрозоль позволяет создать высокие концентрации препарата в легких, тогда как системное действие цитокина практически не проявляется. По данным Huland (1997), частота объективных ответов при ингаляционном пути введения интерлейкина–2 человека рекомбинантного достигает 15,2%, средняя продолжительность лечебного эффекта — 15,5 мес. Для оценки клинического значения аэрозольных форм интерлейкина–2 человека рекомбинантного необходимо проведение дальнейших рандомизированных исследований.
К сожалению, на сегодняшний день не существует надежных критериев, позволяющих прогнозировать эффективность неспецифической иммунотерапии, которая в настоящее время является одним из самых распространенных и доступных методов лечения этого заболевания. Большая частота объективных ответов отмечается среди пациентов, имеющих хороший соматический статус, при локализации метастазов в легких, лимфатических узлах, метастатическом поражении одного органа, выполненной нефрэктомии, метахронных метастазах. Костные метастазы и метастазы в головной мозг являются общепринятыми неблагоприятными прогностическими факторами для проведения иммунотерапии.
Интерлейкин–2 человека рекомбинантный в сочетании с интерферонами
В доклинических испытаниях продемонстрирован синергизм противоопухолевого действия интерлейкина–2 человека рекомбинантного и интерферона альфа. Однако клинические работы показали отсутствие преимуществ комбинированной терапии.
French Immunotherapy Group рандомизировала 278 пациентов на монотерапию высокими дозами интерлейкина–2 человека рекомбинантного, монотерапию интерфероном альфа и комбинированное лечение интерлейкином–2 человека рекомбинантным и интерфероном альфа. Частота объективных ответов в группах составила 6,5%, 7,5% и 18,6% соответственно (p<0,01). Однако все дополнительные ремиссии среди пациентов, получавших комбинированное лечение, были частичными. Преимуществ выживаемости в данной группе больных не отмечено. Таким образом, рутинное применение комбинации цитокинов при диссеминированном раке почки не оправдано.
Примеры комбинаций:
интерлейкин–2 человека рекомбинантный — по 2 млн ЕД/м2 в сутки в/в инфузия 120 ч 1–5 дни,
интерферон альфа — по 4 млн ЕД/м2 п/к ежедневно.
Интерлейкин–2 человека рекомбинантный и химиотерапия
Синергизм цитокинов и цитостатических препаратов изучается с 1980-х гг. В исследовании Atzpodien J. (1993), в котором применялась комбинация п/к инъекций интерлейкина–2 человека рекомбинантного, интерферона альфа и фторурацила, частота объективных ответов на лечение достигла 48,6%. Однако в дальнейшем попытки воспроизвести его результаты не увенчались успехом. По данным Bukowski R.M. (1999), проанализировавшего данные 11 серий наблюдений, средняя эффективность этой схемы иммунохимиотерапии составляет 25,3% (от 1,8 до 39,0%). Таким образом, значение данной комбинации в лечении метастатического рака почки неоднозначно. В последнее время активно изучается возможность совместного использования фторурацила и гемцитабина. Попытки улучшить результаты иммунотерапии путем дополнительного введения винбластина, циклофосфамида, доксорубицина не привели к увеличению эффективности.
Примеры комбинаций:
интерлейкин–2 человека рекомбинантный — по 2 млн ЕД/м2/сут, в/в инфузия 120 ч, 1–5 дни,
фторурацил — по 600 мг/м2, в/в инфузия 120 ч. Циклы повторяются каждые 28 дней.
Адоптивная иммунотерапия
Интерлейкин–2 человека рекомбинантный в сочетании с ЛАК
Способность ИЛ–2 активировать процесс уничтожения опухолевых клеток лимфоцитами послужила теоретической предпосылкой для их использования в клинической практике. С помощью лимфоцитафереза производится выделение лимфоцитов из крови пациентов, получавших интерлейкин–2 человека рекомбинантный, после окончания 1 нед лечения. Лимфоциты активируют ИЛ–2 in vitro, после чего ЛАК вводят больным в течение 2 нед терапии ИЛ–2. Частота объективных ответов на лечение высокими дозами интерлейкина–2 человека рекомбинантного + ЛАК составляет 3–14%, что говорит об отсутствии преимуществ комбинированного лечения.
Интерлейкин–2 человека рекомбинантный и TIL’s
С целью повышения эффективности иммунотерапии при диссеминированном раке почки изучались возможности использования опухоль-инфильтрирующих лимфоцитов (tumor-infiltrating lymphocytes, TILs), выделенных из первичной опухоли, в сочетании с интерлейкином–2 человека рекомбинантным. Рандомизированное исследование, сравнивавшее интерлейкин–2 человека рекомбинантный в монорежиме и интерлейкин–2 человека рекомбинантный в комбинации с CD8 + TILs, не выявило преимуществ терапии с TILs.
Вакцинотерапия и генная терапия
В литературе опубликованы предварительные результаты применения противоопухолевых вакцин при диссеминированном почечно-клеточном раке. В исследовании Repmann R. (1997) адъювантная вакцинотерапия аутологичными иррадиированными опухолевыми клетками привела к увеличению 2-летней выживаемости больных раком почки II стадии с 71 до 96%, III стадии — с 53 до 81%.
В настоящее время изучается возможность использования дендритных клеток в вакцинотерапии больных почечно-клеточным раком. Последние являются “профессиональными” антиген-презентирующими клетками, которые представляют опухолевый антиген в комплексе с молекулой главного комплекса гистосовместимости (МНС) I класса цитотоксическим лимфоцитам и активируют последние благодаря наличию на своей поверхности костимуляторных молекул семейства В–7 (CD80, CD86).
Генетическая модификация противоопухолевых вакцин дает возможность повысить их эффективность. Введение ex vivo в геном опухолевых клеток определенных полинуклеотидных последовательностей позволяет им приобрести способность вырабатывать различные цитокины, что вызывает повышение их иммуногенности. Отмечено, что вакцины, продуцирующие ГМКФ, индуцируют формирование иммунного ответа против слобоиммуногенных опухолей.
Отрабатываются методики интратуморального введения генов, кодирующих синтез ряда цитокинов, in vivo. В настоящее время данные модели изучаются в рамках I фазы клинических исследований.
Миниаллогенная трансплантация стволовых клеток
В течение последних 30 лет аллогенная трансплантация стволовых клеток успешно используется для лечения злокачественных заболеваний крови. Было отмечено, что противоопухолевый эффект ВДХ может поддерживаться пересаживаемыми вместе со стволовыми клетками иммунокомпетентными Т-лимфоцитами донора, вызывающими развитие оРТПХ (в сущности, РТПО). Это послужило основанием для развития одного из наиболее перспективных направлений иммунотерапии сóлидных опухолей, резистентных к другим видам лечения, — АллоТСК с использованием немиелоаблативных методик, позволяющих оказать достаточное для проведения аллогенной трансплантации иммуносупрессивное действие без угнетения собственного кроветворения реципиентами и достижения РТПО. По данным Childs R. (2000), частота объективных ответов у больных диссеминированным раком почки достигает 53%.
Заключение
Почечно-клеточный рак является химио— и гормонорезистентной опухолью. На сегодняшний день стандартом лечения метастатического рака почки является иммунотерапия с использованием интерферона и ИЛ–2 по отдельности или в сочетании друг с другом. Суммарный ответ на иммунотерапию колеблется от 10 до 20%. Появление новых методов иммунотерапии (противоопухолевая вакцинотерапия, генная терапия и миниаллогенная трансплантация с эффектом РТПО) позволяет надеяться на увеличение эффективности комбинированного лечения диссеминированного рака почки.
Лучевая терапия при костных метастазах рака почки
Несмотря на то, что рак почки резистентен к лучевому воздействию, при костных метастазах лучевая терапия используется с паллиативной целью: для уменьшения болей и предотвращения дальнейшей прогрессии, улучшая качество жизни. Большинство радиологов не рекомендуют применять обычный режим фракционирования (РОД 2 Гр). Предпочтительнее использование таких режимов, как 10 фракций х 3 Гр в течение 2 нед или 5 фракций x 4 Гр в течение 1 нед. Анальгезирующий эффект лучевой терапии при СОД от 30 до 40 Гр достигается у 80% больных.
Лучевая терапия при раке почки применяется не только для уменьшения болевого синдрома, но и с целью стабилизации и предотвращения патологических переломов за счет реминерализации костной ткани. В основе паллиативного анальгезирующего эффекта лучевой терапии и рекальцификации лежат разные механизмы. Для достижения рекальцификации показано использование более длительных курсов с более мелким фракционированием и высокими суммарными дозами. Spiro & Springfield (2000) при солитарных метастазах и невозможности оперативного лечения предлагают проводить лучевую терапию СОД 60–66 Гр и РОД 2 Гр 5 дней в неделю. Другие применяемые режимы включают СОД 50 Гр в 20 фракциях и 39 Гр в 13 фракциях. Выбор схемы зависит от ожидаемой продолжительности жизни пациента и локализации поражения. Аналогичные режимы могут быть применены в послеоперационном периоде, хотя доза облучения уменьшается в зависимости от размеров резидуальной опухоли.
Бисфосфонаты
С целью улучшения качества жизни больных раком почки с метастазами в кости в последнее время активно используются препараты группы бисфосфонатов (памидроновая кислота, клодроновая кислота, ибандроновая кислота, золедроновая кислота). Бисфосфонаты являются синтетическими аналогами пирофосфатов, регулирующих процесс минерализации в организме (см. соотв. разд.). При использовании данной группы препаратов нормализация уровня сывороточного кальция и исчезновение симптомов гиперкальциемии (рвота, летаргия, запор, брадикардия, полиурия) отмечаются у 75% пациентов раком почки с костными поражениями.
При ретроспективном анализе подгруппы из 74 больных раком почки с метастазами в кости, включенных в многоцентровое, рандомизированное плацебо-контролируемое исследование, было показано, что золедроновая кислота в дозе 4 мг достоверно уменьшает процент осложнений со стороны костной системы (37% против 74% в группе пациентов, получавших плацебо), определяемых как появление патологического перелома, компрессия спинного мозга, необходимость проведения лучевой терапии или хирургического вмешательства на костях. Золедроновая кислота также достоверно увеличивала время до появления первого осложнения на 6 мес. Риск развития осложнений уменьшался на 61%. Среднее время до начала прогрессии костных поражений у больных, получавших золедроновую кислоту, было достоверно дольше, чем у пациентов, получавших плацебо, и составило 586 и 89 дней соответственно.
Таким образом, золедроновая кислота является высокоэффективным препаратом в лечении костных метастазов рака почки, значительно улучшающим качество жизни больных. Необходимы дальнейшие исследования для оценки возможного влияния золедроновой кислоты на продолжительность жизни.
Литература
Аляев Ю.Г. Расширенные, комбинированные и органосохраняющие операции при раке почке. Дис. на соиск. уч. ст. докт. мед. наук.— М., 1989.
Гарин А.М. и др. Справочник практической химиотерапии опухолей.— М., 1995.— C. 72–73.
Давыдов М.И. и др. ... Хирургическое лечение местно-распространенного и метастатического рака почки.— М., 2002. — C. 15–35.
Давыдов М.И. и др. ...там же.— C. 94–96.
Давыдов М.И. и др. ...там же.— C. 177–260.
Матвеев Б.П. ... Руководство по урологии. Под ред. Н.А. Лопаткина.— М., Медицина, 1998.— С. 199–233.
Пытель Ю.А. и др. ... Хирургия.— 1997.— № 3.— P. 29–35.
Трапезников Н.Н. и др. Заболеваемость злокачественными новообразованиями и смертность от них населения стран СНГ в 1998 г.— М, 1998.
AJCC Cancer staging handbook. Sixth edition TNM classification of malignant tumors.— Springer, NY, Berlin, Heidelberg, 2002.
Atzpodien J. et al. ...Eur. J. Cancer.— 1993.— V. 29a. — P. 56.
Blom J.H.M. et al. ... Eur. Urol.— 1999.— V. 36.— P. 565–569.
Bloom H.J.G. ... Br. J. Cancer.— 1971.— V. 25.— P. 250.
Bretheau D. et al. ...Cancer.— 1995.-V. 76 (12).— P. 2543–2549.
Bugert P. et al. ...Lab. Invest.— 1997.— V. 76.— P. 203–208.
Bukowski R.M. ... Cancer.— 1997.— V. 80.— P. 1198–1220.
Bukowski R.M. et al. ...Genitourinary Oncology. — 2nd ed.— Ed. by N.J. Vogelzang et al. — USA: Lippincott Williams and Wilkins, 1999.— P. 218–234.
Bukowski R.M.et al. ... J. Immunother.— 1991.— V. 10. — P. 432.
Campbell S.C. et al. ... J. Urol.— 1994.— V. 151.— P. 1177.
Childs R. et al. ... NEJM.— 2000.— V. 343.— P. 750–758.
Chow W.H. et al. ... Genitourinary Oncology.— 2nd ed.— Ed. by N.J. Vogelzang et al.— USA: Lippincott Williams and Wilkins.— 1999.— P. 101–110.
Chow W.H. et al. ... Cancer Epidemiol. Biomarkers Prev.— 1995.— V. 4.— P. 327–331.
Citterio G. et al. ...Eur. Urol.— 1997.— V. 31.— P. 286–291.
Clayman R.V. et al. ... J. Urol.— 1980.— V. 123.— P. 157.
de Kernion, J. B. et al. ...J. Urol.— 1978.— V. 120.— P. 148.
Dillman R.O. et al. ... J. Clin. Oncol.— 1991.— V. 9.— P. 1233–1240.
Dutcher J.P. et al. ...Cancer J. Sci. Am.— 1997.— V. 3.— P. 73–78.
Elson P.J. et al. ... Cancer Res.— 1988.— V. 48.— P. 7310–7311.
Fairlamb D.J. ... Cancer.— 1981.— V. 47.— P. 2102.
Figlin R. et al. ... Proc. Am. Soc. Clin. Oncol.— 1998.— V. 17.— P. 318a.
Figlin R.A. et al. ... J. Clin. Oncol.— 1988.— V. 6.— P. 1604–1610.
Fisher R.I. et al. ...Ann. Int. Med.— 1988.— V. 108.— P. 518–523.
Fisher R.I. et al. ... Cancer J. Sci. Am.— 1997.— V. 3.— P. 70–72.
Fradet Y. et al. Placebo associated remissions in a multicentral randomized double blind trial of interferon gamma 1b for the treatment of metastatic renal cell carcinoma//Proc. Am. Soc. Clin. Oncol.— 1997.
Frydenberg M. et al. ... J. Urol.— 1994.— V. 152.— P. 1994.
Fyfe G. et al. ... J. Clin. Oncol.— 1995.— V. 13.— P. 688–696.
Gilboa E. et al. ... Cancer Immunol. Immunother.— 1998.— V. 46.— P. 82–87.
Glazer A.A. et al. ...J. Urol.— 1996.— V. 155. — P. 448–450.
Gleave M.F. ...N. Engl. J. Med.— 1998.— V. 338.— P. 1265.
Gohji K. et al. ... J. Urol.— 1994.— V. 152.— P. 1993.
Goldfarb D.A. et al. ... J. Urol.— 1990.— V. 144.— P. 1100–1104.
Golimbu M. et al. ... Urology.— 1986.— V. 27.— P. 291–301.
Halperin E.C. et al. ... Cancer.— 1983.— V. 51.— P. 614.
Horan J.J. et al. ... J. Urol.— 1989.— V. 142.— P. 943–948.
Huland E. et al. ... Cancer J. Sc. Am.— 1997.— V. 3.— P. 98.
Indrova M. et al. ... Neoplasma.— 1994.— V. 41.— P. 197.
Jakse G. et al. ... Sem. Oncol.— 1988.— V. 4.— P. 161–164.
Kirkwood J.M. ... Cancer Res.— 1985.— V. 45.— P. 863.
Kirkwood J.M. et al. ... Ann. Int. Med.— 1985.— V. 103.— P. 32.
Kollender Y. et al. ... J. Urol.— 2000.— V. 164.— P. 1505–1509.
Kovacs G. et al. ... Genes Chromosomes Cancer.— 1991.— V. 3.— P. 249–255.
Kozlowski J.M. Genitourinary Oncology. — 2nd ed. Ed. by N.J. Vogelzang et al.— USA: Lippincott Williams and Wilkins, 1999.— P. 264–266.
Kuijpers D. et al. ... Radiology.— 1989.— V. 170.— P. 59–60.
Kumar A. et al. ... Prog. Food Nutr. Sci.— 1993.— V. 17.— P. 89–98.
Libertino J.A. et al. ...J. Urol.— 1987.— V. 137.— P. 21.
Lipton A. ...Cancer. In press.— 2003.
Ljungberg B. et al. ... Cancer.— 1995.— V. 76.— P. 1435–1439.
Ljungberg B. et al. ...Eur. J. Cancer.— 1997.— V. 33.— P. 1794–1798.
Ljungberg B. et al. ...J. Urol.— 1994.— V. 151.— P. 1509–1513.
Ljungberg B. et al. ... Br. J. Cancer.— 1996.— V. 74.— P. 123–127.
Lokich J. et al. ... J. Urol.— 1975.— V. 114.— P. 371–374.
Lukkonen A. et al. ... Int. J. Cancer.— 1999. — Vol. 83. — P. 486–490.
Maldazys J.D. et al. ... J. Urol.— 1986.— V. 136.— P. 376.
Margolin K.A. et al. ... J. Immunother.— 1993.— V. 14.— P. 70.
Marshal F.F. et al. ... Urol. Clin. North. Am.— 1986.— V. 13.— P. 551–557.
Marshall F.F. et al. ... World J. Urol.— 1995.— V. 13.— P. 159–162.
Marshall M.E. et al. ... Urol.— 1990.— V. 36.— P. 300–302.
McCleannan B.L. et al. ... Radiol. Clin. North. Am.— 1994.— V. 32.— P. 55–69.
Mclaughlin J.K. et al. ...Int. J. Cancer.— 1992.— V. 52.— P. 562–565.
Medical Research Council Renal Cancer Collaborators. Interferon-? and survival in metastatic RCC: early results of a randomized controlled trial//Lancet.— 1999.— V. 353.— P. 14–17.
Mellemgaard A. et al. ... Cancer Causes Control.— 1994.— V. 5.— P. 105–113.
Mrstic C.H. et al. ... J. Urol.— 1992.— V. 148.— P. 1097–1100.
Muss H.B. ...J. Clin. Oncol.— 1987.— V. 5.— P. 286.
Negrier S. et al. ... N. Engl. J. Med.— 1998.— V. 338.— P. 1272–1278.
Neidhart J.A. ... Cancer.— 1986.— V. 57.— P. 1696–1699.
Neilsen O.S. et al. ... J. Clin. Oncol.— 1991.— V. 9.— P. 509.
Nelsen K.A. et al. ... Proc. Am. Assoc. Cancer Res.— 1989.— V. 30.— P. 260.
Nishiyama K. ... Cancer.— 1993.— V. 71.— P. 3611.
Novick A.C. ... Br. J. Urol.— 1998.— V. 82.— P. 321–324.
Novick A.C. et al. ... Ann. Surg.— 1990.— V. 212.— P. 472.
Nurmi M. et al. ... Stranchlentherap.— 1985.— V. 161.— P. 632–636.
Onufrey V. et al. ... Int. J. Radiat. Oncol. Biol. Phys.— 1985.— V. 11.— P. 2007.
Palmer P.A. et al. ...Cancer Biotherapy.— 1993.— P. 123–136.
Papac R.J. et al. ... Eur. J. Cancer.— 1993.— V. 29A.— P. 997.
Patel A. et al. ...Urologic Oncology. Eds. J.E. Oesterling et al., 1997.— P. 147–173.
Quesada J.R. et al. ... J. Clin.Oncol.— 1985.— V. 3.— P. 1522.
Rabinovitch R.A. et al. ... J. Clin. Oncol.— 1994.— V. 12.— P. 206.
Raynor W.J. et al. ... Am. J. Epidemiol.— 1981.— V. 113.— P. 371–377.
Reptmann R. et al. ...Anticancer Res.— 1997.— V. 17.— P. 2879–2882.
Rini B. et al. ... J. Clin. Oncol.— 2000.— V. 18.— P. 2419–2426.
Rosenberg S.A. et al. ... JAMA.— 1994.— V. 27.— P. 907–913.
Rosenberg S.A. et al. ... Ann. Surg.— 1998.— V. 228.— P. 307–319.
Sagalowsky A.I. et al. ... J. Urol.— 1994.— V. 151.— P. 1181–1184.
Saitoh H. ... J. Urol.— 1982.— V. 127.— P. 652–653.
Saitoh H. et al. ... J. Urol.— 1982.— V. 128.— P. 916.
Saitoh H. et al. ... J. Urol.— 1982.— V. 127.— P. 1092.
Samuels B. et al. ... Clin. Cancer Res.— 1997.— V. 3.— P. 1977.
Sarna G. et al. ... Cancer.— 1987.— V. 59.— P. 610–612.
Savage P.D. et al. Renal cell cancer. — Philadelphia: Lippincott Co., 1995.— P. 373–387.
Semelka R.C. et al. ... Radiology.— 1992.— V. 182.— P. 425–430.
Sherman J.L. et.al. ... AJR.— 1981.— V. 137.— P. 1221–1226.
Skinner D.G. et al. ... Cancer.— 1971.— V. 28.— P. 1165–1177.
Skinner D.G. et al. ...Ann. Surg.— 1989.— V. 210 (3).— P. 387–392.
Spiro I.J. et al. ...Genitourinary Oncology.— 2nd ed.— Ed. by N.J. Vogelzang et al.— USA: Lippincott Williams and Wilkins, Philadelphia, 1999.— P. 183–201.
Srougi M. ...ibid.— P. 201–206.
Staehler G. et al. ... J. Urol.— 1999.— V. 163.— P. 1671–1675.
Storkel S. et al. ... Cancer.— 1997.— V. 80.— P. 987–989.
Swanson D.A. et al. ... J. Urol.— 1983.— V. 129. — P. 704.
Taberno J. et al. ...Proc. Am. Soc. Clin.Oncol.— 1998.— V. 17.— P. 345a.
Tagliaferri P. et al. ... Am. J. Clin. Oncol.— 1998.— V. 21 (1).— P. 48–53.
Tretter C.P.G. et al. ...Genitourinary Oncology. — 2nd ed.— Ed. by N.J. Vogelzang et al.— USA: Lippincott Williams and Wilkins, 1999.— P. 248–259.
Van Poppel H. et al. ... J. Urol.— 1998.— V. 160.— P. 674–678.
Vogelzang N.J. et al. ... Lancet.— 1998.— V. 352.— P. 1691.
Weiss G.R. et al. ... J. Clin. Oncol.— 1992.— V. 10.— P. 275–281.
Weyman P.J. et al. ... Radiology.— 1980.— V. 137.— P. 417–424.
Yagoda A. et al. ... Urol. Clin. N. Am.— 1993.— V. 20.— P. 303.
Yang J.C. et al.... Cancer J. Sc. Am.— 1997.— V. 3.— P. 79–84.
Yang J.C. et al. ... Cancer.— 1995.— V. 76.— P. 687.
Yuan J.M. et al. ... Cancer Epidemiol Biomakers Prev.— 1998.— V. 7.— P. 429–433.
Описание проверено экспертом
Оцените статью:
- Вильмса опухоль
- Рак почек
- Метастатические карциномы почки
- Метастатический почечно-клеточный рак
- Опухоль Вильмса
- Рак почки
- Распространенный почечно-клеточный рак
- Рецидивирующие карциномы почки
- Неоперабельные карциномы почки
- Метастатическая почечно-клеточная карцинома
- Почечная карцинома
- Распространенная почечноклеточная карцинома
- Вилмса опухоль
- Аденомиосаркома
- Аденомиоцистосаркома
- Аденосаркома почки
- Нефробластома
- Нефрома
- Нефрома эмбриональная
- Опухоль Бирх-Хиршфельда
- Опухоли почки
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
рак почки
почечно-клеточная карцинома, почечно-клеточный рак,


