C56 Злокачественное новообразование яичника, МКБ-10
Отредактировано: 02.04.2024
д.м.н., проф. Жорданиа К.И.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Распространение и факторы риска возникновения опухолей яичников. Диагностика. Патоморфологическая характеристика и особенности клинического течения. Лечение злокачественных опухолей яичников
Распространение и факторы риска возникновения опухолей яичников
Злокачественные опухоли репродуктивной системы являются наиболее частыми в структуре онкологической заболеваемости женщин. Их суммарная доля превышает 35%. РЯ составляет 4–6% среди злокачественных опухолей у женщин и занимает 7 место по частоте. По данным Международного агентства по изучению рака, ежегодно в мире регистрируется более 165 тыс. новых случаев РЯ, и более 100 тыс.
женщин умирают от злокачественных опухолей яичников. Если удельный вес РЯ в онкологической заболеваемости женщин во всех странах мира примерно одинаков, то частота заболеваемости на 100 тыс. женского населения значительно варьирует. В Европе, особенно в северных странах и Великобритании, а также в Северной Америке, стандартизованные показатели заболеваемости наиболее высокие (12,5 и более на 100 тыс.). В России ежегодно РЯ выявляется более чем у 11 тыс. женщин (10,17 на 100 тыс.), занимая 7 место в структуре общей онкологической заболеваемости (5%) и 3 — среди гинекологических опухолей, после рака тела и шейки матки. За последние 10 лет в стране отмечен заметный — на 8,5% — прирост заболеваемости. Удручает и выживаемость больных данной патологией. Только на первом году после установления диагноза мы теряем каждую третью пациентку. По сводным данным популяционных раковых регистров стран Европы, 1-летняя выживаемость больных РЯ составляет 63%, 3-летняя — 41%, 5-летняя — 35% (Аксель Е.М., Козаченко В.П., Ушакова Т.И., 2001).
Этиология возникновения опухолей яичников неизвестна, хотя немаловажную роль в возникновении заболевания играют гормональные и генетические факторы. Известно, что беременности и роды снижают риск возникновения заболевания, в то время как бесплодие его повышает. Применяемые в течение года гормональные препараты, стимулирующие овуляцию, повышают риск заболевания в 2–3 раза. Согласно так называемой “овуляторной” гипотезе риск развития РЯ прямо пропорционален числу репараций покровного эпителия яичников после овуляторных циклов в течение всей жизни женщины. Рак молочной железы (РМЖ) в анамнезе повышает риск заболевания опухолями яичников в 2–4 раза (Rossing M.A., Daling J.R., Weiss N.S. et al. 1994; Whittemore W., 1994). Были получены убедительные данные, свидетельствующие о несомненной роли в этиологии РЯ генетических факторов. Спорадические формы опухолей яичников составляют примерно 93–95% (Гарькавцева Р.Ф., 2001).
До последнего времени вопросы гистогенеза опухолей яичников имели преимущественно академическое значение. Теперь, когда арсенал лечебных средств онкогинекологов значительно обогатился противоопухолевыми препаратами, а самое главное, появилось очень перспективное направление — генотерапия, большое практическое значение приобретает установление точного гистогенеза опухоли. Источником почти всех эпителиальных опухолей яичников считаются кисты включения, возникающие в результате отшнурования инвагинированного покровного мезотелия. Клетки в этих кистах могут дифференцироваться в сторону как трубного, так и эндоцервикального эпителия. Клетки герминогенных опухолей развиваются из зародышевых клеток, а стромальноклеточные опухоли яичников — из мезенхимальных. Многие авторы, в течение длительного времени занимающиеся этим разделом онкоморфологии, однозначно признаются в том, что в значительном числе наблюдений установить начало инвазивного роста не представляется возможным. По-видимому, это обстоятельство и привело к выделению в классификации ВОЗ подгруппы так называемых "пограничных" опухолей или "карцином низкой степени злокачественности" (Карселадзе А.И., 1989).
Морфолологическая классификация опухолей яичников
I. Эпителиальные опухоли.
А. Серозные опухоли.
1. Доброкачественные:
а) цистаденома и папиллярная цистаденома;
б) поверхностная папиллома;
в) аденофиброма и цистаденофиброма.
2. Пограничные (потенциально низкой степени злокачественности):
а) цистаденома и папиллярная цистаденома;
б) поверхностная папиллома;
в) аденофиброма и цистаденофиброма.
3. Злокачественные:
а) аденокарцинома, папиллярная аденокарцинома и папиллярная цистаденокарцинома;
б) поверхностная папиллярная карцинома;
в) злокачественная аденофиброма и цистаденофиброма.
Б. Муцинозные опухоли.
1. Доброкачественные:
а) цистаденома;
б) аденофиброма и цистаденофиброма.
2. Пограничные (потенциально низкой степени злокачественности):
а) цистаденома;
б) аденофиброма и цистаденофиброма.
3. Злокачественные:
а) аденокарцинома и цистаденокарцинома;
б) злокачественная аденофиброма и цистаденофиброма.
В. Эндометриоидные опухоли.
1. Доброкачественные:
а) аденома и цистаденома;
б) аденофиброма и цистаденофиброма.
2. Пограничные (потенциально низкой степени злокачественности):
а) аденома и цистаденома;
б) аденофиброма и цистаденофиброма.
3. Злокачественные:
а) карцинома:
i аденокарцинома;
ii аденоакантома;
iii злокачественная аденофиброма и цистаденофиброма.
б) эндометриоидная стромальная саркома;
в) мезодермальные (мюллеровы) смешанные опухоли, гомологичные и гетерологичные.
Г. Светлоклеточные (мезонефроидные) опухоли.
1. Доброкачественные: аденофиброма.
2. Пограничные (потенциально низкой степени злокачественности).
3. Злокачественные: карцинома и аденокарцинома.
Д. Опухоли Бреннера.
1. Доброкачественные.
2. Пограничные (пограничной злокачественности).
3. Злокачественные.
Е. Смешанные эпителиальные опухоли.
1. Доброкачественные.
2. Пограничные (пограничной злокачественности).
3. Злокачественные.
Ж. Недифференцированная карцинома.
З. Неклассифицированные эпителиальные опухоли.
II. Опухоли стромы полового тяжа.
А. Гранулезно-стромальноклеточные опухоли.
1. Гранулезоклеточная опухоль.
2. Группа теком — фибром:
а) текома;
б) фиброма.
Б. Андробластомы; опухоли из клеток Сертоли и Лейдига.
1. Высокодифференцированные:
а) тубулярная андробластома; опухоль из клеток Сертоли;
б) тубулярная андробластома с накоплением липидов;
в) опухоль из клеток Сертоли с накоплением липидов (липидная фолликулома Лесена);
г) опухоль из клеток Сертоли и Лейдига;
д) опухоль из клеток Лейдига; опухоль из хилюсных клеток.
2. Промежуточной (переходной) дифференцировки.
3. Низкодифференцированные (саркоматоидные).
4. С гетерологическими элементами.
В. Гинандробластома.
Г. Неклассифицируемые опухоли стромы полового тяжа.
III. Липидноклеточные (липоидноклеточные) опухоли.
IV. Герминогенные опухоли
А. Дисгерминома.
Б. Опухоль эндодермального синуса (опухоль желточного мешка).
В. Эмбриональная карцинома.
Г. Полиэмбриома
Д. Хорионэпителиома.
Е. Тератомы.
1. Незрелые.
2. Зрелые:
а) сóлидные;
б) кистозные:
i дермоидная киста;
ii дермоидная киста с малигнизацией.
3. Монодермальные (высокоспециализированные):
а) строма яичника;
б) карциноид;
в) строма яичника и карциноид;
г) другие.
Ж. Смешанные герминогенные опухоли.
V. Гонадобластома.
А. Чистая (без примеси других форм).
Б. Смешанная с дисгерминомой и другими формами герминогенных опухолей.
VI. Опухоли мягких тканей, неспецифичные для яичников.
VII. Неклассифицированные опухоли.
VIII. Вторичные (метастатические) опухоли.
IX. Опухолевидные процессы.
А. Лютеома беременности.
Б. Гиперплазия стромы яичника и гипертекоз.
В. Массивный отек яичника.
Г. Единичная фолликулярная киста и киста желтого тела.
Д. Множественные фолликулярные кисты (поликистозные яичники).
Е. Множественные лютеинизированные фолликулярные кисты и (или) желтые тела.
Ж. Эндометриоз.
З. Поверхностные эпителиальные кисты включения (герминальные кисты включения).
И. Простые кисты.
К. Воспалительные процессы.
Л. Параовариальные кисты.
Степень распространения, а соответственно, и стадию болезни устанавливают на основании данных клинического обследования, результатов оперативного вмешательства и гистологического изучения биоптатов, взятых во время операции из различных участков брюшной полости. Правильное определение стадии болезни позволяет выбрать оптимальную тактику лечения и улучшить результаты лечения. Классификация РЯ по стадиям (TNM и FIGO, 1997) приведена ниже (табл. 1).
Таблица 1
| TNM | FIGO | Степень распространения |
| T0 | — | Опухоль отсутствует |
| TХ | — | Недостаточно данных для оценки первичной опухоли |
| TlА | IА | Опухоль ограничена одним яичником, капсула не поражена, нет опухолевого разрастания на поверхности яичника |
| TlВ | IВ | Опухоль ограничена двумя яичниками, капсула не поражена, нет опухолевого разрастания на поверхности яичника |
| TlС | IС | Опухоль ограничена одним или двумя яичниками, сопровождается разрывом капсулы, наличием опухолевого разрастания на поверхности яичника, наличием злокачественных клеток в асцитической жидкости или смыве из брюшной полости |
| T2 | II | Опухоль поражает один или два яичника с вовлечением органов и стенок малого таза |
| T2A | IIA | Распространение и/или метастазирование в матку и/или одну или обе трубы |
| T2B | IIB | Распространение на другие ткани таза |
| T2C | IIC | Ограничена пределами малого таза (IIа или IIb) с наличием злокачественных клеток в асцитической жидкости или смыве из брюшной полости |
| T3 и/или N1 | III | Опухоль поражает один или оба яичника с микроскопически подтвержденными метастазами за пределами таза и/или метастазами в регионарных лимфатических узлах |
| T3A | IIIA | Микроскопически подтвержденные внутрибрюшинные метастазы за пределами таза |
| T3B | IIIB | Макроскопические внутрибрюшинные метастазы за пределами таза до 2 см в наибольшем диаметре |
| T3C и/или N1 | IIIC | Внутрибрюшинные метастазы за пределами таза более 2 см в наибольшем измерении и/или метастазы в регионарных лимфоузлах |
| M1 | IV | Отдаленные метастазы (исключая внутрибрюшинные метастазы) |
Примечание: метастазы в капсулу печени классифицируются как Т3 /стадия III; метастазы в паренхиму печени классифицируются как М1 /стадия IV; позитивные цитологические находки в плевральной жидкости расцениваются как М1 /стадия IV.
Необходимо отметить значительные трудности, возникающие при определении распространенности злокачественного процесса, особенно при так называемых “ранних” стадиях заболевания.
Данные литературы свидетельствуют о том, что даже у больных I-II стадиями РЯ, которые расцениваются клиницистами как “ранние стадии” при целенаправленном исследовании диагностируются метастазы в забрюшинные лимфоузлы различных локализаций (Trimbos J.B., 2000). По данным некоторых исследователей, поражение лимфоузлов достигает почти 30%. Лапаротомия является наиболее точным методом определения стадии РЯ. Из 100% больных I-II стадиями РЯ у 28% с предполагаемой первой стадией и у 43% с предполагаемой второй — устанавливаются более поздние стадии процесса. Исходя из этого, разработанные и неоднократно модифицированные классификации FIGO и TNM, вероятно, не полностью удовлетворяют онкологов, т.к., даже несмотря на многочисленные поправки, они остаются достаточно условными. Сложность обнаружения метастазов в забрюшинные лимфоузлы объясняется тем, что забрюшинно, только в парааортальной зоне, насчитывается от 80 до 120 лимфоузлов, и практически каждый из них может быть поражен микрометастазами. Пораженные опухолью лимфоузлы могут оставаться обычного размера, иметь плотно-эластическую консистенцию, быть свободно или относительно смещаемыми. Поэтому у больных РЯ с ранними стадиями заболевания (табл. 2), которым была проведена операция в полном объеме (Trimbos J.B., 2000) отмечается достаточно высокий процент рецидивов — 23%.
Таблица 2
Частота рецидивов при I-II стадиях РЯ в зависимости от гистологической формы опухоли
| Серозный рак | 21% |
| Муцинозный рак | 10% |
| Эндометриоидный рак | 16% |
| Мезонефроидный рак | 53% |
Учитывая столь высокий процент рецидивов заболевания при ранних стадиях процесса, в некоторых клиниках склонны на втором этапе проводить дополнительную терапию, не будучи уверенными в правильном стадировании заболевания. Заметное увеличение продолжительности жизни и уменьшение количества рецидивов у этой категории больных еще раз подтверждают ошибки в определении распространенности процесса.
Кроме метастатического поражения лимфоузлов у больных злокачественными опухолями яичников в ряде случаев обнаруживается и поражение метастазами костного мозга (Braun S. et al., 2001) Подобного рода метастазы обычно диагностируются при помощи антител. В одном из исследований, проведенном FIGO, были обнаружены метастазы в костный мозг у 30% больных РЯ с I-III стадиями заболевания. Необходимо подчеркнуть, что у больных с метастазами в костный мозг значительно чаще (70%) возникали рецидивы заболевания по сравнению с больными, у которых поражения костного мозга выявлено не было (40%). В связи с приведенными выше данными возникает целый ряд вопросов, которые при их разрешении могут заставить онкологов пересмотреть ныне существующие позиции и значительно изменить наши взгляды на тактику ведения больных РЯ.
К сожалению, в настоящее время используемые немногочисленные прогностические параметры не дают в полной мере информации, по которой можно объективно судить о течении заболевания. Доказательством могут служить судьбы пациенток с пограничными опухолями яичников — состоянием, при котором и морфологическая структура и степень дифференцировки оптимальны с прогностической точки зрения, но и при этой патологии хорошо известны рецидивы и метастазы. Высокая дифференцировка опухоли с учетом выраженного полиморфизма опухолей яичников абсолютно не исключает плохого прогноза течения заболевания. Метод проточной цитометрии считающийся наиболее объективным в настоящее время, может дать абсолютно разные результаты при исследовании тканей из разных участков одной и той же опухоли.
Одним из сложных аспектов разбираемой проблемы являются вопросы морфологии опухолей яичников. Не будет преувеличением сказать, что неэффективность лечения злокачественных новообразований яичников во многом обусловлена серьезными пробелами в наших знаниях о структуре этих опухолей, их гисто— и морфогенезе (Карселадзе А.И., 1989). Если анатомические особенности целого ряда органов (шейка матки, желудок, легкое и др.) с внедрением эндоскопических и цитологических методов исследования дали возможность детально изучить предраковые состояния и ранние формы рака, то сложности визуализации начальных этапов бластомогенеза в яичниках, поздняя клиническая выявляемость их опухолевого поражения привели к тому, что морфологическая семиотика раннего рака практически неизвестна.
Диагностика
Бурное развитие биологических наук в последнее десятилетие и особенно интенсивные исследования в экспериментально-теоретической онкологии, позволили добиться значительных успехов в познании генетических факторов, причастных к возникновению неоплазий у человека. В настоящее время уже нет сомнений в том, что в основе злокачественных новообразований (в том числе и РЯ) лежат повреждения генетического аппарата в герминальной (половой) и соматической клетках, делающие эти клетки чувствительными к воздействию канцерогенных факторов внешней среды, способных запустить процесс малигнизации. В зависимости от того, в какой клетке произошла первоначальная мутация — половой или соматической, рак может быть наследственным и спорадическим (Гарькавцева Р.Ф., 2001).
В последнее время решение вопросов этиологии, патогенеза и ранней диагностики во многом связывают с медико-генетическими исследованиями, направленными на изучение роли наследственной предрасположенности к развитию РЯ, его генетической гетерогенности и выявление среди родственников пациентки лиц с потенциально высоким риском заболеть этой формой рака (Гарькавцева Р.Ф., 2001).
В семьях больных РЯ аналогичная форма рака встречается в 4–6 раз чаще, чем в популяции. В этих семьях также наблюдалось 4-кратное повышение частоты по сравнению с общей популяцией РМЖ. Риск заболеть РЯ для родственниц первой степени родства в таких семьях в 9–10 раз превышает максимальное значение накопленного общепопуляционного риска. Анализ генеза и течения РЯ, основанный на использовании такого подхода, позволил рассматривать это заболевание как мультифакторное. Вклад генетических факторов в развитие РЯ составил 54%, соответственно, вклад факторов внешней среды — 46%. С одной стороны, это соответствует представлениям о сложном взаимодействии обеих групп факторов в развитии РЯ, с другой — говорит о генетической гетерогенности заболевания.
Первый уровень этиологической и генетической гетерогенности РЯ был установлен в зависимости от характера накопления его и других опухолей в семьях, что позволило выделить 3 группы:
1) семьи с накоплением только РЯ — органоспецифический РЯ;
2) семьи с накоплением РЯ, ассоциирующего с другими опухолями органов женской репродуктивной системы (РМЖ, рак эндометрия);
3) семьи, где РЯ является компонентом синдрома семейного рака (синдром Линча II) и встречается наряду со злокачественными заболеваниями других локализаций — раком прямой кишки, почки и др.
Семейная (органоспецифическая) форма РЯ наследуется аутосомно-доминантно и напрямую зависит от числа родственниц 1 или 2 степени родства:
1) если РЯ болели 2 родственницы 1 степени родства (мать, сестры, дочери), риск заболевания составляет 50%;
2) если РЯ болели одна родственница 1 степени родства и одна родственница 2 степени (бабушка, тетя, двоюродная сестра, внучка), риск заболевания повышен в 3–10 раз;
3) если РЯ болела одна родственница 1 степени родства, то риск развития РЯ повышен в 2–4 раза.
Синдром Линча II — наследственная форма рака прямой кишки (без полипоза) в сочетании с аденокарциномами яичников, матки, молочной железы, желудка, опухолями почек, легких. Риск заболевания РЯ повышен в 3 раза.
По данным Канцеррегистра ГУ РОНЦ им. Н.Н. Блохина РАМН, в 720 обследованных семьях с наследственной предрасположенностью, за период 1983–2000 гг. было выявлено 130 больных с различной онкологической патологией (табл. 3).
Таблица 3
Число выявленных больных из группы наследственного риска
| Название онкологической патологии | Число больных |
| Рак молочной железы | 47 |
| Рак яичников | 38 |
| Рак тела матки | 14 |
| Рак желудка | 9 |
| Рак толстой кишки | 7 |
| Меланома кожи | 7 |
| Рак почки | 5 |
| Рак легкого | 3 |
| ИТОГО: | 130 |
Необходимо подчеркнуть, что практически у всех пациенток (93%) были диагностированы начальные формы заболеваний, не требующие дополнительного лечения. Кроме того, было выявлено 420 больных, страдающих доброкачественными заболеваниями (миомы матки, доброкачественные опухоли яичников, полипозы эндометрия и т.д.).
Одним из значительных достижений в области изучения наследственных форм РЯ (РМЖ) явилось открытие генов BRCA–1 и BRCA–2.
Ген BRCA–1 картирован на длинном плече 17 хромосомы. У носительниц данного гена риск заболеть РМЖ составляет 90%, РЯ — 50%. Показано, что мутация этого гена происходит в герминальных клетках, что приводит к развитию наследственных форм РЯ и РМЖ. Таким образом наследственно обусловленные формы рака этих локализаций привлекают особое внимание онкологов с точки зрения формирования групп риска из числа родственников пациенток с целью ранней диагностики у них предопухолевой и опухолевой патологии (подробнее см. соотв. раздел).
Существуют 2 основных лабораторных метода диагностики злокачественных новообразований, в т.ч. яичника.
Первый — молекулярно-генетический — основан на определении мутантных генов и их РНК-продуктов. Многочисленные мутации в генах приводят к синтезу целого ряда несвойственных взрослому организму белков, а также белков, характерных для эмбрионального периода развития. Чувствительность метода очень высока и достигает 10–15 — 10–18 г (Жорданиа К.И., 2001). ПЦР мутантных генов в ДНК плазмы крови человека позволяет выявить опухоль еще в доклинической стадии. Теоретические расчеты показывают, что таким путем можно выявить опухолевый очаг объемом до 0,01 см3.
Наибольшую практическую ценность в качестве молекулярно-генетических маркеров имеют онкогены и антионкогены.
Онкогены — дефектные гены факторов положительной регуляции клеточного деления (семейства ras и myc генов, семейства генов ростовых рецепторов и т.д.) и антиапоптозных факторов, особенно bcl–2.
Антионкогены или гены супрессоры опухолевого роста — гены факторов отрицательной регуляции клеточного деления (гены факторов апоптоза). Дефект антионкогенов приводит к потере их противоопухолевой функции. Известны десятки генов супрессоров опухолевого роста, но наибольшее диагностическое значение имеют мутации гена белка р53 — ингибитора клеточного деления и ключевого фактора апоптоза. Мутации гена р53 встречаются более чем в половине случаев онкологических заболеваний. Почти столь же распространены в опухолях дефекты другого гена супрессора опухолевого роста — гена белка р16.
Молекулярно-генетический анализ онкогенов myc, ras, bcl–2 и антионкогенов р53 и р16 позволяет выявить большинство опухолей человека.
Ранним и постоянным признаком малигнизации является развитие состояния генетической нестабильности, что вызывает мутации в микросателлитных ДНК. Мутации в микросателлитных ДНК — второй вид молекулярно-генетических онкомаркеров.
Наконец, для опухолей характерно нарушение метилирования ДНК, которое заключается в изменении карты метилирования. Поэтому еще одним видом молекулярно-генетических маркеров может стать анализ сайтов метилирования в опухолевой ДНК.
Все опухоли имеют обычно моноклоновую природу, то есть являются потомками одной мутантной клетки, маркерные мутации присутствуют во всех опухолевых клетках. Это позволяет обнаружить достаточное количество молекул мутантной ДНК при анализе как самой опухоли, так и лимфатических узлов, крови, костного мозга, содержащих опухолевые клетки. Более того, как показали исследования последних лет, мутантные молекулы ДНК опухолевого происхождения могут быть выявлены даже в бесклеточной части крови (плазме) онкологических больных, что упрощает раннюю диагностику заболевания.
Второй метод диагностики онкологических заболеваний — выявление онкомаркеров иммунохимическими методами. Анализ многих иммунохимических маркеров выполняется с помощью стандартных диагностических наборов.
Биохимические онкомаркеры — большая группа факторов, обнаруживаемых в злокачественных и ассоциированных со злокачественным ростом клетках. Они включают:
— эмбриональные антигены,
— ростовые и дифференцировочные антигены,
— ферменты и изоферменты,
— другие факторы.
Однако чувствительность иммунохимических методов в тысячи раз меньше, чем при применении молекулярно-генетических методов и диагностическое значение они имеют уже при сформировавшихся опухолях. Лишь в последние годы, благодаря качественному повышению уровня иммунотехнологий, намечается некоторая тенденция к повышению эффективности этого метода диагностики и индивидуализации подходов к каждой в отдельности локализации опухолевого процесса.
Циркулирующие опухолевые маркеры — природные протеины, которые секретируются опухолевыми клетками в кровоток.
Определение опухолевого маркера должно:
— быть доступным,
— быть относительно простым и недорогим,
— быть достаточно специфичным для изучаемой опухоли и по возможности ассоциироваться с ней,
— давать четкое соотношение между уровнем и весом (количеством) опухолевых клеток,
— повышаться при ранних стадиях и рецидивах заболевания.
В настоящее время в клинике наиболее широко применяется определение у больных РЯ опухолеассоциированного маркера СА 125 (Cancer Аntigen–12,5).
Необходимо подчеркнуть, что при исследовании концентраций СА 125 отмечаются и физиологические колебания: прогрессивный рост уровня белка в фолликулярную— лютеиновую фазу менструального цикла, с резким повышением во время самой менструации, а затем резким падением к ее окончанию. Описаны случаи повышения концентрации маркера в крови до 100–300 ЕД/мл. Такое “поведение” маркера встречается редко, но знать о данном феномене все же необходимо.
Повышение уровня СА 125 в сыворотке крови характерно не только для опухолевого поражения яичников. Описаны случаи положительных реакций на этот маркер у больных острым гепатитом, панкреатитом, туберкулезом, при перитонитах и асцитических выпотах различной этиологии. Правда необходимо отметить, что уровень маркеров при этих патологических состояниях редко превышает 100 ЕД/мл.
У онкогинеколога достаточно часто возникают проблемы с интерпретацией диагноза в случае наличия у пациенток эндометриоза. Эта, достаточно часто встречающаяся патология у женщин, сопровождается повышением показателей маркера в 25% наблюдений. Необходимо помнить, что примерно у 11% больных эндометриозом процесс может малигнизироваться, поэтому эта категория пациенток требует тщательного наблюдения, с возможным использованием инвазивных методов диагностики (Карселадзе А.И., 2003). Синтез СА 125 и повышение его уровня в крови отмечается также и при других онкологических заболеваниях. Например, у больных, страдающих РМЖ (15–20%), РТМ (25%), раком предстательной железы (25%), легких (17%), желудка (15%).
Как известно, более 80% больных РЯ страдают его серозной формой, и именно при этом гистологическом варианте рака наиболее специфичным маркером оказался СА 125. По данным разных авторов, чувствительность метода составляет 75–90%. При других морфологических формах РЯ (муцинозной, эндометриоидной, светлоклеточной) положительные реакции на этот маркер соответствуют 30–60%. Чем выше стадия заболевания и выраженнее метастатическое поражение брюшины — тем больше средние показатели СА 125 (табл. 4).
Таблица 4
Показатели СА–125 в зависимости от стадии РЯ
| Стадии | Показатели CA 125 |
| I стадия | 28,8 ЕД/мл |
| II стадия | 183,2 ЕД/мл |
| III-IV стадии | Обычно более 103 ЕД/мл |
Вероятно, метастазы опухоли, имплантируясь на поверхности брюшины и синтезируя целый ряд весьма активных протеолитических ферментов, резко нарушают проницаемость брюшинного покрова, способствуя проникновению СА 125 в кровоток. Это косвенно подтверждается отсутствием большой разницы в концентрации белка в асцитической жидкости и сыворотке крови при запущенных стадиях бластоматозного процесса (Жорданиа К.И., 2001). Возможно, значительное повышение уровня белка в больном организме является реакцией именно на поражение брюшины. Подтверждением данного предположения могут служить известные случаи повышения показателей СА 125 при истинном раке брюшины, а также при диссеминации по брюшной полости РМЖ, рака ПЖ, желудка и толстой кишки.
Таким образом, несмотря на ряд ограничений, нельзя недооценивать роль СА–125 у больных РЯ.
С помощью этой тест-системы можно достаточно объективно контролировать эффективность проводимого лечения. Для этого следует проводить оценку уровня СА 125 после каждого курса химиотерапии. Если в процессе терапии отмечается неуклонное падение концентрации маркера в крови, это свидетельствует об эффективности лечения. И наоборот, при отсутствии изменений или росте показателей СА 125 можно думать либо о неправильно поставленном диагнозе, что бывает наиболее часто, либо о первичной резистентности опухоли. Исследуя прогностическую роль маркера при мониторинге послеоперационного лекарственного лечения, удалось обнаружить, что в случае нормализации показателей в ближайшие 3 мес от начала лечения, медиана выживаемости составила 2,8±0,7 г., в то время как для пациенток, у которых маркер был повышен долее названного срока, медиана выживаемости не превышала 1,7±0,3 г.
Значительно более информативной представляется возможность использования СА 125-тест-системы для раннего выявления рецидивов РЯ (Шелепова В.И. с соавт., 1996). Клиницистам хорошо известно, что у большинства больных возникают рецидивы заболевания, терапия которых очень сложна и часто малоэффективна, несмотря на применение целого комплекса лечебных мероприятий. Даже у больных с так называемыми ранними стадиями болезни в 25–30% наблюдений отмечен возврат заболевания, не говоря уже о III-IV стадиях, когда число рецидивов достигает 80–90%. Очень интересные данные были получены при исследовании роли СA 125 во время ремиссии и при рецидивах РЯ у 201 больной (Шелепова В.И. с соавт., 1996; Порханова Н.В., 1999). В исследовании были получены результаты, свидетельствующие о том, что повышение СА 125 от нуля (либо от базального уровня) до 35 ЕД/мл, т.е. даже в пределах “нормы”, может считаться доклиническим проявлением рецидива.
Длительность субклинического течения рецидива до его клинической манифестации, в частности, определяемого с помощью УЗИ, зависит от следующих параметров:
а) время удвоения опухоли, выражением которого является прирост СА 125 в единицу времени;
б) абсолютное значение СА 125 в момент времени, от которого производится отсчет (табл. 5).
Таблица 5
Динамика роста СА 125 при рецидивах серозного РЯ
| Уровень СА 125 в период ремиссии | Прирост за месяц, % | Время до диагностирования рецидива |
| Менее 1/2 ДК* | Менее 20 | В течение 6 мес не наблюдается |
| Менее 1/2 ДК | Свыше 20 | 4-6 мес |
| От 1/2 ДК до ДК | Свыше 20 | 2-4 мес |
| Выше ДК | Свыше 20 | Локальное образование находится в пределах чувствительности УЗИ; при диссеминации 1-3 мес |
*ДК — дискриминационная концентрация СА 125, равная 35 ЕД/мл
У всех пациенток с СА 125 менее 1/2 ДК и ежемесячным приростом, не превышающим 20% от предыдущего значения маркера, рецидива в ближайшие 6 мес не будет; если прирост превышает 20%/мес, рецидив будет диагностирован через 4–6 мес. У пациенток со значением СА 125 от 1/2 ДК и приростом свыше 20%/мес, рецидив состоится в ближайшие 2–4 мес. Если значение маркера превышает ДК, а его прирост выше 20%, то в случае локального образования его размеры находятся в пределах чувствительности УЗИ и, следовательно, могут быть диагностированы с помощью этого метода исследования, а в случае диссеминации рецидив можно обнаружить спустя 1–3 мес.
Итак, использование СА 125 позволяет не только с достаточно высокой точностью диагностировать наличие рецидива, но и с большой вероятностью прогнозировать его появление. Чувствительность СА 125 при рецидиве заболевания составляет 97%. Необходимо помнить о весьма вероятном повышении уровня СА 125 у больных рецидивным РЯ, у которых при первичном лечении показатель не превышал нормы. Повышение уровня маркера на фоне ремиссии должно стать основанием для комплексного углубленного обследования больной с целью выявления рецидива заболевания, своевременное лечение которого могло бы значительно повысить эффективность терапии. Хотя некоторые авторы рекомендуют начинать лечение лишь при первых клинических признаках рецидива заболевания, даже несмотря на повышение уровня СА 125, однако единого мнения по этому вопросу еще не выработано.
Открытие опухолеассоциированных антигенов и моноклональных антител (МКА) сделало возможным их применение в диагностике и лечении онкологических заболеваний. Первые же попытки использования меченых радионуклидами МКА вселили надежду, что в онкологии появился новый, высоко специфический и весьма перспективный диагностический подход, способный при его усовершенствовании вытеснить практически все остальные диагностические методики. Это объясняется высокой информативностью метода, используя который можно определить стадию процесса, степень распространения и даже гистологическую форму опухоли. Так, при серозном РЯ использование РФП IMACIS 1 и IMACIS 2 (меченых 131 J МКА к СА 125) подтвердило достаточно высокую информативность методики (Жорданиа К.И. и др., 1988). Препарат фиксировался в местах локализации как первичной опухоли, так и в ее метастазах, давая точную картину распространения процесса. Идентичная картина была получена при рецидивах заболевания. Чувствительность метода иммунолокализации для малого таза составила 87% и для брюшной полости — 100%, специфичность — 50 и 55% , точность — 88 и 72% соответственно (рис. 1 на цветной вклейке).
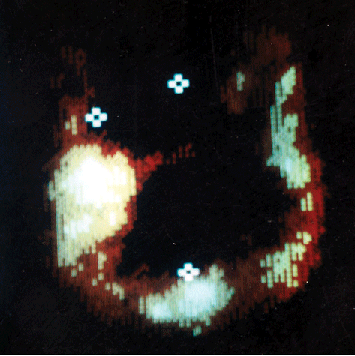
Рисунок 1. Иммуновизуализация серозного рака яичников III стадии
В настоящее время уже предпринимаются попытки использования этого метода и для терапии опухолей. Конъюгированный со специфическим МКА практически любой терапевтический агент фиксируется на месте продукции антигена, т.е. непосредственно в тканях злокачественного новообразования.
Широко применяемый в настоящее время ультразвуковой метод диагностики, уже стал рутинным и высокоэффективным. Эхография позволяет получить максимум информации о патологических состояниях в брюшной полости и способствует активному выявлению опухолей яичников в группах риска, дифференциальной диагностике, определению распространенности заболевания, мониторингу эффективности проводимого лечения. Учитывая неинвазивный и практически безвредный характер эхографии, такие методы диагностики как КТ, МРТ, АГ и лапароскопия применяются в основном как уточняющие методики при сложных клинических наблюдениях. Возможность выявления ультразвуковым методом опухолей размерами от 0,5 см в диаметре позволяет диагностировать рецидивы заболевания в доклинической стадии. Сочетание эхографии и определения СА 125 еще более повышает информативность, позволяя клиницистам своевременно начать лечение больных.
Патоморфологическая характеристика и особенности клинического течения
Остановимся на основных формах злокачественных опухолей яичников и дадим им краткие патоморфологические характеристики.
Из всех злокачественных опухолей яичников на эпителиальные приходится 75—80%. В соответствии с исходным типом клеток 50% из них — серозные, 15% — муцинозные, 20% — эндометриодные, 5% — мезонефроидные и 10% — недифференцированные.
В классификации ВОЗ каждая гистогенетическая единица представлена тремя разновидностями — доброкачественная, пограничная, злокачественная.
Серозные опухоли
Серозные доброкачественные опухоли являются наиболее часто встречающимися доброкачественными новообразованиями яичника. Они обнаруживаются практически во всех возрастных группах за исключением детского возраста, проявляют четкую тенденцию к двусторонности, локализуются чаще на границе яичника с мезоварием или под корой яичника ближе к его латеральным краям. Основные структуры, выявляемые в этой опухоли: цистаденомы, цистаденопапилломы, поверхностный папилломатоз — являются фазами усложнения строения опухоли и редко встречаются в изолированном виде (Карселадзе А.И., 2000).
Клеточные структуры опухоли представляют собой спектр дифференцирующихся элементов от округлого мезотелиоидного до трубного эпителия со всеми промежуточными этапами, проявляют полное тождество с покровом яичника и выстилкой маточной трубы. Практически все доброкачественные опухоли яичников после исключения функциональных кист должны быть подвергнуты хирургическому лечению, т.к. только срочное и плановое гистологическое исследование удаленного препарата, может определить дальнейшую тактику ведения больных.
В серозных доброкачественных опухолях яичников можно выявить участки постепенного зарождения очагов так называемой пограничной серозной опухоли, которая для клиницистов является достаточно серьезной проблемой. В классификации ВОЗ не дано достаточно конкретного и хорошо прокомментированного определения пограничных опухолей. В классификации сказано: “Форма эпителиальной опухоли, промежуточная между морфологически явно доброкачественной и формой явно злокачественной, получила название ”пограничной" опухоли, или “карциномы низкой степени злокачественности”. Эта опухоль может быть охарактеризована как тип опухоли, имеющий некоторые, но не все признаки злокачественности. Даже из процитированного фрагмента ясно, насколько неконкретно определение, данное авторами классификации. Между тем диагностические, а отсюда и тактические, ошибки при пограничных новообразованиях характеризуются весьма частым проявлением (20% случаев).
Серозные пограничные опухоли составляют 9,8% у больных с эпителиальными опухолями яичников. Возраст женщин колеблется от 19 лет до 71 года. Большинство больных относятся к возрастному интервалу 30–50 лет. Провести грань между этой опухолью, с одной стороны, и доброкачественными и явно злокачественными ее аналогами — с другой, очень трудно. Между всеми этими формами можно всегда обнаружить переходные ступени. Отсутствует строгий параллелизм между преобладающими клеточными типами в первичном очаге и участках диссеминации. В диссеминатах наряду с преимущественной пролиферацией определенного типа клеток возникает и разного рода стромальная реакция, характер которой коррелирует с прогнозом болезни (Карселадзе А.И., 2000).
Объяснить своеобразие пограничных серозных опухолей трудно. По-видимому, эти опухоли не являются строго очерченной нозологической единицей, а представляет собой этап в цепи постепенно малигнизирующегося эпителия трубного типа, по традиционной терминологии соответствующего высокодифференцированному раку. Параллельно с процессом нарастания атипии клеток, сменой разных клеточных клонов происходит и процесс адаптации опухолевых элементов в очагах диссеминации, формируются структуры, отражающие результат взаимоотношений между организмом опухоленосителя и опухолевыми клетками. Развивающееся при этом фиброзирование — ответ на определенную антигенность опухолевых клеток, возможно, отражение большей агрессивности клона этих клеток. В результате формирования фиброзных прослоек опухолевые клетки как бы изолированы от влияния как защитных сил организма, так и химиопрепаратов. Этим объясняются минимальная эффективность терапии и плохая выживаемость больных, у которых в очагах диссеминатов развивается фибропластическая реакция (Карселадзе А.И., 2000).
На практике нельзя ограничиваться постановкой диагноза пограничной серозной опухоли только на основании изучения первичного очага и поисков начальных признаков инвазивного роста. Необходимо микроскопическое исследование сальника, участков наиболее типичных для диссеминатов (париетальная брюшина в области пупка, диафрагмы, малого таза и др.). Такое исследование даст возможность установить степень распространения процесса (определение стадии), а характер диссеминатов и тип стромальной реакции вокруг опухолевых клеток позволяет составить максимально точное представление о прогнозе данного новообразования. В настоящее время абсолютно адекватных рекомендаций при планировании терапии больным серозными пограничными опухолями нет. Однако считается, что для молодых больных минимальным объемом хирургического лечения являются: удаление измененных придатков матки, резекция контрлатерального яичника, обязательное удаление большого сальника, множественная биопсия брюшины. Пожилым пациенткам выполняют экстирпацию матки с придатками, удаление большого сальника, биопсию брюшины. Химиотерапия, лучевая терапия, гормонотерапия при истинных пограничных опухолях яичников неэффективны.
Серозные раки составляют большинство новообразований яичников, а среди всех эпителиальных опухолей яичников — 32,7%.
Возраст больных колеблется от 17 до 73 лет. Основная группа больных находится в возрастном интервале 41–60 лет, составляя примерно 72% всех больных с серозными РЯ.
В менопаузном возрасте находилось почти 50% больных. Сроки наступления менопаузы от нескольких месяцев до 35 лет. Имеется четкая тенденция к раннему климаксу, начиная с 40 лет. Частота появления подобных больных составляет 15% всех больных менопаузного периода (Карселадзе А.И., 2000; Scully R., 1998).
Серозные раки еще в большей мере, чем их доброкачественные и пограничные аналоги, имеют склонность к двусторонности поражения. Примерно 81% больных имели опухоли в обоих яичниках. Интересно, что двусторонность вовсе не зависит от стадии процесса. Наличие массивных метастазов в брюшной полости, асцита, может быть результатом диссеминации небольшого первичного очага в яичнике, с трудом выявляемого иногда даже при микроскопическом исследовании, тогда как крупные опухоли в обоих яичниках могут не выходить за пределы органа.
Внешний вид этих опухолей разнообразен. Это могут быть кисты с тем или иным количеством сосочков как на внутренней, так и на наружной поверхности, или сóлидные опухоли. Между этими двумя полюсами выявляется большое разнообразие форм, зависящее от удельного веса кистозного и сóлидного компонентов. Для этих опухолей и является наиболее характерной известная картина «цветной капусты» с агломерацией сосочков на поверхности кист (Scully R., 1998).
В ряде случаев, даже при очень распространенном процессе, диссеминации в брюшной полости, первичная опухоль в яичниках может иметь незначительные размеры, ограничиваться лишь покровом и близлежащими к нему слоями. Поражение яичника может иметь в таких случаях вид шероховатости на поверхности яичника. Много вторичных изменений, некрозов, очагов кровоизлияний. Содержимое кист может быть и густым, слизевидным. Зависит это от продукции внеклеточной слизи, которая может в отдельных случаях накапливаться в значительных количествах.
Говорить о локализации опухоли внутри яичника трудно. Практически всегда к моменту операции опухоль целиком выполняет орган. Однако в редких случаях при небольших новообразованиях преимущественная локализация — корковый слой, поверхность яичника, ближе к латеральным его краям.
Микроскопическая структура серозных раков крайне полиморфна. Редко в какой-либо другой опухоли человека сочетается такое разнообразие структур, и, главное, с первого взгляда — вне всякой связи друг с другом. Основной клеточный элемент — мезотелиоподобные клетки, которые могут возникнуть как первично, путем анаплазии покрова яичника, так и вторично (чаще), в результате модуляции опухолевого трубного эпителия. Все многообразие микроскопической структуры может быть сведено к исходной модификации клеток, покрывающих сосочки, при слиянии которых формируются более сложные цистаденокарциноматозные и сóлидные структуры. В течение этого процесса возникают очаги, имеющие сходство с целым рядом нозологических единиц, встречающихся в яичнике, как в изолированном виде, так и в составе других опухолей. Среди указанных — структуры светлоклеточного рака, опухоли эндодермального синуса, листовидной опухоли молочной железы, гепатоцеллюлярного рака, гранулезоклеточной опухоли, карциноида, цилиндроклеточного рака, переходно-клеточного рака, менингиомы. Псаммомы встречаются в 75% серозных раков, но могут быть обнаружены и вне ткани опухоли (просвет трубы, непораженный сальник). Серозные раки тесно связаны переходами с пограничными серозными новообразованиями. Эта связь четко прослеживалась в 20% случаев (Карселадзе А.И.; 1998; Scully R., 1998).
В метастатических очагах серозного рака могут значительно превалировать структуры, представленные в первичном очаге небольшими очагами и не являющиеся характерными для всей опухоли в целом (веретенообразные, базалиоидные и др.). Прогноз серозного рака целиком зависит от стадии болезни и массы остаточной опухоли, но не определяется морфологическими особенностями. 5-летняя выживаемость при серозном раке следующая: I стадия — 76%, II стадия — 56%, III стадия — 25% и IV стадия — 9%.
Муцинозные опухоли
Муцинозные доброкачественные опухоли яичников встречаются в 9% всех эпителиальных опухолей яичников. Наибольшее число больных этой патологией группируются в интервале 41–70 лет. Минимальный возраст 15 лет. Опухоли достигают больших размеров, практически всегда односторонние, на поверхности никогда не бывает разрастаний. Лечение оперативное — односторонняя аднексэктомия.
Муцинозные пограничные опухоли яичников составляют 14% от всех муцинозных опухолей, проявляют явную тенденцию к односторонности, характеризуются клеточной и структурной пестротой. Около двух третей больных относятся к возрастному интервалу 51—70 лет. Нередко встречается патология щитовидной железы — тиреотоксикоз, рак щитовидной железы. Наряду с высокодифференцированными структурами, связанными переходами с доброкачественными фоновыми процессами, содержат элементы с выраженной дисплазией эпителия, (аналоги преинвазивного рака) и мелкие фокусы инвазивного рака. Опухолевые клетки продуцируют слизь гетерогенного состава. Клиническое течение опухолей гораздо лучше, чем при серозных аналогах. Причиной смерти могут послужить два фактора — осложнение течения болезни псевдомиксомой или генерализация по типу рака. Источником последней являются мелкие очаги инвазивного рака, пропущенные при первичной диагностике (Hart W.R., 1977). Механическое попадание слизи в брюшную полость неравнозначно псевдомиксоме брюшины. Исходя из некоторых морфологических особенностей псевдомиксомы — ангиоматоза, обилия лимфоплазмоцитарных инфильтратов и данных о том, что студневидные массы попадают в брюшную полость задолго до появления клиники заболевания, можно думать, что псевдомиксома — это своего рода гиперергическая реакция, наступающая после сенсибилизации антигеном, содержащимся в слизи опухолевых клеток. Развитие псевдомиксомы не связано со степенью злокачественности опухолевых клеток. Об этом свидетельствуют наблюдения развития псевдомиксом при абсолютно доброкачественных муцинозных кистах и отсутствия их у больных муцинозным РЯ (хотя у последних очень часто обнаруживался дефект в стенке опухоли). Таким образом, усилия по прогнозированию развития псевдомиксомы должны быть направлены в сторону изучения реактивности этих больных и тщательного биохимического анализа продуцируемой слизи. Если у больной муцинозной опухолью есть очаги малигнизации, то, независимо от их размеров и стадии болезни, процесс генерализации непредсказуем и практически наступает в ближайшие после операции годы. В этом и заключается парадоксальность прогноза при муцинозных пограничных опухолях, когда подавляющее большинство больных имеют высокую выживаемость после хирургического вмешательства (Карселадзе А.И., 1998).
Результаты 5-летней выживаемости при пограничной муцинозной опухоли составляют при I стадии — 92%, но уже при III — только 51%. Лечение типичной пограничной муцинозной опухоли — хирургическое.
Муцинозный рак — сравнительно редко встречающиеся злокачественные эпителиальные новообразования яичника (5–10% среди всех злокачественных опухолей яичников). Значительно чаще опухоли односторонние, выявляются во всех возрастных группах, представляют собой крупные кистозные образования. Микроскопическая структура вариабельна (Scully R., 1998). Вызвано это в части случаев большой долей примеси пограничного варианта. Наряду с типичными сосочковыми и сóлидными структурами опухоль может расти в виде злокачественной аденофибромы, карциноида, редко — коллоидного рака. Часть опухолей яичника, расцененных как метастаз Крукенберга, на самом деле являются муцинозными раками с большим числом дискомплексированных желез, имитирующих перстеневидноклеточный рак. Выживаемость при муцинозном раке по стадиям следующая: I стадия — 83%, II стадия — 55%, III стадия — 21% и IV стадия — 9%.
В клинической практике можно встретить редкие нозологические формы: анапластический рак в стенке муцинозной кисты и саркомоподобные гигантоклеточные опухоли брюшной полости, генетическая связь которых с муцинозными новообразованиями предположительна и требует дальнейшего изучения (Карселадзе А.И., 1989).
Эндометриоидные опухоли
Эндометриодные опухоли — это опухоли, имеющие микроскопические черты одной и/или более типичных форм эндометриальных опухолей.
Однако для начала следует вспомнить такую нередкую патологию как эндометриоз. Известны многочисленные теории происхождения эндометриоза. В литературе существует не менее одиннадцати (!) различных концепций, представляющих собой попытки дать объяснение происхождения данного заболевания. Но среди них лишь немногие по своему значению заслуживают внимания. Нельзя не согласиться, что именно к эндометриозу приложимо название «болезнь теорий». Ни одна из них не может полностью вскрыть патогенез этого заболевания и причины многообразия его локализаций (Карселадзе А.И., 1989).
В настоящее время большинство ученых считают, что эндометриоз происходит из целомического мезотелия и подлежащей стромы эндометрия. Изменилось и представление о функционировании очагов эндометриоза (Карселадзе А.И., 1989). Раньше считали, что очаг эндометриоза по строению соответствует слизистой оболочке тела матки в зависимости от менструального цикла. Сейчас только в 61% случаев доказано это соответствие. В остальных случаях имеется «неактивный» эндометриоз, похожий на базальные железы эндометрия и не реагирующий на гормональную терапию (Карселадзе А.И., 1989; Scully R., 1998).
Доброкачественные эндометриоидные очаги изучаются в соответствующих руководствах по гинекологии.
Пограничные эндометриоидные опухоли встречаются крайне редко. Чаще они являются составной частью эндометриодного рака и связаны переходными вариантами. Эти опухоли чаще односторонние, возникают в очагах эндометриоза.
Но основной интерес онкологов к эндометриозу вызван возможностью его малигнизации и возникновения эндометриодного рака. Частота малигнизации варьирует от 1% до 11,4%. Морфогенетические механизмы возникновения злокачественных опухолей в эндометриозе исследованы мало.
Эндометриодные карциномы менее кистозны, чем серозные или муцинозные карциномы. Их размеры варьируют от 2 до 35 см, большинство — от 10 до 20 см в диаметре. Более трети больных принадлежит к возрастному интервалу 51–60 лет. Среди больных с этим видом РЯ не отмечено больных с конституциональным типом, столь характерным для РТМ: сочетание ожирения, гипертонической болезни, диабета. Утверждение некоторых авторов о чувствительности опухоли к гормонотерапии спорно.
Сóлидные участки тканей от желто-коричневого до темно-красного цвета часто соседствуют с кистами или составляют основную часть опухоли. В некоторых обнаруживаются внутрикистозные папиллярные разрастания, однако папиллярные разрастания на поверхности капсулы встречаются нечасто. Плоскоклеточная метаплазия или дифференциация является характерным признаком эндометриодной карциномы, присутствующим в 25—50% всех случаев (Коржевская Е.К., 1997). Плоскоклеточная метаплазия выявляется почти в 80% случаев. Часто встречающиеся элементы — внутрижелезистые плоскоклеточные морулы или участки ороговевающего плоскоклеточного эпителия. Большинство этих опухолей возникают как плоскоклеточная карцинома (Карселадзе А.И., 1989).
Происхождение рака из эндометриодной кисты может быть доказано только в 5–10% случаев. Атипические гиперпластические изменения в эндометриозе яичников могут быть предвестниками эндометриоидных карцином. Также имеет место происхождение эндометриоидных карцином из ранее существующих цистаденом или аденофибром. При этом РЯ сочетается с карциномой эндометрия в 4% случаев. Имеющиеся данные показывают, что большинство случаев злокачественного поражения яичников и эндометрия — это раздельные, независимые первичные, синхронные опухоли, а не метастазы из одного органа в другой. Поэтому правильное стадирование эндометриоидного РЯ иногда несколько затруднено, поскольку, по классификации FIGO, не предусмотрено изменение стадии заболевания при наличии эндометриоидного рака в матке.
5-летняя выживаемость больных эндометриоидной карциномой составляет: I стадия — 78%, II стадия — 63%, III стадия — 24%, IV стадия — 6%.
Основная масса мезонефроидных (светлоклеточных) опухолей — один из вариантов эпителиальных новообразований яичника, но чаще — эндометриоидного рака. Как самостоятельная нозологическая единица — светлоклеточная опухоль представлена тремя вариантами — светлоклеточная аденофиброма, пограничная опухоль и светлоклеточный рак.
Пограничные и доброкачественные формы этой опухоли встречаются очень редко (Карселадзе А.И., 1989).
Мезонефроидный рак встречается в 5–10% наблюдений всех злокачественных опухолей яичников, в основном в возрастной группе 50–70 лет. Бесплодие наблюдается у 2/3 женщин. В 50–70% наблюдений мезонефроидный рак ассоциируется с эндометриозом и параэндокринной гиперкальциемией. Клинически мезонефроидный РЯ протекает крайне злокачественно. Отмечена его низкая чувствительность к проводимой лекарственной и лучевой терапии. Возникающие рецидивы заболевания быстро приводят к летальному исходу. Выживаемость при светлоклеточном раке составляет: I стадия — 69%, II стадия — 55%, III стадия — 13% и IV стадия — 4%.
В яичниках встречаются опухоли, точный гистогенез которых установить крайне трудно. К ним относятся недифференцированные и неклассифицируемые РЯ. В рамках настоящего руководства ограничимся рассмотрением проблем, возникающих при верификации опухолей, эпителиальность которых не вызывает сомнений. Необходимо подчеркнуть одно важное обстоятельство. В процессе диагностики подобных новообразований решающее значение могут иметь клинические данные. Большое значение имеет также форма распространения опухоли, отношение диссеминатов к серозным покровам, к капсуле печени и др.
Выделено 3 типа опухолей этой группы.
Первый тип — наименее дифференцированные новообразования, близкие к мезотелию, связанные с покровом яичника — так называемые мезотелиомы яичника. Иногда в этих опухолях проявляется тенденция к рекапитуляции отдельных черт эмбрионального мезотелия.
Второй тип — сóлидные опухоли с саркомоподобными участками из веретенообразных клеток с примесью гигантских многоядерных клеток.
Третий тип — формально зрелые опухоли. Это обычно сосочковые раки с тем или иным количеством железисто-сóлидных участков. Однако, несмотря на кажущуюся зрелость, признаки определенной дифференцировки не обнаруживаются даже с помощью ультраструктурных и гистохимических методов исследования.
По-видимому пока не появятся другие, более специфичные маркеры дифференцировки, в подобных случаях лучше ставить диагноз “рак” без указания гистогенеза и давать описание структур. Тем более, что, судя по данным мировой литературы, именно таков подход к этим новообразованиям.
Опухоли Бреннера составляют 1–2% всех опухолей яичников и чаще бывают односторонними (левосторонние).
У больных с типичной доброкачественной и пограничной опухолью Бреннера прогноз абсолютно благоприятный, после операции наступает выздоровление. Каких-либо особенностей менструальной функции и акушерского анамнеза не отмечено. Основная масса больных находится в менопаузе. Ведущий симптом — наличие опухоли и кровянистые выделения из половых путей. В 2% наблюдений встречаются злокачественные формы заболевания, которые растут обычно в пределах одного яичника. Понятие опухоль Бреннера включает в себя новообразования разной степени дифференцировки. Структурной специфичностью обладает лишь доброкачественный вариант, состоящий из 2 компонентов — эпителиальных гнезд и клеточной стромы. Злокачественную опухоль Бреннера вообще следует расценивать как диморфный рак, в котором железистый компонент представлен переходно-клеточными структурами с признаками внутриклеточного слизеобразования, однако при этом сохраняются типичные структуры опухоли Бреннера. Допустима аналогия между морфогенезом ряда структур опухоли Бреннера и процессами пролиферации и эпидермизации резервных клеток в цервикальном канале в том смысле, что сочетание муцинозных кист яичников с гнездами опухоли Бреннера — по существу единый процесс, механизм которого требует дальнейших исследований. Злокачественная опухоль Бреннера поражает в основном пациенток пожилого возраста.
Рекомендуемое лечение включает радикальную операцию в объеме экстирпации матки с придатками, удалении большого сальника, проведении полихимиотерапии с включением препаратов платины. Некоторые авторы дополняют лечение лучевой терапией. Однако единой тактики для лечения этой патологии до настоящего времени не выработано. Прогноз при малигнизации обычно неблагоприятный, 3-летняя выживаемость составляет 43%.
Опухоли стромы полового тяжа
Эта категория новообразований, которые составляют примерно 8% из всех первичных опухолей яичников, включает в себя клетки гранулезы, тека-клетки, клетки Сертоли и Лейдига, фибробласты стромального происхождения. Все эти варианты клеточных структур встречаются как в чистом виде, так и в различных комбинациях и пропорциях (Scully R., 1998).
Гранулезоклеточные опухоли яичников являются самыми частыми среди гормонопродуцирующих новообразований яичников и составляют от 1 до 4% наблюдений. Согласно модифицированной классификации в группе гранулезоклеточных опухолей на основании некоторых клинико-морфологических особенностей выделено 2 типа опухолей — взрослый и ювенильный.
Опухоли взрослого типа встречаются гораздо чаще — до 95% по сравнению с ювенильной формой. Поражаются в основном женщины в возрасте 50—55 лет. Обычно это односторонние опухоли, размерами от микроскопических до занимающих практически всю брюшную полость. В 10—15% наблюдается повреждение капсулы. Диссеминируют по брюшной полости, отдаленные метастазы достаточно редки. В отличие от других злокачественных форм опухолей яичников рецидивы развиваются поздно. Описаны случаи рецидивов заболевания через 5, 10 и даже 25 лет после первичного лечения.
Гистогенез гранулезоклеточной опухоли яичников недостаточно ясен, однако показано, что гранулеза в атретических фолликулах может пролиферировать. Большинство гранулезоклеточных опухолей продуцируют эстрогены, что обуславливает яркую клиническую картину, благодаря которой большинство новообразований выявляются в I стадии. У женщин репродуктивного возраста отмечаются нарушения менструального цикла: гиперполименорея, аменорея, аменорея с последующими ациклическими кровянистыми выделениями или кровотечением. Зачастую в репродуктивном возрасте при явлениях аменореи врачами женских консультаций ставится диагноз «беременность» или «ранний климакс», а в пременопаузе данная симптоматика трактуется как проявления «дисфункции яичников климактерического периода». В постменопаузе отмечаются ациклические кровянистые выделения различной интенсивности, естественно, заставляющие клинициста подозревать рак эндометрия. Клиническая картина гиперэстрогении проявляется также симптомами «омоложения» (сказывается на внешнем облике пациенток). Отмечается хороший тургор кожи, повышение либидо, нагрубание молочных желез, отсутствие инволютивных изменений молочных желез и гениталий (сочные розовые слизистые, хорошо выраженная складчатость влагалища, наличие III-IV типа реакции влагалищного мазка по Грейсту — Салмону, иногда симптом «зрачка», матка несколько больше возрастной нормы). Некоторые авторы отмечают: чем старше возраст пациентки, тем ярче выражена клиническая картина «омоложения» (Bridgewater J., Rustin G., 1999).
В литературе имеются описания случаев продукции гранулезоклеточной опухолью одновременно эстрогенов и прогестерона. Кроме стероидных гормонов, гранулезоклеточные опухоли вырабатывают ряд гликопротеидов. В частности, ингибин и мюллеровскую ингибирующую субстанцию. Информация о том, что в норме источником ингибина являются клетки фолликулярного эпителия яичников, привела к исследованию вопроса о выработке ингибина гранулезными клетками одноименной опухоли. Результаты иммуногистохимических исследований последних лет с МКА к ингибину показали: гранулезоклеточные опухоли как взрослого, так и ювенильного типа, а также их рецидивы и метастазы, экспрессируют ингибин, что может быть полезно для проведения дифференциальной диагностики между гранулезоклеточной опухолью и карциноидом, дисгерминомой, мелкоклеточным раком с гиперкальцемией и др. Однако экспрессия ингибина характерна и для других типов опухолей стромы полового тяжа яичников, и в меньшей степени — для различных типов аденокарцином яичников (муцинозных и серозных). Асцит при гранулезоклеточных опухолях яичников часто не содержит клеточных элементов и представляет собой транссудат, патогенез возникновения которого подобен таковому при синдроме Мейгса. Необходимо отметить, что спонтанный разрыв капсулы новообразования с возникновением клиники внутрибрюшного кровотечения не редкость и по данным некоторых авторов имеет место в 10—12% наблюдений.
Благодаря наиболее частому выявлению заболевания на ранних стадиях, первым этапом лечения, за редким исключением, является операция, объем которой до сих пор вызывает прения. На IA стадии заболевания у женщин репродуктивного возраста (до 40 лет), при отсутствии клинических проявлений и морфологических признаков злокачественности, минимальным и в то же время вполне достаточным объемом оперативного вмешательства является удаление придатков матки на стороне поражения. Учитывая в целом низкую степень злокачественности опухоли и поздние сроки возникновения рецидивов, это оправдано, т.к. позволяет женщине сохранить фертильность и реализовать репродуктивную функцию. При наличии сопутствующей патологии гениталий (миома матки, гиперпластические процессы в эндометрии, патология шейки матки), особенно в пери— и постменопаузе, необходимо удалять матку с придатками с обеих сторон.
При наличии клинических и морфологических признаков злокачественности, разрывов опухоли, более распространенном процессе, необходимо удаление матки с придатками с обеих сторон, дополненное резекцией большого сальника. Учитывая преимущественное возникновение рецидивов и метастазов из имплантатов опухолевых клеток (67%), на наш взгляд, нет необходимости в дополнительном выполнении подвздошной и парааортальной лимфаденэктомии.
Что касается тактики лечения рецидивных и метастатических опухолей, то благодаря их склонности к медленному оппонирующему росту, в ряде случаев с успехом применяются повторные операции. Иногда только оперативное удаление рецидива излечивает больных на длительный срок. С другой стороны, сам факт возникновения повторных рецидивов гранулезоклеточной опухоли яичников взрослого типа свидетельствует о недостаточности только хирургического лечения. Вопрос о проведении адьювантной химиотерапии большинством авторов решается в пользу последней по схемам PVB или VBC. Схемы химиотерапии представлены в табл. 6.
Таблица 6
Схемы химиотерапии
| Комбинация | Лекарственное средство, доза и режим лечения |
| PVB или VBC | Винбластин — по 3 мг/м2 в/в в 1 и 2 дни, Блеомицин — по 15 мг/м2 (максимально — по 20 мг) непрерывной в/в инфузией в течение 24 ч в 1, 2, 3 дни Цисплатин — по 20 мг/м2 в/в капельно в 4, 5, 6, 7 и 8 дни. Циклы повторяют каждые 3 нед. Всего 6 циклов |
| VPIC | Этопозид — по 100 мг/м2 в/в капельно в 1-3 дни, Ифосфамид — по 1500 мг/м2 в/в капельно в 1-5 дни, Месна (в стандартном режиме), Цисплатин — по 20 мг/м2 в/в капельно в 1-6 дни. Циклы повторяют каждые 3 нед. Всего 6 циклов |
| VI | Этопозид — по 100 мг/м2 в/в капельно в 1-3 дни, Ифосфамид — по 1500 мг/м2 в/в капельно в 1-5 дни |
| BEP | Блеомицин — по 30 мг в/в или в/м 1 раз в течение 12 нед, Этопозид 100 мг/м2 в/в капельно в 1-5 дни, Цисплатин — по 20 мг/м2 в/в капельно в 1-5 дни. Циклы повторяют каждые 3 нед. Всего 6 циклов |
| Цисплатин — по 20 мг/м2 в/в в 1-5 дни, Этопозид — по 100 мг/м2 в/в в 1, 5 дни, Блеомицин — по 30 мг/м2 в/в в 1, 3, 5 дни. Циклы повторяют каждые 3 нед. Всего 4-6 циклов |
|
| Винбластин — по 4 мг/м2 в/в в 1 день, Дактиномицин — по1 мг/м2 в/в капельно в 1 день, Блеомицин — по 30 мг в/в в 2-4 дни Циклофосфамид — по 600 мг/м2 в/в в 1 день. Цисплатин — по 100 мг/м2 в/в капельно в 4 день |
|
| VIP | Ифосфамид — по 1,2 г/м2 в/в в 1-5 дни, Винбластин — по 4 мг/м2 в/в в 1, 2 дни, Цисплатин — по 20 мг/м2 в/в в 1-5 дни |
Большие разногласия вызывает использование облучения при комбинированном и комплексном лечении пациенток. Целесообразность послеоперационного облучения признается далеко не всеми. До настоящего времени не существует четких критериев назначения лучевой терапии при наличии данной опухоли. Однако, в случае отсутствия эффекта от лекарственного лечения остаточных опухолей, а также рецидивов и метастазов гранулезоклеточных опухолей яичников с паллиативной целью может быть рекомендована лучевая терапия. Гормональная терапия гранулезоклеточных опухолей яичников считается малоэффективной.
Группа теком и фибром
Текома — стромальная опухоль, состоящая из липидных клеток, схожих с клетками theca interna и содержащая около 10% гранулезных клеток. Типичная текома составляет 1/3 всех гранулезоклеточных опухолей яичников. В 85% наблюдаются у пациенток в постменопаузе и в 10% — у больных моложе 30 лет. Более чем в 50% случаев это — эстрогенпродуцирующая опухоль, часто сочетающаяся с аденокарциномой эндометрия, реже — с эндометриоидными саркомами и смешанными мюллеровскими опухолями матки. Лютеинизирующие текомы могут быть гормонально неактивными, а в 11% случаев синтезируют андрогены. При этом маскулинизация в связи с наличием достаточного количества ароматаз, трансформирующих андрогены в эстрогены, наблюдается редко.
Текома — опухоль в подавляющем числе наблюдений односторонняя, достигающая размеров от непальпируемых до 5—10 см. На разрезе — желтая, с некрозами и кровоизлияниями. Значительная кальцификация ткани опухоли наблюдается у молодых больных.
Адекватным методом лечения, но при обязательном исследовании эндометрия, считается односторонняя аднексэктомия. Пожилым больным производится экстирпация матки с придатками. Большинство так называемых “злокачественных теком” (около 7%) представлены гормонально неактивными фибросаркомами или диффузными гранулезоклеточными опухолями. Очень редко митотически активные типичные и лютеинизирующие текомы могут метастазировать в отдаленные органы и ткани. При диссеминированных формах прогноз неблагоприятный.
Фибромы составляют около 4% всех опухолей яичников. Средний возраст больных — 48 лет. В 90% наблюдений односторонняя опухоль, размером в среднем 6 см. На разрезе опухоль плотная, гладкая, мелового цвета. Может ассоциироваться с синдромами Мейгса и Горлина. Лечение хирургическое. В молодом возрасте можно ограничиться односторонней аднексэктомией, в пожилом необходима экстирпация матки с придатками. Прогноз благоприятный. В случае обнаружения фибросаркомы рекомендуется дополнить лечение химиотерапией по схеме ВЕР.
Опухоли из клеток Сертоли и Лейдига. Андробластома поражает в основном молодых пациенток. Доброкачественные опухоли содержат незначительное количество клеток Сертоли и Лейдига в различных пропорциях. В 40% случаев отмечается повышенный синтез андрогенов с соответствующими клиническими признаками.
Опухоль чаще сóлидная, односторонняя, размеры обычно не превышают 5 см, после операции клинические проявления андрогенемии регрессируют.
Умеренно дифференцированная опухоль достигает несколько бóльших размеров. Заболевание протекает доброкачественно.
Низкодифференцированная опухоль, схожая с саркомой, чаще односторонняя, кистозно-сóлидная с некрозами и кровоизлияниями, размеры более 15 см. Отмечается значительное количество митозов.
При смешанной форме у 28% больных отмечается андрогенемия. Опухоль содержит элементы эндодермального и мезодермального происхождения.
Тактика лечения зависит от возраста больной, целостности капсулы, стадии заболевания и степени дифференцировки опухоли. У молодых женщин чаще (98%) поражается один яичник, поэтому правомочна односторонняя аднексэктомия. Радикальная операция и адъювантная химиотерапия (VAC) показаны при распространенных стадиях, низкой дифференцировке опухоли, наличии мезенхимальных элементов, а также при разрывах капсулы умеренно дифференцированной опухоли.
В отличие от гранулезоклеточной опухоли, которая может рецидивировать через много лет, злокачественные опухоли из клеток Сертоли и Лейдига в 66% наблюдений рецидивируют в первый же год. При лучевой терапии на малый таз в дозе 50–60 Гр 5-летняя выживаемость достигает 75% при I стадии, а при II и III — 50%.
Гинандробластома. Диагноз может быть поставлен только при явном наличии в гистологическом препарате нормальных клеток яичника на фоне малигнизированных тканей. При комбинации ювенильной гранулезоклеточной опухоли и опухоли из клеток Сертоли — Лейдига вместе с диагнозом гинандробластома всегда указываются и компоненты опухоли. Опухоль обычно встречается у молодых женщин, диагностируется в I стадии, манифестирует на фоне андроген— или эстрогенемии. При правильном стадировании, после односторонней аднексэктомии заболевание протекает доброкачественно. В случае диссеминированного процесса лечение проводится, как при других опухолях стромы полового тяжа, (радикальная операция с последующей полихимиотерапией).
Неклассифицируемые опухоли стромы полового тяжа (достаточно редкая патология, встречающаяся в 5–10% из всей группы опухолей стромы полового тяжа), являются промежуточной формой между гранулезоклеточной опухолью и опухолью из клеток Сертоли — Лейдига. Данные мировой литературы по лечению данной патологии крайне скудны. Тактика лечения идентична таковой при гранулезоклеточной опухоли яичников.
Липидноклеточные (липоидноклеточные) опухоли (Steroid cell tumors). Название данной группы связано с целым рядом опухолей по своему клеточному составу схожих с клетками, являющимися продуцентами стероидных гормонов (лютеиновыми, Лейдига, кортико-адреналовыми и др.). Термин «липидноклеточные» (опухоли) не является правильным и специфичным в связи с тем, что около 25% этих опухолей могут быть вообще не содержать липидов.
Стромальная лютеома в 80% возникает в постменопаузе. Основным клиническим проявлением заболевания в 60% наблюдений является маточное кровотечение, связанное с эстрогенемией. Влияние андрогенов выявляется примерно в 12% случаев. Течение заболевания доброкачественное.
Стероидно-клеточные опухоли (not other specified) встречаются в 60% наблюдений, чаще односторонние. Лечение — при IA стадии — только оперативное. Однако в 20% наблюдений отмечается выход опухоли за пределы яичника, требующий радикальной операции. Химиотерапия и лучевая терапия обычно неэффективны.
Герминогенные опухоли яичника составляют 2–3% всех злокачественных опухолей этой локализации и возникают у подростков или молодых женщин. Средний возраст заболевших составляет около 20 лет. Это очень агрессивное заболевание, которое при неправильной тактике лечения приводит к быстрой генерализации процесса и смерти. Вместе с тем высокая чувствительность опухоли к химиотерапии с включением производных платины коренным образом изменила прогноз больных и позволила добиться полного излечения у большинства заболевших.
Клинически важно разделение герминогенных опухолей яичника на дисгерминомы и недисгерминомы (эмбриональный рак, тератомы различной степени зрелости, опухоли желчного мешка, хорионкарциномы и смешанные варианты вышеперечисленных морфологических типов).
В отличие от недисгермином дисгерминома, как и семинома у мужчин, имеет более доброкачественное течение и высокую чувствительность к химиотерапии и лучевой терапии.
Герминогенные опухоли яичника возникают у девочек-подростков и молодых женщин, поэтому следует проявлять онкологическую настороженность при возникновении перечисляемых ниже жалоб и симптомов.
Обычно первыми признаками заболевания являются боли внизу живота и наличие пальпируемой опухоли в малом тазу. Примерно у 10% пациенток интенсивные боли внизу живота обусловлены перекрутом ножки опухоли яичника или внутрибрюшным кровотечением из распадающейся опухоли. В этом случае диагноз, как правило, устанавливается при проведении экстренной лапаротомии. Реже заболевание сопровождается моточными кровотечениями и лихорадкой.
Герминогенные опухоли яичника продуцируют опухолевые маркеры, в частности альфа-фетопротеин (АФП) и хорионический гонадотропин (ХГ), в норме синтезируется клетками паренхимы печени и желточного мешка плода. У взрослых лиц повышение концентрации АФП свидетельствует о патологии, в частности, о наличии гепатоцеллюлярного рака или герминогенной опухоли яичка или яичников. По данным различных авторов, повышенное содержание ХГ в крови определяется у 20–40% больных герминогенными опухолями яичника. Повышение концентрации ХГ более 104 нг/мл чаще всего обусловлено значительным распространением опухолевого процесса и присутствием в опухоли элементов хорионэпителиомы, что коррелирует с плохим прогнозом.
Большое значение в диагностике и мониторинге больных герминогенными опухолями яичника имеет определение АФП и ХГ. Обнаружение АФП или ХГ в крови у пациентки с наличием объемного образования в яичнике указывает на герминогенное происхождение опухоли. Повышение уровня АФП при дисгерминоме указывает на присутствие других морфологических вариантов герминогенных опухолей, и в этом случае следует рассматривать опухоль как недисгерминому. Динамика уровней маркеров в процессе лечения позволяет судить об эффективности терапии. Повышение уровня маркеров после окончания лечения указывает на рецидив заболевания и само по себе, даже при отсутствии других проявлений болезни, является показанием к проведению химиотерапии.
При обнаружении опухолевого образования в яичнике у девушки или молодой женщины следует в первую очередь думать о наличии герминогенной опухоли яичника. Определение показателей АФП, ХГ, а кроме того — уровня ЛДГ крови — гарантируют безошибочность диагноза. Однако следует помнить, что у 40% больных герминогенными опухолями яичников концентрация маркеров в крови не превышает норму. При подозрении на наличие герминогенной опухоли яичника в комплекс исследования должны входить рентгенография органов грудной клетки, РКТ и/или УЗТ органов брюшной полости, малого таза и забрюшинного пространства, которые в комплексе позволяют оценить степень распространенности опухолевого процесса.
Классификация герминогенных опухолей яичника по стадиям производится согласно классификации FIGO, используемой для стадирования РЯ. При отсутствии явных клинических признаков наличия опухолевого процесса вне яичников правильно установить стадию заболевания позволяет лапаратомия.
Дисгерминома по своему гистогенезу является аналогом семиномы у мужчин и протекает более доброкачественно, чем другие герминогенные опухоли яичника. Дисгерминома — наиболее частый вариант из всех герминогенных опухолей яичника. Частота возникновения составляет примерно 1% от всех опухолей яичников. Средний возраст пациенток — 20 лет. 2/3 пациенток в момент постановки диагноза имеют I стадию заболевания, при которой опухоль локализуется в одном или в двух (10% больных) яичниках, не распространяясь на органы малого таза, брюшину и т.д. Основной путь метастазирования дисгермином — лимфогенный, в лимфатические узлы забрюшинного пространства. Очень редко, как правило, в далеко зашедших случаях, имеет место гематогенное метастазирование с поражением легких, печени. Диагностическим тестом принято считать определение ЛДГ в сыворотке крови, повышение уровня которой отмечается у 95% больных и коррелирует с размерами опухоли, распространенностью заболевания, эффективностью проводимого лечения, появлением рецидива. Не менее важным является определение также ХГ и АФП. Молодым больным в репродуктивном периоде с IА стадией процесса показана односторонняя аднексэктомия. При IВ стадии, когда имеется заинтересованность второго яичника, при возможности производится резекция контралатерального яичника. Во время операции проводится тщательная ревизия органов брюшной полости, ревизия забрюшинного пространства, исследуются смывы из брюшной полости. При истинной IA стадии следует рекомендовать наблюдение больных под строгим контролем показателей маркеров, УЗТ и КТ. Необходимо отметить достаточно высокую частоту рецидивов заболевания — 15–25%. При IB и IC стадиях целесообразно проведение не менее 3 курсов химиотерапии PVB или ВЕР. В случае повышения уровней маркеров у больных в течение 3–4 нед послеоперационного периода, необходимо данный контингент пациенток рассматривать как больных с более распространенным процессом и рекомендовать соответствующее лечение. При II, III, IV стадиях заболевания на первом этапе производится односторонняя аднексэктомия с удалением всех визуализируемых опухолей брюшной полости. При невозможности сохранения яичников производится радикальная операция — экстирпация матки с придатками, удаление большого сальника. Далее проводится 3 курса химиотерапии ЕР/PVB. Во всех остальных случаях проводится 4 курса индукционной химиотерапии BEP/PVB. При неэффективности проводимой терапии назначаются препараты 2-й линии VAB–6/VIP.
При частичной регрессии, стабилизации и рецидивах заболевания может быть рекомендована достаточно эффективная локальная лучевая терапия.
Опухоль желточного мешка (опухоль эндодермального синуса) — вторая по частоте герминогенная опухоль после дисгермином, растущая из недифференцированных и мультипотентных эмбриональных карцином. Средний возраст пациенток — 19 лет. Часто компонентом являются смешанные герминогенные опухоли с включением микроцист, миксоматоза, клеток эндодермального синуса, гепатоидных и папиллярных клеток, телец Шиллера-Дюваля. Отмечается повышение АФП, причем уровень маркера более 1000 нг/мл является патогномоничным для данной опухоли. Описаны случаи повышения уровней СА 125 и раково-эмбрионального антигена (РЭА). Типично поражение правого яичника, опухоль может достигать больших размеров. На разрезе коричнево-желтого цвета. Метастазирует лимфогенно в забрюшинные лимфоузлы, а также в легкие, печень и другие органы. Прогноз при I стадии благоприятный, однако при диссеминированном процессе после операции и химиотерапии выживаемость достигает лишь 50%. Описаны наблюдения, при которых на фоне проводимого лечения опухоль переставала синтезировать АФП, что значительно затрудняло мониторинг заболевания. Многокомпонентная опухоль прогностически более злокачественна. При IA стадии возможна односторонняя аднексэктомия у молодых женщин для сохранения репродуктивной функции. Применяемая послеоперационная химиотерапия PVB/BEP повышает выживаемость больных до 90%.
Эмбриональная карцинома считается наименее дифференцированной герминогенной опухолью яичников. Поражает пациенток от 4 до 28 лет, в половине случаев в пубертатном периоде. Клинически манифестирует нерегулярными менструациями, аменореей, гирсутизмом. Часто развивается с другими герминогенными опухолями, особенно с опухолью желточного мешка. При лапаротомиях в 40% наблюдений отмечается диссеминация по брюшной полости. Опухоль метастазирует в паренхиматозные ткани. Без проведения послеоперационной химиотерапии при I стадии выживаемость достигает лишь 50%. Опухоль продуцирует ХГ несколько реже чем АФП, оба маркера используются в мониторинге. Очень высокий митотический уровень. Одностороннее удаление пораженного опухолью яичника повышает риск летального исхода. Рекомендуемое лечение — радикальная операция с последующей химиотерапией PVB/BEP.
Полиэмбриома — опухоль, характеризующаяся преобладанием эмбриональных телец, которые схожи с нормальным эмбрионом, в различные сроки его развития. Часто сочетается с незрелой тератомой. Очень редкая опухоль. Пациентки — обычно дети и молодые женщины. Частота определения ХГ и АФП в сыворотке больных низкая. При истинной IA стадии возможна односторонняя аднексэктомия с последующим лекарственным лечением (PVB/BEP) под контролем показателей маркеров. Определенной тактики ведения больных с запущенным процессом не выработано. Необходимо отметить, что после проведенного лечения рецидивы заболевания могут быть представлены зрелой тератомой.
Хориокарцинома — также крайне редкое заболевание, характеризуется наличием цитотрофобласта и/или переходными формами трофобласта, а также синтициотрофобласта. Заболевание не связано с беременностью, составляет около 1% от всех герминогенных опухолей яичников. Является одним из компонентов смешанных герминогенных опухолей яичников. Часто не представляется возможным дифференцировать эту опухоль от метастатического поражения при трофобластических опухолях матки. Несколько облегчает эту задачу определение отцовских антигенов и наличие игрек—хромосомы. Заболевают чаще дети и молодые женщины. Симптоматика очень напоминает трубную беременность — кровянистые выделения, боли. Комбинированная химиотерапия идентичная таковой при лечении других герминогенных опухолей. Использование препаратов, традиционно применяемых при лечении трофобластических опухолей матки (метотрексат, дактиномицин) неэффективно.
Смешанные герминогенные опухоли яичников — в их состав может входить два и более вариантов герминогенных опухолей: дисгерминома, опухоли желточного мешка, эмбриональная карцинома, тератомы и т.д. Очень редкая форма бластоматозного процесса. Клиническое течение заболевания связано с наличием в опухоли того или иного компонента тканей. Но с другой стороны, не было выявлено корреляции между составом опухоли и ее поведением после проведенной операции и полихимотерапии.
Тератома — достаточно редко встречающаяся опухоль. Зрелая тератома, дермоидная киста, фетиформная тератома (гомункулюс) — доброкачественные формы, излечивающиеся хирургическим путем. Правда, необходимо подчеркнуть данные о крайне редких (0,2%) наблюдениях озлокачествления последних.
Для онкологов представляют интерес незрелые тератомы, которые составляют около 1% всех злокачественных опухолей яичников. На разных этапах развития заболевания в опухолевой ткани может возникнуть новый компонент — как в виде любого варианта злокачественной герминогенной опухоли, так и в виде новообразований, характерных для соматических тканей — саркома, рак, злокачественная нейрогенная опухоль. Средний возраст больных — 21 год. Размеры опухоли обычно достаточно большие — до 20 см. Более чем в 60% наблюдений в сыворотке больных определяется АФП. Несколько реже — ХГ; СА 125; СА 19–9; РЭА. Незрелые тератомы яичников рецидивируют в 40% наблюдений, диссеминируют по париетальной и висцеральной брюшине в 25% случаев, метастазируют в 18,5% наблюдений в печень, легкие, кости. В сочетании с герминогенными опухолями более чем в 50% наблюдений метастазируют в лимфоузлы, печень, легкие.
В основную группу монодермальных тератом (высокоспециализированных) входят: струма яичника, карциноид, струма — карциноид, нейроэктодермальная опухоль и др.
Струма яичника — тератома, которая полностью представлена тканью щитовидной железы, либо является одним из ее компонентов. Частота около 5%. Заболевают в основном женщины пятой декады, хотя описаны единичные случаи возникновения опухоли у девочек и женщин в глубокой менопаузе. В одной трети наблюдений у больных определялся асцит. Синтез тиреоидных гормонов отмечен в 5% наблюдений, причем визуализация новообразования (также как и терапия) возможна накоплением в опухоли 131 J. Часто сочетается с дермоидными кистами и карциноидом. На разрезе обычно имеет кистозно-сóлидную структуру с муцинозным содержимым от коричневого до зеленого цвета. Несмотря на то, что в 5–10% случаев опухоль малигнизируется, только у половины этих больных отмечается диссеминация процесса с метастазированием по брюшной полости, в легкие, печень, лимфоузлы, кости, головной мозг, средостение.
Карциноид в большинстве своем представлен клетками, идентичными клеткам ЖКТ. “Чистые” опухоли встречаются достаточно редко и ассоциируются в 90% наблюдений с другими формами тератом.
Инсулярный тип карциноида встречается в 75% наблюдений, возраст больных колеблется от 30 до 80 лет.
У 1/3 пациенток отмечается карциноидный синдром: приливы крови к лицу, которые практически всегда ошибочно принимаются у женщин в менопаузе за естественное состояние, поносы, шумы в связи с недостаточностью трикуспидального клапана, стеноз легочных артерий. Типичным является повышение уровня 5-гидроксииндоловой кислоты в моче, реже — повышение кальцитонина в сыворотке крови, а также, при наличии у больных инсулярной и трабекулярной формы карциноида, гиперинсулинемическая гипогликемия. В 15% наблюдений в контралатеральном яичнике обнаруживаются опухоли Бреннера, муцинозные опухоли, дермоидные кисты.
Нейроэктодермальные опухоли. Эти новообразования очень напоминают злокачественные опухоли ЦНС, начиная от анаплазированных до достаточно дифференцированных глиом. Опухоли визуально вариабельны, встречаются как сóлидные, так и кистозные формы от 5 до 20 см в диаметре. Разнообразна и цветовая гамма: опухоли бывают коричневые, розовые, желтые с кровоизлияниями и некрозами. Часто в контралатеральном яичнике развиваются дермоидные кисты. На ранних стадиях прогноз после операции благоприятный.
Больным незрелыми тератомами яичников следует выполнять органосохраняющие операции в объеме удаления придатков матки, резекцию противоположного яичника со срочным гистологическим исследованием и удаление большого сальника. После оперативного лечения всем больным незрелыми тератомами яичника независимо от стадии заболевания и степени зрелости опухоли показана химиотерапия — 4–6 курсов PVB/BEP.
Группа смешанных герминогенных опухолей и опухолей полового тяжа яичников характеризуется наличием герминогенных клеток, а также клеток стромы полового тяжа, схожих с незрелыми гранулезными и незрелыми клеткам Сертоли. Часто сочетание с клетками, похожими на лютеиновые или клетки Лейдига. Опухоли этой группы подразделяются на две категории: гонадобластомы и неклассифицированные гетерогенные новообразования.
Гонадобластома состоит из герминогенных клеток, напоминающих незрелый половой тяж. Определяются многочисленные очаги (гнезда) клеток Лейдига и лютеиновых клеток. Заболевание часто встречается у больных с нарушенным половым развитием, наличием в кариотипе игрек—хромосомы. Болеют в основном дети — 1/3 больных в возрасте до 15 лет. Клиническая картина включает вид больной, наличие опухоли в брюшной полости, патологический тип синтеза стероидных гормонов и развития гонад, нарушение развития вторичных половых признаков. Всегда трудно определить, какой вид гонад превалирует в опухоли. “Чистая” гонадобластома обычно небольшого размера — до 8 см, однако в 25% наблюдений макроскопически может быть неопределима. Следует отметить поражение гонадобластомой контралатерального яичника (1/3 наблюдений). Опухоль в основном считается доброкачественной, если в ней не присутствует инвазивный герминогенный компонент. Лечение сводится к двусторонней овариэктомии. В редких случаях можно ограничиться только удалением опухоли (при условиях нормального кариотипа и нормального полового развития больной).
В категорию неклассифицируемых опухолей полового тяжа входят новообразования с наличием герминогенных элементов, клеток полового тяжа, иногда лютеиновых и лейдигоподобных клеток, но при отсутствии типичной для гонадобластомы картины. Заболевание поражает детей до 10 лет с нормальным кариотипом и половым развитием. Обычно эти опухоли протекают доброкачественно, но описаны редкие наблюдения диссеминированных форм.
Первичные неспецифичные овариальные опухоли. Очень редкие формы заболевания.
Лейомиома в 80% наблюдений встречается в постменопаузе и чаще является случайной находкой. Клинически может проявиться синдромом Мейгса. Морфологически очень напоминает лейомиому маточного происхождения.
Известны немногочисленные наблюдения лейомиосарком, их миксоидного варианта, фибросарком, лимфангиосарком, рабдомиосарком. Очень редко встречаются даже остеосаркомы, развивающиеся из смешанной мезодермальной опухоли, незрелой тератомы, гетерогенной опухоли Сертоли — Лейдига, а также из дермоидной кисты.
Мелкоклеточная карцинома (гиперкальцемический тип) — низкодифференцированная опухоль, которая часто ассоциируется с гиперкальцемией. Поражает пациенток от 2 до 45 лет, часто носит наследственный характер. Обычно опухоль двусторонняя, рано диссеминирует. Мелкоклеточная карцинома с параэндокринной гиперкальцемией протекает злокачественно даже при ранних стадиях процесса. Прогностически благоприятными факторами являются: IА стадия, возраст пациенток более 30 лет, опухоль размером менее 10 см, нормальный уровень кальция в крови до операции, радикальная операция и послеоперационная лучевая терапия.
Мелкоклеточная карцинома (легочный тип) — микроскопически типичный мелкоклеточный рак легких. Заболевание встречается в любом возрасте. Обычно двусторонняя опухоль с диссеминацией процесса по брюшной полости. Трудноотличима от метастатического поражения. Прогноз неблагоприятный.
Гепатоидная карцинома — сходное с гепатоцеллюлярным раком и гепатоидной опухолью желудка новообразование, отличительной чертой которого является отсутствие синтеза АФП. В мире описано мало случаев заболевания. Поражает женщин в основном в постменопаузе. Трудно дифференцировать с метастатическим поражением.
Злокачественные мезотелиомы — перитонеальная высокодифференцированная папиллярная и диффузная формы — опухоли, которые при диссеминации по брюшной полости, часто выглядят как типичный РЯ. Правильный диагноз злокачественной формы мезотелиомы устанавливается на основании морфологического, гистохимического и иммуногистохимического исследований.
Метастатическое поражение яичников
Вторичные (метастатические) опухоли яичников встречаются достаточно часто и составляют, по данным различных авторов, от 4,3 до 63%. Столь значительные расхождения свидетельствуют о далеко неполной выявляемости метастазов даже при целенаправленном обследовании больных. Часть авторов диагноз метастатического поражения яичников основывали на данных аутопсий, а часть только клинически. С другой стороны, зная о чрезвычайном полиморфизме опухолей яичников, нельзя не указать на первичные новообразования, маскирующиеся под видом метастазов из других органов и тканей. Кроме того, часто в исследования были включены несравнимые группы больных, хотя бы по стадиям заболевания. Объективно подходя к этому вопросу, следует отметить, что вероятность вторичного поражения яичников составляет около 7%.
Опухоли Крукенберга составляют большинство (70%) метастазов из ЖКТ. Обычно опухоли двусторонние (80%), белесовато-желтого цвета, плотного или сóлидно-кистозного характера. Метастазы в яичники при раке кишечника встречаются примерно в 4% наблюдений, двустороннее их поражение отмечается примерно в 60% случаев.
Истинный карциноид чаще всего поражает оба яичника. Возраст женщин самый разный — от 20 до 80 лет. Опухоль визуально беловато-желтого цвета, похожа на фиброму или текому яичника. Часто метастатический карциноид можно принять за гранулезоклеточную опухоль взрослого типа, опухоль Сертоли-Лейдига, опухоль Бреннера, аденофиброму. Встречается т.н. карциноидный синдром, связанный с инкрецией серотонина из клеток Кульчицкого.
При раке ПЖ частота метастазов в яичники не превышает 10%. Чаще эти опухоли двусторонние, большие, кистозного характера. Визуально схожи со злокачественными муцинозными опухолями яичников.
К редким наблюдениям относят метастазы в яичники рака желчного пузыря и гепатоцелюллярного рака. Обычно первые признаки заболевания манифестируют опухолевым поражением яичников. Лечение этих опухолей в основном хирургическое. Химиотерапия и лучевая терапия не эффективны.
Метастазы РМЖ в яичники диагностируются у 10–20% больных. Считается, что метастазы РМЖ клинически симулируют первичные опухоли яичников с диссеминацией процесса по брюшной полости в 17% случаев. Чаще метастазы наблюдаются при распространении внутрипротокового рака (75%). Двухстороннее поражение встречается в 2/3 наблюдений, размеры опухолей редко превышают 5–7 см.
Лечение метастазов РМЖ в яичники включает:
— оперативное лечение в объеме экстирпации матки с придатками и удаления большого сальника в связи с частым поражением метастазами миометрия (13%) и большого сальника (15%);
— химио-гормонотерапию;
— лучевую терапию.
Примерно в 5% наблюдений отмечаются метастазы в яичники при раке легких, особенно при его мелкоклеточной форме.
Появление метастазов рака эндометрия в яичники достаточно четко зависит от гистотипа первичной опухоли, стадии процесса. Чаще метастазирует аденокарцинома с плоскоклеточной метаплазией, поражающей всю полость матки с переходом на цервикальный канал, со смешанной формой роста. Несколько более характерно одностороннее поражение — 61%. Следует отметить успешное применение химиотерапии при лечении больных раком эндометрия с метастазами в яичники: 5-летняя выживаемость больных, получивших химиотерапию CAP/AF, составляет 62,6%, не получавших лечения — 18%.
При плоскоклеточном раке шейки матки метастазы в яичники диагностируются примерно в 3% случаев, а при аденокарциноме — в 12% наблюдений. Рекомендуемый объем операции — расширенная экстирпация матки с придатками и удаление большого сальника с последующей лучевой терапией.
Лечение злокачественных опухолей яичников
Основная роль в терапии РЯ принадлежит 3 методам лечения: хирургическому, лекарственному и лучевому.
Хирургическое лечение РЯ
Оперативному вмешательству в настоящее время придается первостепенное значение как самостоятельному методу и как важнейшему этапу в комплексе лечебных мероприятий. Практически при всех опухолях яичников должна производиться срединная лапаротомия. Только этот разрез позволяет произвести тщательную ревизию органов брюшной полости и забрюшинного пространства, способствует морфологической верификации диагноза, определению степени дифференцировки и плоидности опухоли и, что самое главное, позволяет удалить опухолевую ткань, целиком или частично.
При злокачественных опухолях яичников операция выбора — экстирпация матки с придатками и удаление большого сальника. В некоторых клиниках призывают дополнительно производить аппендэктомию, спленэктомию, резекцию пораженных отделов кишки, а также забрюшинную лимфаденэктомию. Теоретически тотальная забрюшинная лимфаденэктомия должна приводить к лучшим результатам лечения, однако те немногочисленные авторы, которые имеют достаточный опыт выполнения подобных операций, отмечают практически одинаковую выживаемость больных, перенесших стандартную операцию и больных с дополнительной лимфаденэктомией.
Касаясь вопроса лечебной тактики при так называемых ранних стадиях заболевания, необходимо подчеркнуть, что даже начальные формы заболевания являются большой проблемой для онкологов. В настоящее время и, вероятно, в обозримом будущем, лечение должно начинаться только с операции, потому что, только после лапаротомии можно получить максимальную информацию о состоянии опухолевого процесса. При этом хирурги должны стремиться к максимальному объему с учетом частоты рецидивов и метастазов.
Конечно, реалистически подходя к вопросу лечебной тактики при ранних стадиях заболевания, приходится признать, что не все больные оперируются радикально. В ряде случаев, явно рискуя, хирурги вынуждены идти навстречу пожеланиям молодых женщин, которые по тем или иным мотивам не соглашаются на радикальное оперативное лечение. В подобных случаях необходим строго индивидуальный подход. Органосохраняющие операции возможны, но лишь при самом тщательном морфологическом исследовании контралатерального яичника, придатков, брюшины, большого сальника с определением степени дифференцировки, пролиферативного потенциала и других биологических параметров опухоли.
При пограничных опухолях яичников I стадия заболевания встречается в 90% наблюдений. Во время лапаротомии выполняется резекция или односторонняя овариоэктомия (аднексэктомия), обязательно биопсия контрлатерального яичника и удаление большого сальника. При II—III стадиях процесса производится экстирпация матки с придатками, удаление большого сальника. При подтвержденной пограничной опухоли яичников послеоперационная химиотерапия, по нашему мнению, малоэффективна.
При высокодифференцированных опухолях IA, B стадий обычно выполняется экстирпация матки с придатками, удаление большого сальника, биопсия брюшины (не менее 10 образцов), особенно из области малого таза и поддиафрагмальной поверхности, смывы из брюшной полости. В случае подтверждения IА стадии серозного, высокодифференцированного рака женщинам, желающим сохранить детородную функцию, может быть произведена односторонняя аднексэктомия, биопсия контрлатерального яичника, резекция большого сальника, ревизия забрюшинных лимфоузлов. Щадящий объем операции накладывает на хирурга большую ответственность, т.к. достаточно велико число диагностических ошибок на всех этапах наблюдения за больной. В связи с этим пациентка постоянно должна находится под строгим контролем (УЗТ, СА 125). Дополнительное лечение — адъювантная химиотерапия — в большинстве клиник мира обычно не проводится, хотя, по нашим данным, послеоперационное лекарственное лечение, даже в монорежиме, повышало 5-летнюю выживаемость на 7%. При остальных гистологических формах РЯ IА, В стадий предпочтительнее проведение радикальной операции. По сводным данным, 5-летняя выживаемость при высокодифференцированном мезонефроидном раке I стадии составляет 69%, при серозном — 85%, при муцинозном — 83%, при эндометриоидном — 78%, а при недифференцированной форме — 55%. Поэтому данному контингенту больных, после произведенной радикальной операции рекомендуется адъювантная монохимиотерапия мелфаланом, цисплатином или комбинациями САР, СР — не менее 6 курсов, хотя некоторые авторы предлагают и 3 курса.
Всем больным с умеренно— и низкодифференцированными опухолями IA-B-C, а также со IIA-B-C стадиями показана операция — экстирпация матки с придатками, удаление большого сальника с последующей полихимиотерапией СР/САР — не менее 6 курсов (Стенина М.Б. 2000., Тюляндин С.А., 2000, Young R., Pecorelli S., 1998).
Значительно больше проблем возникает перед клиницистами при лечении пациентов с распространенными стадиями заболевания.
В настоящее время ни у кого не вызывает сомнений необходимость применения при первичном лечении этих больных комбинированных или комплексных лечебных мероприятий. В то же время отдельные стороны и детали комбинированного лечения противоречивы в связи с большим количеством мнений различных исследователей, касающихся тактики, схем химиотерапии, этапности, длительности лечения и т.д.
Изучая значение последовательности лечебных воздействий при III-IV стадиях РЯ, уже давно пришли к выводу, что вариант “операция + химиотерапия” значительно улучшает выживаемость пациенток при сравнении с теми, когда лекарственное лечение было проведено на первом этапе.
Это утверждение можно обосновать и теоретически:
— неэффективность фармакологических препаратов устраняетсяется удалением основной массы опухоли со слабым кровотоком;
— эффективность химиопрепаратов связана с высокой митотической активностью малых опухолей;
— наименьшие остаточные опухоли требуют меньшего количества курсов химиотерапии, в то время как при больших массивах повышается вероятность появления резистентных форм;
— удаление основных опухолевых масс приводит к относительной нормализации иммунной системы пациентки;
— удаляются по возможности фенотипически резистентные опухолевые клетки.
Ниже мы постараемся коротко расшифровать перечисленные критерии возможной эффективности циторедуктивных операций.
Для сóлидных новообразований характерен сравнительно бедный кровоток, что не позволяет достичь эффективных концентраций фармацевтического препарата в опухолевых тканях и, соответственно, снижает концентрацию фармакологического препарата в опухолевых тканях и эффективность проводимого лечения. Особенно это проявляется в центральных областях опухоли, где часты обширные некрозы, связанные с нарушением трофики тканей. К некротическим участкам примыкают кровоснабжающиеся из мелких сосудов многочисленные, особенно жизнеспособные участки злокачественных тканей. Такое представление подтверждается, правда косвенно, низким содержанием свободной глюкозы и высоким уровнем молочной кислоты во внутритканевой жидкости сóлидных опухолей. Все это приводит к временному снижению митотической активности злокачественных клеток и в результате — к снижению эффективности проводимой химиотерапии, тропной к ДНК клетки только в определенной фазе клеточного цикла. Для максимального эффекта большинства фармакологических агентов необходима фракция клеток с быстрым ростом, поэтому, после удаления основной массы малочувствительных к химиотерапии клеток, остаются более чувствительные небольшие очаги (диссеминаты), обладающие высокой митотической активностью. Кроме того, удаление большой массы опухоли приводит к относительному восстановлению иммунокомпетентности организма-опухоленосителя, в первую очередь — за счет снижения иммуносупрессии, индуцированной неоплазмой.
Целью хирургического лечения является удаление максимально возможного объема первичной опухоли и ее метастазов.
Если полное удаление опухоли невозможно, удаляют бóльшую ее часть. Показано, что выживаемость больных в значительной степени коррелирует с размером оставшихся после операции метастазов. Так, при размерах остаточной опухоли, которые не превышала 5 мм, средняя продолжительность жизни соответствует 40 мес; при размерах до 1,5 см — 18 мес, а в группе больных с метастазами более 1,5 см — 6 мес.
В связи с этим в настоящее время рекомендуются следующие стандартные положения для выбора оперативных вмешательств.
Первичная циторедуктивная операция предусматривает удаление максимально возможного объема опухоли и метастазов перед началом лекарственной терапии. Первичная циторедуктивная операция является стандартом помощи при распространенном РЯ, особенно при III стадии заболевания. Целью циторедуктивной операции должно являться полное или максимальное удаление опухоли. Роль циторедуктивной операции при IV стадии по FIGO противоречива, но больные с наличием только плеврального выпота, метастазами в надключичные лимфоузлы или единичными кожными метастазами могут лечиться, как при III стадии заболевания.
Не показан данный объем операции больным с метастазами в печень и легкие.
С другой стороны, неоадьювантная химиотерапия является приемлемой альтернативой циторедуктивной операции при IV стадии заболевания или у больных, у которых заболевание не может быть оптимально уменьшено в связи с техническими трудностями.
Промежуточная циторедуктивная операция выполняется после короткой индукционной химиотерапии (обычно 2–3 курса). Выполнение операции на данном этапе является приемлемым подходом в терапии пациенток, у которых первая операция была либо пробной, либо малоуспешной.
Операция “second-look” — диагностическая лапаротомия, которая выполняется для оценки остаточной опухоли у больных без клинических проявлений заболевания после химиотерапии. Данная тактика в настоящее время широко не используется, т.к. в результате не приводит к улучшению выживаемости.
Вторичная циторедуктивная операция. Большинство вторичных циторедуктивных операций выполняются при локализованных рецидивах, возникших после комбинированного лечения. Предварительный анализ показал, что кандидаты для выполнения подобных операций могут быть определены с учетом факторов прогноза. Чаще всего это опухоли, которые рецидивируют спустя год и более после завершения первичного лечения и адекватно отвечали на проводимую ранее химиотерапию.
Паллиативные операции в основном производятся для облегчения состояния больной, например, при кишечной непроходимости на фоне спаечного процесса или при прогрессировании заболевания.
В заключение необходимо отметить, что к настоящему времени, методы оперативного лечения при РЯ практически не изменились, за небольшим исключением, в то время как лекарственное лечение стало более эффективным и продолжает совершенствоваться. Широко исследуются новые перспективные методы терапии на стыке генетики, иммунологии, химиотерапии и лучевой терапии. Следует признать, что, вероятно, в ближайшем будущем, злокачественные опухоли яичников будут является в основном прерогативой консервативной медицины.
Химиотерапия
Системная химиотерапия является стандартным методом лечения больных распространенным РЯ.
В связи с тем, что циторедуктивная операция не является радикальной, проведение химиотерапии следует начать как можно быстрее после операции — обычно на 10—12 сутки.
Химиотерапия РЯ 1-й линии
Таблица 7
| Комбинация | Лекарственное средство, доза и режим лечения |
| cbP | Карбоплатин (AUC 5-7,5) в/в 1 раз в 3 нед, 6-8 циклов |
| Р | Цисплатин — по 100 мг/м2 в/в 1 раз в 3 нед, 6-8 циклов |
| СР | Цисплатин — по 75 мг/м2 в/в Циклофосфамид — по 750 мг/м2 в/в 1 раз в 3 нед, 6-8 циклов |
| СсbP | Карбоплатин (AUC 5) в/в Циклофосфамид — по 750 мг/м2 в/в 1 раз в 3 нед, 6-8 циклов |
| ТР | Цисплатин — по 75 мг/м2 в/в Паклитаксел — по 175 мг/м2 в/в 1 раз в 3 нед, 6-8 циклов |
| TcbP | Карбоплатин (AUC 5) в/в Паклитаксел — по 175 мг/м2 в/в 1 раз в 3 нед, 6-8 циклов |
В большинстве стран мира стандартом считается такая однодневная двухкомпонентная химиотерапия 1-й линии:
цисплатин — по 75мг/м2 (или карбоплатин AUC 7) и циклофосфамид — по 750 мг/м2, 6—8 курсов с интервалами 3 нед (Стенина М.Б., 2000, Тюляндин С.А., 2000).
Проводимая химиотерапия позволяет добиться среднего времени до прогрессирования не менее 12 мес, а средней продолжительности жизни до 24 мес.
Необходимо отметить, что идентичные результаты были получены и при использовании в монорежиме карбоплатина.
В последнее десятилетие широко стала применяться схема химиотерапии с использованием таксанов.
Так, стандартной химиотерапией 1-й линии становится комбинация:
цисплатин — по 75мг/м2 (или карбоплатин AUC 5—7,5) + паклитаксел — по 175мг/м2 — 6 курсов с интервалом 3 нед.
По данным исследователей, продолжительность жизни больных увеличилась до 36 мес.
Рассмотрим несколько подробнее основные химиопрепараты.
Цисплатин — один из наиболее активных препаратов для лечения больных опухолями яичников. Объективный противоопухолевый эффект отмечен у 32% пациенток, которые ранее получали химиотерапию хлорэтиламинами или доксорубицином. При использовании цисплатина у больных, не получавших ранее химиотерапии, объективный эффект наблюдали в 60–70% случаев, из них в 15–20% — полный, а 5-летняя выживаемость составила 6%.
К сожалению, комбинации с включением цисплатина плохо переносятся больными в связи с выраженной тошнотой и рвотой, частым развитием нефро— и нейротоксичности.
Именно поэтому перспективным представляется замена цисплатина на менее токсичный карбоплатин.
Карбоплатин — препарат второго поколения из группы платиносодержащих. В отличие от своего предшественника цисплатина, карбоплатин обладает меньшей нефро— и нейротоксичностью, способностью вызывать тошноту и рвоту. Основным побочным действием карбоплатина является угнетение кроветворения, что можно преодолеть активным назначением колониестимулирующих факторов. Частота объективных эффектов при использовании карбоплатина у ранее леченных больных варьирует от 9 до 32% и в среднем составляет 24%.
Оба препарата платины обладают примерно равной эффективностью при лечении РЯ, если дозы двух цитостатиков взяты в соотношении 4:1 (т.е. карбоплатин в дозе 400 мг/м2 равноценен по противоопухолевой эффективности цисплатину в дозе 100 мг/м2).
Было проведено несколько рандомизированных исследований, в которых сравнивали эффективность комбинаций с включением этих двух производных платины. Во всех исследованиях, где карбоплатин использовали в дозе 300 мг/м2 и выше в комбинации с другими цитостатиками (циклофосфамид, доксорубицин) показана примерно равная эффективность в сравнении с комбинациями на основе цисплатина. При этом режимы с включением карбоплатина переносятся больными гораздо легче.
Полученные данные показывают, что комбинация карбоплатин + циклофосфамид является схемой выбора у больных распространенным РЯ.
Рекомендуется использовать: карбоплатин — по 300–360 мг/м2 + циклофосфамид — по 500 мг/м2 каждые 3–4 нед.
Паклитаксел — препарат растительного происхождения, полученный из коры тиса. При проведении второй фазы клинических испытаний была изучена эффективность паклитаксела в химиотерапии второй или третьей линии у больных РЯ, получавших препараты платины. На большом числе больных было показано, что паклитаксел в режиме монохимиотерапии является эффективным препаратом при лечении этой прогностически неблагоприятной группы пациенток. Частота объективных эффектов продолжительностью от 3 до 6 мес составляет 20—36%. Создается впечатление, что с повышением дозы паклитаксела можно рассчитывать на более высокую эффективность лечения.
Перспективно использование паклитаксела для внутрибрюшинного введения. Высокая молекулярная масса и размеры молекулы паклитаксела обусловливают медленное всасывание препарата в кровь при введении его внутрибрюшинно. В брюшной полости создается высокая концентрация препарата (более чем в 100 раз выше, чем в плазме при в/в введении), которая сохраняется в течение 5–7 дней. Разовая доза для внутрибрюшинного введения паклитаксела составляет 60 мг/м2 и рекомендуется для еженедельного введения в течение 3–4 нед.
Внутрибрюшинное введение паклитаксела может быть использовано для проведения индукционной химиотерапии у больных с оптимально выполненной циторедуктивной операцией, когда размеры опухолевых образований не превышают 0,5 см, а также в качестве химиотерапии 2-й линии у больных с минимальными проявлениями болезни после индукционной химиотерапии.
Опухоли яичников являются чувствительными к химиотерапии. Чрезвычайно важным фактором успешного лечения является интенсивность проводимой химиотерапии. Это означает, что при лечении больных диссеминированными опухолями яичника надо использовать комбинации противоопухолевых препаратов, вводить цитостатики в полных рекомендуемых дозах, строго соблюдать интервалы между курсами (как правило, это 3–4 нед с момента начала последнего курса), число которых не должно быть менее 6 на этапе индукции. Примение монохимиотерапии, использование цитостатиков в меньших дозах, удлинение интервала между курсами и сокращение числа курсов химиотерапии на этапе индукции негативно влияют на непосредственные и отдаленные результаты лечения больных.
Планируя проведение лечения, каждый онколог должен реально представлять, что выбор химиотерапии и правильность ее проведения является одним из важнейшим факторов, влияющих на качество лечения и прогноз жизни.
Несколько слов о том, сколько курсов химиотерапии необходимо проводить на этапе индукции. Наибольший противоопухолевый эффект наблюдается уже после проведения 3–4 курсов лечения. Оптимальным при проведении индукционной терапии принято считать 6–8 курсов лекарственного лечения. Проведение 10 и более курсов не улучшает результаты лечения больных опухолями яичника.
Всем пациенткам по завершении индукционной химиотерапии показано обследование, включающее общий осмотр, ректовагинальное исследование органов малого таза, УЗТ и КТ органов брюшной полости и малого таза, рентгенографию грудной клетки, определение СА 125 в крови. У 60–70% больных, которым на первом этапе была выполнена циторедуктивная операция в оптимальном объеме с последующим проведением 6–8 курсов индукционной химиотерапии с включением производных платины, проявления болезни после окончания лечения обычно отсутствуют. Как правило, КТ органов брюшной полости и малого таза и определение уровня СА 125 не позволяют полностью исключить наличие субклинических проявлений болезни. Было показано, что при повышении уровня СА 125 более 35 ЕД/мл у 100% больных при повторной лапаротомии обнаруживают присутствие опухоли в брюшной полости. К сожалению, даже при полной нормализации уровня СА 125 после химиотерапии, у 44% больных имеются проявления болезни, подтвержденные повторной лапаротомией. Таким образом, операция “sесоnd-lоок” является единственным объективным методом оценки состояния болезни и лечебного эффекта. Менее инвазивный метод — лапароскопия — не может в полной мере заменить лапаротомию, так как обладает ограниченными возможностями ревизии брюшной полости и примерно в 35% случаях лапароскопическая картина полной регресии опухоли не подтверждается в дальнейшем при проведении лапаротомии. С практической точки зрения повторная лапаротомия может быть рекомендована больным III стадией РЯ молодого возраста, у которых после окончания химиотерапии, по данным обследования, отсутствуют признаки заболевания и произошла нормализация уровня СА 125 в крови. В случае обнаружения опухолевых образований небольших размеров (менее 0,5 см) таким больным возможно проведение внутрибрюшинной химиотерапии цисплатином или паклитакселом.
В настоящее время не существует общепринятых подходов к лечению остаточных после индукционной химиотерапии проявлений РЯ. Если индукционная химиотерапия включала цисплатин в рекомендуемых дозах каждые 3–4 нед не менее 6 курсов лечения, то можно думать, что оставшиеся опухолевые образования представляют собой клон клеток, ставших устойчивыми к используемым цитостатикам. Тактика лечения в этом случае во многом определяется размерами оставшихся опухолевых образований. При максимальных размерах 0,5 см целесообразна попытка внутрибрюшинной химиотерапии производными платины или паклитакселом. Следует отметить, что до сих пор не установлено истинное значение внутрибрюшинной химиотерапии для улучшения отдаленных результатов лечения больных РЯ. Если размеры остаточных (после химиотерапии) опухолевых образований в брюшной полости превышают 0,5 см, целесообразно прекратить лечение.
У отдельных больных может быть предпринято удаление рецидива опухоли. Показаниями к выполнению такой операции являются наличие солитарного опухолевого узла, молодой возраст пациентки, продолжительность безрецидивного периода после окончания индукционной химиотерапии более 12 мес. Столь тщательный отбор больных для повторной циторедуктивной операции объясняется тем фактом, что у подавляющего большинства пациенток с рецидивом РЯ повторное хирургическое лечение не улучшает прогноз заболевания.
Химиотерапия 2-й линии
Несмотря на достигнутые успехи в лечении РЯ запущенных стадий, у подавляющего большинства больных отмечается прогрессирование опухолевого процесса, и они нуждаются в проведении химиотерапии 2-й линии. Арсенал противоопухолевых средств, используемых для проведения химиотерапии 2-й линии, необычайно велик. Это свидетельство того, что ни один из них не позволяет достигнуть длительных ремиссий у большинства пациенток. Эффект химиотерапии 2-й линии можно предсказать, зная продолжительность ремиссии. Чем она дольше, тем больше шанс получения клинического эффекта при возобновлении лечения.
Поэтому пациенткам, у которых этот интервал составил 5 мес и больше, лечение рецидива целесообразно проводить комбинацией препаратов с включением платиновых производных. Частота объективных эффектов при этом составляет от 25 до 50%.
Обычно проводится 4–6 курсов химиотерапии комбинациями цисплатин + циклофосфамид или карбоплатин + циклофосфамид.
Во всех остальных случаях в качестве химиотерапии 2-й линии рекомендуется использовать препараты, не входившие в схему индукционной химиотерапии.
Назначение паклитаксела в дозе 135–200 мг/м2 в/в капельно в течение 3 ч каждые 3 нед 4–6 курсов позволяет добиться объективного эффекта у 25–35% больных с прогрессированием РЯ.
Средняя продолжительность эффектов составляет 5–8 мес.
Ифосфамид в качестве химиотерапии 2-й линии эффективен у 12–20% больных РЯ и может быть назначен в дозе 2 г/м2 в/в 3 дня в сочетании с месна.
Пероральная форма алтретамина дает объективный противоопухолевый эффект у 12—14% пациенток. Препарат обладает минимальной токсичностью.
Тамоксифен. У 18% больных отмечен объективный эффект при приеме по 20 мг препарата ежедневно. Эффект, как правило, наблюдали у больных с наличием рецепторов эстрогенов в опухоли.
Комбинация фторурацил + кальция фолинат обладает умеренной эффективностью (10%) в случае резистентной к цисплатину опухоли.
Этопозид. Пероральный прием в дозе 100 мг в течение 10–14 дней ежедневно эффективен у 6–26% больных. Незначительная токсичность препарата позволяет использовать его для проведения амбулаторного лечения ослабленных больных.
Наиболее эффективные схемы 2-й линии химиотерапии РЯ приведены ниже.
Таблица 8
| Лекарственное средство/комбинация | Доза и режим лечения |
| Паклитаксел | По 1,5 мг/м2 в/в, 1 раз в неделю |
| Топотекан | По 1,5 мг/м2 или 2,3 мг/м2 внутрь, в 1-5 дни, интервал — 3 нед |
| Алтретамин | По 260 мг/м2 внутрь в 1—14 дни, интервал — 4 нед |
| Паклитаксел + Карбоплатин + Алтретамин | Паклитаксел — по 150 мг/м2 в/в в 1 день, Карбоплатин (AUC 5) в/в/ в 1 день, Алтретамин — по 150 мг/м2 внутрь во 2-15 дни |
| Гемцитабин | По 1000 мг/м2 в/в в 1, 8, 15 дни, интервал — 4 нед |
| Гемцитабин + Цисплатин | Гемцитабин — по 600-1000 мг/м2 в/в в 1, 8, 15 дни, Ц цисплатин — по 30 мг/м2 в/в в 1 день |
| Этопозид | По 50 мг/м2 внутрь в 1-21 дни |
| Этопозид + Карбоплатин | Этопозид — по 50 мг/м2 внутрь в 1-21 дни, Карбоплатин (AUC — 5) в/в в 1 день |
| Иринотекан | По 100-200 мг/м2 в/в 1 раз в 3 нед |
| Иринотекан + Доцетаксел | Иринотекан — по 150-200 мг/м2 в/в 1 раз в 3 нед, Доцетаксел — по 60 мг/м2 в/в |
| Доксорубицин (липосомальный) | По 50 мг/м2 в/в 1 раз в 3 нед |
Непосредственные и отдаленные результаты лечения больных РЯ с момента внедрения в клиническую практику препаратов платины и комбинаций на их основе существенно улучшились. Анализ отдаленных результатов лечения следует проводить с учетом ряда важных прогностических факторов, влияющих на конечные результаты.
На протяжении последних десятилетий классическим остается сочетание двух основных методов лечения, хирургического и лекарственного. Критический анализ публикаций отечественных и зарубежных авторов, обобщивших опыт ведущих клиник, свидетельствует, что эти методы терапии РЯ практически достигли своего предела в улучшении отдаленных результатов лечения.
Лучевая терапия
Лекарственная резистентность опухоли и высокая частота рецидивов вновь заставляет обратить внимание на применение лучевой терапии, которая в настоящее время занимает весьма скромное место, несмотря на заметную чувствительность большинства злокачественных опухолей яичников к этому виду терапии (Михина З.П., 2001).
На сегодняшний день существует 4 варианта применения лучевой терапии при РЯ:
- Внутрибрюшинное применение радиофармацевтических препаратов (РФП) — коллоидного 32 P или коллоидного золота — при лечении I, II, III стадий РЯ без визуально определяемых метастазов, а также при лечении диссеминатов по брюшной полости не превышающих 3 мм. Метод достаточно эффективен (85,7%), но часто приводит к выраженному спаечному процессу в брюшной полости и малой чувствительности к химиотерапии в случае рецидива заболевания.
- Облучение брюшной полости и ретроперитонеального пространства методом перемежающихся полос.
- Методика широких полей с возможными модификациями.
- Техника открытых полей с усилением в области малого таза.
При анализе выживаемости в зависимости от вида первичного лечения наибольшее значение имеет эффективность каждого из методов в отдельности.
Лучевая терапия, проведенная больным с частичными регрессиями после операции и химиотерапии, позволяет добиться полного эффекта дополнительно у 27% больных (Михина З.П., 2001).
К сожалению, следует признать, что в настоящее время лучевая терапия неоправданно применяется лишь как паллиативный метод, в основном при рецидивах заболевания.
Неудовлетворительные результаты лечения больных РЯ стимулируют поиск новых подходов. В настоящее время уже предпринимаются попытки применения химиотерапии на фоне гипертермии, изучается возможность вакцинотерапии, генной терапии, использования ингибиторов ангиогенеза.
Литература
Аксель Е.М. и др. Статистика злокачественных опухолей яичников/ Современные экспериментальные и клинические подходы к диагностике и рациональному лечению рака яичников. М.: РОНЦ им. Н.Н. Блохина РАМН, 2001.
Гарькавцева Р.Ф. Наследственные формы рака яичников: диагностика, генетическая гетерогенность, клинические особенности, медико-генетическое консультирование/ Современные экспериментальные и клинические подходы к диагностике и рациональному лечению рака яичников. М.: РОНЦ им. Н.Н. Блохина РАМН, 2001.
Губина О.В. Особенности клинического течения и лечения пограничных опухолей яичников: Дис. ... канд. мед. наук.— М., 1995.
Жорданиа К.И. Роль опухолеассоциированных маркеров в диагностике и лечении рака яичников/ Современные экспериментальные и клинические подходы к диагностике и рациональному лечению рака яичников. М.: РОНЦ им. Н.Н. Блохина РАМН, 2001.
Жорданиа К.И. и др. Применение меченных моноклональных антител для иммуносцинтиграфии первичных очагов, метастазов и рецидивов рака толстой кишки и яичников/ Диагностика злокачественных заболеваний М.: РОНЦ им. Н.Н. Блохина РАМН, 1988.
Карселадзе А.И. Морфология эпителиальных опухолей яичников: Дис. ... докт. мед. наук.— М., 1989.
Коржевская Е.К. Эндометриоидный рак яичников. Факторы прогноза: Дис. ... канд. мед. наук. — М., 1997.
Михина З.П. Лучевая терапия в комплексном лечении эпителиальных опухолей яичников/ Современные экспериментальные и клинические подходы к диагностике и рациональному лечению рака яичников. М.: РОНЦ им. Н.Н. Блохина РАМН, 2001.
Порханова Н.В. Рецидивы серозного рака яичников (факторы прогноза и диагностика): Дис. ... канд. мед. наук.— M., 1999.
Стенина М.Б. ...Практическая онкология.— 2000.— № 4.
Тюляндин С.А. ...Практическая онкология.— 2000.— № 4.
Шелепова В.И. с соавт. ...Вестник РОНЦ им. Н.Н. Блохина.— 1996.— № 1.
Braun S. et al. ...J. Clin. Oncol.— 2001.— Jan. 15.— V. 19 (2).— P. 368–375.
Bridgewater J. et al. ...Oncology.— 1999.— V. 57.— P. 89–98
Hart W.R. ...Hum. Pathol.— 1977.— V. 8.— P. 541–549.
Rossing M.A. et al. ...N. Engl. J. Med.— 1994.— V. 331.— P. 771.
Scully R. Atlas of tumor pathology. Third series. Fascicle 23. Tumors of the ovary.— Maryland: Bethesda, 1998.
Trimbos J.B. ...Int. J. Gynecol. Cancer.— 2000.— V. 10 (suppl. 1).— P. 8–11.
Whittemore W. ...N. Engl. J. Med.— 1994.— V. 331.— P. 805.
Young R. et al. ...Seminars in oncology.— June 1998.— V. 25 (3).
Описание проверено экспертом
Оцените статью:
- Рак яичника
- Метастазирующая карцинома яичника
- Злокачественная опухоль яичника
- Карцинома яичников
- Метастазирующая злокачественная опухоль яичников
- Метастатический рак яичника
- Метастатический рак яичников
- Опухоль яичников
- Рак яичников
- Герминогенная опухоль яичников
- Эпителиальная опухоль яичников
- Распространенный метастатический рак яичников
- Распространенный рак яичников
- Трофобластические опухоли
- Хорионкарцинома
- Герминогенная опухоль яичника
- Цистаденокарцинома яичника муцинозная
- Аденокарцинома яичника псевдомуцинозная
- Карцинома яичника муцинозная
- Рак из псевдомуцинозной кисты
- Цистокарцинома яичника псевдомуцинозная
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
новообразование яичников
злокачественное новообразование яичника
объемные новообразования яичников, опухоли яичников, объемные новообразования яичника, при лечении эпителиальных опухолей яичников, рак яичника, рак яичников, карцинома яичников,


