D74 Метгемоглобинемия, МКБ-10
- D74.0 Врожденная метгемоглобинемия
- D74.8 Другие метгемоглобинемии
- D74.9 Метгемоглобинемия неуточненная
Отредактировано: 23.10.2025
Метгемоглобинемия
Определение
Метгемоглобинемии представляют собой гетерогенную группу заболеваний, характеризующихся повышением содержания метгемоглобина в крови свыше физиологической нормы, которая составляет 1-2% от общего количества гемоглобина (Hb) [1].
Этиология и патогенез
Метгемоглобин – это окисленная форма гемоглобина, в которой атом железа в геме переходит из двухвалентного (Fe²⁺) в трехвалентное состояние (Fe³⁺). Важно различать окисление и оксигенацию.
- Оксигенация – это обратимое присоединение молекулы O₂ к двухвалентному железу гема без изменения валентности.
- Окисление же представляет собой химическую реакцию, при которой железо теряет электрон и переходит в состояние Fe³⁺, что делает связывание кислорода с атомом железа в геме невозможным.
Таким образом, ключевое отличие метгемоглобина от нормального гемоглобина заключается в том, что метгемоглобин неспособен обратимо связывать и переносить кислород, что приводит к гипоксии тканей. Кроме того, трехвалентный гем в тетрамере гемоглобина повышает сродство к кислороду у оставшихся двухвалентных гемов, еще больше затрудняя высвобождение O₂ в тканях и усугубляя гипоксию.
Клинические последствия метгемоглобинемии зависят от характера ее течения:
- При хронической форме, характеризующейся длительным периодом повышения уровня метгемоглобина, организм способен адаптироваться к возникшей функциональной анемии за счет компенсаторного эритроцитоза, из-за чего у этих пациентов часто наблюдается бессимптомное течение заболевания. Исключение составляют некоторые врожденные формы метгемоглобинемии, которые могут быть ассоциированы с тяжелыми нарушениями развития и другими патологиями [2].
- Острая метгемоглобинемия (обычно токсического генеза) представляет собой угрожающее жизни состояние. Тяжелая гипоксия может привести к летальному исходу. Кислородотерапия, как правило, неэффективна, поскольку в основе патогенеза лежит нарушение транспорта кислорода кровью, а не его недостаток в крови.
В норме метгемоглобин в небольших количествах образуется постоянно, но существует ферментативная система, которая восстанавливает железо обратно в двухвалентную форму. Благодаря этому динамическому равновесию уровень метгемоглобина у здорового человека в среднем не превышает 1% от общего гемоглобина.
Превращение гемоглобина в метгемоглобин происходит в результате следующих реакций:
- Аутоокисление: гемоглобин спонтанно окисляется до метгемоглобина. Этот процесс усиливается при дезоксигенации гемоглобина (физиологическом высвобождении кислорода) и включает образование комплекса «железо (Fe³⁺) – супероксид-анион (O₂⁻)» с последующим высвобождением супероксид-радикала (O₂⁻), в результате чего железо остается в геме в окисленной форме (Fe³⁺).
- Реакции с активными формами кислорода и другими соединениями: образование метгемоглобина также катализируется при взаимодействии с эндогенными соединениями, такими как перекись водорода (H₂O₂), оксид азота (NO), а также со свободными радикалами (гидроксильным радикалом OH•).
- Внешние (экзогенные) факторы: химические вещества (например, некоторые лекарства или нитраты) могут напрямую или через метаболиты повышать уровень метгемоглобина.
Содержание метгемоглобина в организме поддерживается на низком уровне благодаря ферменту эритроцитов цитохром b5 редуктазе (Cyb5R), которая присутствует во всех клетках организма и восстанавливает железо в геме, возвращая в двухвалентное (Fe²⁺) состояние [3, 4]. Эта реакция сопряжена с переносом электронов от НАДН к ФАД и, в свою очередь, к цитохрому b5. Восстановление железа гема с помощью Cyb5R является наиболее важным механизмом преобразования метгемоглобина в организме.
Альтернативный путь обезвреживания метгемоглобина задействует фермент НАДФН-зависимую метгемоглобинредуктазу [2, 5]. В норме этот путь неактивен, так как в эритроцитах отсутствует естественный акцептор электронов для НАДФН, образующийся под действием фермента глюкозо-6-фосфатдегидрогеназы (Г6ФДГ). Путь активируется только при поступлении извне веществ-акцепторов электронов, таких как метиленовый синий или рибофлавин. Именно на этом принципе основано действие метиленового синего как антидота при тяжелой метгемоглобинемии. У пациентов с дефицитом Г6ФДГ терапия метиленовым синим не только неэффективна, но и опасна, поскольку он может действовать как окислитель и вызывать гемолиз – в этих случаях применяется аскорбиновая кислота [6].
По этиологии метгемоглобинемия может быть врожденной и приобретенной.

Клиническая картина
Метгемоглобинемия становится клинически значимой, когда возникает дисбаланс между образованием метгемоглобина и восстановлением – либо из-за избыточного окисления, либо из-за недостаточной активности восстановительных систем. Приобретенные случаи встречаются чаще наследственных. Иногда воздействие окислителя может вызвать тяжелую метгемоглобинемию у лиц с генетической предрасположенностью (например, у гетерозиготных носителей мутации в гене Cyb5R) [7].
Источник: McNulty R. et al. Food‐induced methemoglobinemia: A systematic review //Journal of Food Science. – 2022. – Т. 87. – №. 4. – С. 1423-1448.
Врожденная метгемоглобинемия
Врожденная метгемоглобинемия подразделяется на три подтипа в зависимости от пораженного фермента:
- врожденная недостаточность цитохром b5 редуктазы (Cyb5R),
- гемоглобиноз M (болезнь Hb-M),
- дефицит цитохрома b5.
Врожденная недостаточность цитохром b5 редуктазы (Cyb5R) представляет собой аутосомно-рецессивное заболевание, которое является причиной большинства случаев наследственной метгемоглобинемии [8, 9]. Хотя для манифестации болезни необходимы двуаллельные патологические варианты гена CYB5R3, гетерозиготные носители могут демонстрировать повышенную восприимчивость к приобретенной (токсической) метгемоглобинемии из-за более низких исходных уровней фермента Cyb5R. Выделяют два типа врожденной недостаточности цитохром b5 редуктазы:
- Тип I вызывается вариантами специфичной для эритроцитов изоформы Cyb5R, приводящей к снижению стабильности фермента. Эти варианты представляют собой миссенс-мутации, которые приводят к замене одной аминокислоты [2, 10]. Пациенты с I типом (гомозиготы или гетерозиготы) обычно имеют концентрацию метгемоглобина от 10% до 35%. Клиническая картина может характеризоваться цианозом, но чаще симптомы заболевания отсутствуют даже при увеличении уровня метгемоглобина до 40%. I тип составляет примерно 90% случаев недостаточности Cyb5R.
- Тип II вызывается мутациями, связанными с потерей функции Cyb5R как в эритроцитах, так и в других клетках и тканях [11]. Для клинической картины характерно наличие выраженной неврологической симптоматики. Ожидаемая продолжительность жизни значительно сокращается, большинство пациентов умирает в младенчестве. II тип cоставляет примерно 10% случаев недостаточности Cyb5R.
Гемоглобиноз M (болезнь Hb-M) представляет из себя аутосомно-доминантное заболевание, которое вызывается отдельными мутациями в генах альфа-, бета- или (редко) гамма-глобина. Было описано по меньшей мере 12 вариантов болезни Hb-M [12, 13]. Большинство из них приводят к замене гистидина на тирозин либо в проксимальном, либо в дистальном участке гемового кармана. Это приводит к образованию комплекса железа с фенолятом, который препятствует восстановлению Fe3+ до двухвалентного состояния.
Дефицит цитохрома b5 – самая редкая форма врожденной метгемоглобинемии, описанная в нескольких семьях [14]. Цитохром b5 является субстратом для фермента Cyb5R, работая как донор электронов при превращении метгемоглобина в гемоглобин.
Эпидемиология
Распространенность врожденной метгемоглобинемии недостаточно изучена. Наиболее частой причиной врожденной метгемоглобинемии является дефицит Cyb5R, вызванный двуаллельными патогенными вариантами гена CYB5R3.
Дефицит Cyb5R с повышенной частотой выявляется в определенных изолированных популяциях, таких как:
- эвенки в Якутии, Сибири [15],
- народы Атабаски из Аляски [16],
- народы Навахо [17],
- пуэрториканцы [18].
Клиническая картина
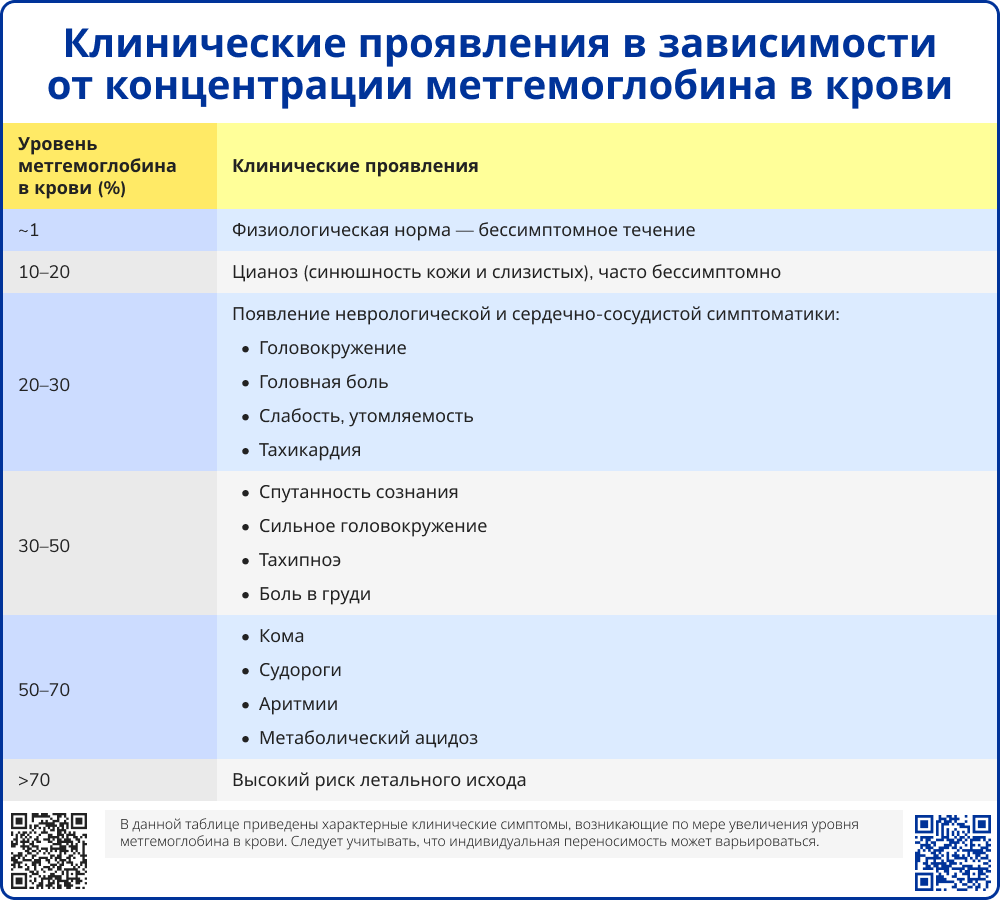
Характерным клиническим проявлением является цианоз, вызванный хронической метгемоглобинемией. Цианоз обычно наблюдается, когда абсолютная концентрация метгемоглобина превышает 1,5 г/дл, что эквивалентно 8-12% метгемоглобина при нормальных концентрациях гемоглобина [6, 19].
Клинические проявления дефицита Cyb5R зависят от того, нарушена ли функция фермента только в эритроцитах (тип I) или во всех тканях (тип II).
- При дефиците Cyb5R I типа типичным проявлением служит цианоз у ребенка, который в остальном чувствует себя удовлетворительно. Одышка, как правило, отсутствует благодаря компенсаторному эритроцитозу. Некоторые пациенты могут предъявлять неспецифические жалобы, такие как головная боль, повышенная утомляемость и одышка при физической нагрузке. Характерен умеренный эритроцитоз. Заболевание не влияет на ожидаемую продолжительность жизни и не сопряжено с повышенными рисками во время беременности.
- Редкие случаи болезни II типа характеризуются тяжелым течением с нарушениями развития и неврологическими отклонениями. Ожидаемая продолжительность жизни сокращена, в большинстве случаев заболевание приводит к летальному исходу в первый год жизни. Возможные проявления включают:
- микроцефалию,
- опистотонус,
- атетоидные движения,
- косоглазие,
- когнитивные нарушения,
- задержку развития,
- судороги,
- спастический тетрапарез.
При гемоглобинозе М уровень метгемоглобина в крови составляет 30-50% (при норме <1%), что приводит к развитию стойкого цианоза. Время манифестации цианоза зависит от того, какая цепь глобина поражена. При поражении альфа-цепи симптомы обычно присутствуют с рождения. Характерным для поражения бета-цепи является появление симптомов в возрасте примерно 6 месяцев, когда происходит замещение фетального гемоглобина на взрослый. При поражении гамма-цепи цианоз наблюдается с рождения, но, как правило, исчезает к 6-месячному возрасту в результате физиологического переключения на синтез бета-глобина.
Диагностика
Заподозрить врожденную метгемоглобинемию следует у ребенка с персистирующим цианозом или лабораторно подтвержденным увеличением уровня метгемоглобина, которые не имеют иного объяснения. Особенно настораживающими являются случаи, когда цианоз или гипоксия не купируются при ингаляции кислорода. Вероятность диагноза повышается при наличии ранее документированных эпизодов метгемоглобинемии или семейного анамнеза, отягощенного по метгемоглобинемии.
При возникновении подозрения на метгемоглобинемию диагностический алгоритм включает комплекс лабораторных и инструментальных исследований [20]. Лабораторная диагностика начинается с выполнения общего и биохимического анализов крови, показатели которых обычно остаются в пределах референсных значений, хотя при хронических формах заболевания может наблюдаться компенсаторный эритроцитоз.
Критическое значение в диагностике имеет оценка оксигенации крови. При проведении пульсоксиметрии выявляется характерный диагностический признак – «плато» сатурации кислорода (SpO₂) на уровне приблизительно 85%, не корригируемое кислородотерапией. Анализ газового состава артериальной крови демонстрирует сдвиг кислородно-диссоциационных кривых влево. Наиболее точным неинвазивным методом является ко-оксиметрия – специализированная модификация стандартной пульсоксиметрии, измеряющая поглощение на длине волны 630 нм, соответствующей пику поглощения метгемоглобина. Важно учитывать, что метод может давать ложноположительные результаты при наличии сульфгемоглобина, карбоксигемоглобина или некоторых лекарственных пигментов [21].
Для верификации диагноза применяется прямое количественное определение метгемоглобина с помощью цианидного теста. Принцип метода основан на способности цианида связываться с метгемоглобином, что приводит к исчезновению характерного пика поглощения в диапазоне 630-635 нм. Последующее добавление феррицианида преобразует образец в цианметгемоглобин для точного измерения общей концентрации гемоглобина.
После подтверждения наличия метгемоглобинемии необходимо установить ее этиологию. Для этого проводятся:
- Генетическое тестирование – направленный поиск патогенных вариантов гена CYB5R3 и генов глобиновых цепей. Результаты имеют ключевое значение для медико-генетического консультирования и выбора терапии.
- Биохимическое тестирование – оценка ферментативной активности Cyb5R в эритроцитах и неэритроидных клетках (для дифференциальной диагностики I и II типов) [14].
- Анализ гемоглобина – проведение электрофореза или высокоэффективной жидкостной хроматографии (ВЭЖХ) для выявления аномального HbM. Этот вариант гемоглобина может проявлять аномальную миграционную активность при электрофорезе в определенных условиях (например, при pH 7,1).
Проведение пренатальной диагностики показано семьям с ранее диагностированными случаями метгемоглобинемии типа II из-за крайне неблагоприятного прогноза этого заболевания.
Дифференциальная диагностика
Дифференциальная диагностика врожденной метгемоглобинемии требует исключения других возможных причин цианоза. В первую очередь рекомендуется дифференцировать ее с цианозом, вызванным гипоксией при декомпенсированных респираторных или сердечно-сосудистых заболеваниях. Далее следует учитывать периферический вазоспазм, который может быть следствием феномена Рейно или воздействия низкой температуры. Дифференциальная диагностика также проводится с менее распространенными состояниями, к которым относится сульфгемоглобинемия, манифестирующая при концентрации сульфгемоглобина выше 0,5 г/дл, а также эритроцитоз.
Лечение
Несмотря на то, что цианоз при врожденных формах метгемоглобинемий обычно имеет доброкачественную природу и не угрожает жизни, он может вызывать психологический дискомфорт, что требует индивидуального подхода к терапии. Выбор лечения зависит от конкретной формы заболевания.
При дефиците Cyb5R цель лечения состоит в снижении уровня метгемоглобина и уменьшении цианоза. Основным препаратом для лечения этой формы метгемоглобинемии является метиленовый синий в дозах 1-2 мг/кг внутривенно или 100-300 мг перорально в сутки. Перед назначением рекомендуется исключить дефицит Г6ФДГ из-за риска развития гемолиза. Альтернативным подходом к лечению, в частности при наличии дефицита Г6ФДГ, является назначение аскорбиновой кислоты в дозе 1000 мг 3 раза в сутки [20, 22]. Ввиду отсутствия прямых сравнительных исследований эффективности метиленового синего и аскорбиновой кислоты, определение оптимальной терапии и коррекция доз проводятся на индивидуальной основе. Важно помнить, что высокие дозы аскорбиновой кислоты связаны с повышенным выделением оксалатов с мочой. При почечной недостаточности это может привести к гипероксалурии и спровоцировать острую почечную недостаточность.
В настоящее время не разработано единого подхода к коррекции неврологических нарушений у пациентов с дефицитом Cyb5R II типа. Трансплантация гемопоэтических стволовых клеток или печени может смягчить сопутствующие нарушения липидного обмена, однако эти методы не исследовались в клинических испытаниях и не являются стандартом терапии.
Специфической терапии для коррекции цианоза при гемоглобинозе М не существует. Метиленовый синий и аскорбиновая кислота неэффективны, и их применения рекомендуется избегать (за исключением случаев сочетания с приобретенной метгемоглобинемией). Целесообразно донести до пациента информацию о благоприятном прогнозе состояния и нецелесообразности применения лекарственных средств для купирования цианоза.
Пациенты с врожденными формами метгемоглобинемии (а также здоровые носители-гетерозиготы) обладают повышенной чувствительностью к веществам-окислителям, индуцирующим образование метгемоглобина. Врачебные рекомендации включают информирование пациентов о мерах предосторожности и необходимости исключения контакта с провоцирующими факторами.
Родственников первой степени родства информируют о диагнозе с предложением проведения генетического тестирования и консультации медицинского генетика.
Приобретенная метгемоглобинемия
Приобретенная (токсическая) метгемоглобинемия является редким, но потенциально жизнеугрожающим состоянием, требующим быстрой клинической диагностики и купирования состояния [23].
Этиология
Развитие приобретенной метгемоглобинемии часто связано с воздействием определенных химических веществ и лекарственных средств.
Одной из распространенных причин является передозировка лекарственными препаратами. Среди них противомикробные средства, такие как дапсон, который используется для профилактики малярии у военнослужащих и является наиболее частой причиной метгемоглобинемии [24]. Местные анестетики (бензокаин, лидокаин, прилокаин) также могут быть факторами, индуцирующими развитие метгемоглобинемии [2, 25]. Прием расбуриказы для лечения и профилактики синдрома лизиса опухоли, особенно при недиагностированном дефиците Г6ФДГ, является типичным примером ятрогенной метгемоглобинемии [26].
Помимо лекарственных препаратов, опасность представляют высокие уровни нитратов и нитритов, содержащиеся в пищевых продуктах, лекарствах, консервантах и химикатах [6]. Типичный пример – вскармливание младенца смесью, приготовленной на воде из колодца, не проверенной на содержание нитритов. Воздействие анилиновых красителей и других химических окислителей может вызывать тяжелые формы метгемоглобинемии.
Факторы риска
Повышенный риск развития метгемоглобинемии наблюдается у гетерозигот по патогенному варианту гена CYB5R3, у которых в обычных условиях уровень метгемоглобина остается в пределах нормы, однако при воздействии провоцирующих агентов может развиваться выраженный цианоз и другие симптомы. Особого внимания требует младенческий возраст из-за физиологически сниженной активности фермента Cyb5R. Группу риска также составляют пациенты с дефицитом Г6ФДГ, для которых назначение метиленового синего особенно опасно, поскольку может вызвать гемолиз и парадоксальное усугубление состояния.
Клиническая картина
Клиническая картина характеризуется симптомами гипоксии тканей, при этом гипоксемия (снижение парциального давления кислорода в артериальной крови – PaO₂) может отсутствовать. Симптомы варьируются от цианоза, одышки и неспецифических жалоб (головная боль, головокружение, усталость, раздражительность, сонливость) до развития шока, тяжелой дыхательной недостаточности, тяжелых неврологических нарушений (кома, судороги) и летального исхода. Выраженность симптомов обычно коррелирует с уровнем метгемоглобина. Токсический эффект может усугубляться фоновой анемией, сердечно-сосудистой или дыхательной недостаточностью.
Диагностика
При сборе анамнеза рекомендуется целенаправленно выявлять потенциальные этиологические факторы, включая алиментарные (например, употребление воды из колодцев), прием лекарственных препаратов и контакт с химическими веществами.
Комплекс лабораторной диагностики начинается с визуальной оценки цвета крови, для которой используется проба артериальной или венозной крови.
Ключевым исследованием является анализ газового состава артериальной крови с количественным определением уровня метгемоглобина: диагноз подтверждается при показателе выше 5%, тогда как клинические симптомы обычно манифестируют при уровне более 10%. У пациентов с сопутствующей анемией или дыхательной недостаточностью (например, при эмфиземе легких) манифестация симптомов наблюдается при меньших значениях метгемоглобина. Показатели, превышающие 30-40%, ассоциированы с развитием тяжелой симптоматики и представляют непосредственную угрозу для жизни.
В общем анализе крови уровень гемоглобина, как правило, остается в пределах нормы, а компенсаторный эритроцитоз отсутствует, хотя возможен относительный эритроцитоз на фоне дегидратации.
Диагностическое значение имеет определение активности Г6ФДГ, которое становится критически важным исследованием перед потенциальным назначением метиленового синего из-за риска развития гемолиза у пациентов с дефицитом этого фермента.
Дифференциальная диагностика
Приоритетное значение в дифференциальной диагностике имеют отравление угарным газом (с образованием карбоксигемоглобина) и сульфгемоглобинемия, поскольку эти состояния также связаны с образованием патологических производных гемоглобина, представляющих непосредственную угрозу для жизни. Критерием различия сульфгемоглобина и метгемоглобина в специализированной лаборатории служит пик поглощения при 620 нм, сохраняющийся после добавления цианида.
Лечение
Лечение острой токсической метгемоглобинемии, особенно при уровне метгемоглобина выше 30% (или при более низких показателях, сопровождающихся симптомами гипоксии), требует неотложных медицинских мероприятий.
Первоочередной шаг – немедленное прекращение воздействия провоцирующего агента. Поддерживающая терапия включает в себя обеспечение внутривенного доступа, гидратацию при гипотонии, респираторную поддержку в случае дыхательной недостаточности и купирование судорог при неврологических осложнениях. Пациенты с тяжелыми симптомами, требующими инотропной или респираторной поддержки, подлежат незамедлительному переводу в отделение интенсивной терапии.
Специфическим антидотом является метиленовый синий, который показан в качестве терапии первой линии для пациентов с выраженными симптомами или при уровне метгемоглобина выше 30%. Преимущество метиленового синего перед аскорбиновой кислотой заключается в более быстром действии и лучшей доказательной базе [2, 20]. Однако применение препарата противопоказано пациентам с дефицитом Г6ФДГ из-за риска гемолиза, а также при одновременном приеме с серотонинергическими препаратами, из-за риска развития серотонинового синдрома. При наличии противопоказаний для назначения метиленового синего используется аскорбиновая кислота, которая, однако, требует многократных введений и может снизить уровень метгемоглобина в течение 24 и более часов. Для пациентов с бессимптомным течением или легкими симптомами при уровне метгемоглобина менее 20% антидотная терапия не показана, однако вопрос о назначении антидота требует пересмотра при малейшем прогрессировании симптоматики.
В ситуациях, когда состояние пациента остается тяжелым и рефрактерным к стандартной терапии, рассматриваются альтернативные методы лечения. К ним относятся обменное переливание крови и гипербарическая оксигенация [27-29]. Гипербарическая оксигенация рекомендуется при отравлении анилиновыми красителями при отсутствии эффекта от метиленового синего. При персистирующей метгемоглобинемии, особенно на фоне сопутствующей анемии, может быть использована стандартная гемотрансфузия.
Список литературы
- Methemoglobinemia - StatPearls - NCBI Bookshelf [Электронный ресурс]. URL: https://www.ncbi.nlm.nih.gov/books/NBK537317/ (дата обращения: 28.09.2025).
- Prchal J.T., и др. Methemoglobinemia - UpToDate [Электронный ресурс]. URL: https://www.uptodate.com/contents/methemoglobinemia/ (дата обращения: 28.09.2025).
- Elahian F. et al. Human cytochrome b5 reductase: structure, function, and potential applications //Critical reviews in biotechnology. – 2014. – Т. 34. – №. 2. – С. 134-143
- Hall R. et al. Cytochrome b5 reductases: Redox regulators of cell homeostasis //Journal of Biological Chemistry. – 2022. – Т. 298. – №. 12. – С. 102654.
- Yip L., Spyker D. A. NADH-methemoglobin reductase activity: adult versus child //Clinical Toxicology. – 2018. – Т. 56. – №. 9. – С. 866-868.
- McNulty R. et al. Food‐induced methemoglobinemia: A systematic review //Journal of Food Science. – 2022. – Т. 87. – №. 4. – С. 1423-1448.
- Nayak A. R. et al. Unmasking Congenital Methemoglobinemia: A Novel CYB5R Mutation Discovered in an Adult with Symptomatic Polycythemia //Turkish Journal of Hematology. – 2024. – Т. 41. – №. 4. – С. 281-282.
- Gupta V. et al. Mutation update: Variants of the CYB5R3 gene in recessive congenital methemoglobinemia //Human Mutation. – 2020. – Т. 41. – №. 4. – С. 737-748.
- Paudel S. et al. A case of congenital methemoglobinemia: rare but real //Cureus. – 2022. – Т. 14. – №. 4.
- Kaminecki I., Huang D. Methemoglobinemia. – 2021.
- Barakizou H., Chaieb S. Familial Psychomotor Delay of an Uncommon Cause: Type II Congenital Methemoglobinemia //Clinical Medicine Insights: Pediatrics. – 2024. – Т. 18. – С. 11795565241229007.
- Rangan A. et al. Interpreting sulfhemoglobin and methemoglobin in patients with cyanosis: an overview of patients with M‐hemoglobin variants //International journal of laboratory hematology. – 2021. – Т. 43. – №. 4. – С. 837-844.
- Skold A., Cosco D. L., Klein R. Methemoglobinemia: pathogenesis, diagnosis, and management //South Med J. – 2011. – Т. 104. – №. 11. – С. 757-761.
- Hegesh E., Hegesh J., Kaftory A. Congenital methemoglobinemia with a deficiency of cytochrome b5 //New England Journal of Medicine. – 1986. – Т. 314. – №. 12. – С. 757-761.
- Burtseva T. et al. Type I Methemoglobinemia Caused by the Cytochrome b5 Reductase 806C> T Mutation Is Present in the Indigenous Evenk People of Yakutia //Blood. – 2009. – Т. 114. – №. 22. – С. 2588.
- Scott E. M., Hoskins D. D. Hereditary methemoglobinemia in Alaskan Eskimos and Indians //Blood. – 1958. – Т. 13. – №. 8. – С. 795-802.
- Balsamo P., Hardy W. R., Scott E. M. Hereditary methemoglobinemia due to diaphorase deficiency in Navajo Indians //The Journal of Pediatrics. – 1964. – Т. 65. – №. 6. – С. 928-931.
- Reading N. S. et al. A patient with both methemoglobinemia and G6PD deficiency: a therapeutic conundrum //American journal of hematology. – 2017. – Т. 92. – №. 5. – С. 474.
- Cortazzo J. A., Lichtman A. D. Methemoglobinemia: a review and recommendations for management //Journal of cardiothoracic and vascular anesthesia. – 2014. – Т. 28. – №. 4. – С. 1043-1047.
- Iolascon A. et al. Recommendations for diagnosis and treatment of methemoglobinemia //American journal of hematology. – 2021. – Т. 96. – №. 12. – С. 1666-1678.
- Barker S. J. et al. Measurement of carboxyhemoglobin and methemoglobin by pulse oximetry: a human volunteer study //Anesthesiology. – 2006. – Т. 105. – №. 5. – С. 892-897.
- Keats K. R. et al. Ascorbic acid for methemoglobinemia treatment: A case report and literature review //Journal of Pharmacy Practice. – 2024. – Т. 37. – №. 4. – С. 1015-1020.
- Gao H., Basri R., Tran M. H. Acquired methemoglobinemia: A systematic review of reported cases //Transfusion and Apheresis Science. – 2022. – Т. 61. – №. 2. – С. 103299.
- Jacob G., Schorr M., Moist L. M. Methemoglobinemia in a 28-year-old woman treated with dapsone //CMAJ. – 2022. – Т. 194. – №. 30. – С. E1062-E1065.
- Moos D. D., Cuddeford J. D. Methemoglobinemia and benzocaine //Gastroenterology Nursing. – 2007. – Т. 30. – №. 5. – С. 342-345.
- Khan M. et al. Rasburicase-induced methemoglobinemia in a patient with glucose-6-phosphate dehydrogenase deficiency //Current Drug Safety. – 2017. – Т. 12. – №. 1. – С. 13-18.
- Cho Y. et al. A case of methemoglobinemia successfully treated with hyperbaric oxygenation monotherapy //The Journal of Emergency Medicine. – 2017. – Т. 53. – №. 5. – С. 685-687.
- Bhat P., Collier A. B. Exchange transfusion as treatment for rasburicase induced methemoglobinemia in a glucose-6-phosphate dehydrogenase deficient patient. – 2008.
- Singh P. et al. Therapeutic whole blood exchange in the management of methaemoglobinemia: case series and systematic review of literature //Transfusion Medicine. – 2020. – Т. 30. – №. 3. – С. 231-239.
Автор статьи
Статьи по теме Лабораторная диагностика
Статьи по теме Разное
Болезни в статье:
- D64.9 Анемия неуточненная
- D74.0 Врожденная метгемоглобинемия
- Q02 Микроцефалия
- H50.9 Косоглазие неуточненное
- R56.8 Другие и неуточненные судороги
- I73.0 Синдром Рейно
- N17-N19 Почечная недостаточность
- N17 Острая почечная недостаточность
- D74.8 Другие метгемоглобинемии
- B54 Малярия неуточненная
- E88.3 Синдром распада опухоли
- R57.9 Шок неуточненный
- J96 Дыхательная недостаточность, не классифицированная в других рубриках
- J43 Эмфизема
Фармгруппы в статье:
Оцените статью:
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
метгемоглобинемия
Метгемоглобинемия (вследствие приема метоклопрамида или дефицита никотинамидадениндинуклеотида (НАДН) цитохрома-b5 в анамнезе), метгемоглобинемия, идиопатическая метгемоглобинемия, наследственная метгемоглобинемия,


