Нестероидные противовоспалительные средства в лечении болезни Альцгеймера: факты и перспективы
Д.м.н. Балашов А.М. Московский НИИ психиатрии Росздрава РФ
НПВС являются на сегодняшний день, вероятно, самыми применяемыми лекарствами, доступными населению. Они отпускаются из аптек как по назначению врача, так и без рецепта. Широкое распространение НПВС обусловлено их эффективностью в подавлении таких общепатологических феноменов, как воспалительные реакции или болевой синдром различного генеза.
Необходимо отметить, что вначале не существовало четких причин для исследования возможной терапевтической значимости НПВС при болезни Альцгеймера (БА), и исходные наблюдения были в определенной мере случайными.
Не задаваясь целью выявить возможную эффективность НПВС в терапии БА, авторы первых наблюдений, скрупулезно фиксировали анамнез и обратили внимание на низкую частоту встречаемости этой патологии у пациентов с ревматоидным артритом по сравнению с общепопуляционными показателями (Beard C.M. et al., 1991). Уже следующее наблюдение, опубликованное в научной литературе, более точно формулировало проблему, констатируя возможное положительное влияние НПВС при БА (Poza-Aldea J.J., Marti-Masso J.F., 1992), а вскоре читателям была представлена гипотеза о новом терапевтическом направлении (Schnabel J., 1993). Повторимся, первоначально клинические испытания с привлечением методологии доказательной медицины не проводились, и работы имели исключительно эмпирический характер (Aisen P.S., 1996). Рассмотрим их результаты более подробно.
Первое клиническое испытание НПВС у пациентов с БА было выполнено с использованием дизайна двойного слепого, плацебо контролируемого исследования. Индометацин назначали в суточной дозе 100–150 мг и регистрировали когнитивные функции в батарее тестов. В группе пациентов, леченых НПВС, с умеренной и средней степенью выраженности проявлений БА ухудшение когнитивных функций в течение полугодового наблюдения было выражено в 6 раз меньше, и различие с группой «плацебо» было статистически значимым (Rogers J. et el., 1993). К середине 90-х годов ХХ в. без существенного теоретического обоснования неоднократно предпринимались попытки изучения опыта клинического применения стероидных и нестероидных противовоспалительных препаратов (в т.ч., сравнительного характера) для купирования проявлений БА. Результаты полутора десятков неконтролируемых исследований суммированы в обзоре Breitner J.C. (1996), в котором сделано заключение о предпочтительности применения НПВС по сравнению с препаратами на основе глюкокортикоидных гормонов.
Дальнейшие работы имели преимущественно эпидемиологическую направленность: например, с применением катамнестических подходов было выполнено исследование на 1686 пациентах с БА, принимавших НПВС, при этом авторы не рассматривали особенности действия конкретных препаратов (Stewart W.F. et al., 1997). Оказалось, что протективный эффект НПВС зависел от длительности приема лекарств: совокупный относительный риск развития БА в группе лиц, принимавших НПВС в течение двух и более лет, оценивался величиной 0,4 по сравнению с 0,65 у тех, кто принимал НПВС менее 2 лет. На риск развития БА не влияли препараты на основе ацетамифена (парацетамола), в действии которого выражен обезболивающий компонент, а противовоспалительные свойства редуцированы. Весьма сходные данные получены при длительном исследовании, проведенном в Балтиморе (Baltimore Longitudinal Study of Aging); в результирующей работе приведены близкие цифры, а использование НПВС рассматривается в качестве предиктора относительно низкого риска развития БА (Zonderman A.B., 2005). Аналогичные результаты были опубликованы в 2002 г., при этом установлено, что, в отличие от НПВС, антагонисты гистаминовых Н2-рецепторов, также демонстрирующие противовоспалительную активность, не являются эффективными (Zandi P.P. et al., 2002).
В законченном в 2002 г. пилотном рандомизированном контролируемом испытании НПВС нимесулида исследовали его эффективность в качестве потенциального средства терапии БА (Aisen P.S. et al., 2002). Сорок пациентов, находившихся на лечении ингибиторами холинэстеразы, получали нимесулид (100 мг per os 2 раза в день) или плацебо в течение 12 нед при двойном слепом контроле. В течение последующих 12 нед НПВС назначали всем пациентам, а те, кто хорошо переносил препарат и чувствовал улучшение, были включены в следующую 2-летнюю фазу испытаний. По результатам исследования было сделано заключение, что, в противоположность длительному применению, кратковременная терапия нимесулидом не приводит к значительным изменениям скорости ухудшения показателей когнитивного дефицита, общего клинического состояния, жизненной активности, аффективного статуса или поведения. Вероятно, назначение нимесулида пациентам с БА должно осуществляться в течение длительного времени.
В популяционном исследовании, проведенном в Швеции, в котором принимали участие 702 пациента старше 80 лет с БА, изучали зависимость развития когнитивных нарушений от приема НПВС, назначаемых с целью профилактики после ишемического инсульта или продолжительных приступов стенокардии (Nilsson S.E. et al., 2003). Установлено, что прием высоких доз ацетилсалициловой кислоты статистически значимо уменьшает распространенность и прогрессирование когнитивных нарушений. Назначение низких доз ацетилсалициловой кислоты, а также парацетамола или D-пропоксифена приводило к сходным протективным реакциям, не достигавшим, однако, статистической значимости.
Весьма впечатляющее проспективное исследование было закончено в 2001 г. (Bas A. et al., 2001). Авторами представлены результаты продолжительного наблюдения за 6989 субъектами старше 55 лет, у которых на момент включения в программу не выявлялись признаки БА. Среди исследуемых были выделены четыре группы: 1-я — не употреблявшие НПВС и три группы употреблявших НПВС: 2-я — короткое время (менее 1 мес за весь период наблюдения); 3-я — промежуточное время (от 1 мес до 2 лет) и 4-я — более 2 лет. Факт употребления препаратов подтверждался документально выписками из аптек. В течение выполнения программы (средний срок наблюдения — 6,8 лет) БА сформировалась у 293 пациентов. Относительно общей популяции риск развития этой патологии составил 0,95 — в группе 2; 0,83 — в группе 3 и 0,20 — в группе 4;. при этом не была установлена зависимость этих показателей от возраста испытуемых. Из представленных данных следует строгий вывод о позитивном профилактическом влиянии НПВС на возникновение БА.
Необходимо отметить, что в литературе также представлены результаты клинических испытаний с негативным результатом; таковы исследования напроксена и селективного ингибитора ЦОГ-2 рофекоксиба (Aisen P.S. et al., 2003, Reines S.A. et al., 2004), диклофенака в комбинации с мизопростолом (Scharf S. et al., 1999).
В наиболее авторитетной и известной качественным мета-анализом кохрейновской базе данных суммированы и проанализарованы результаты всех плацебо контролируемых исследований ибупрофена при БА (Tabet N., Feldman H., 2003). Авторы делают вывод о целесообразности применения этого НПВС для коррекции когнитивных нарушений. Вместе с тем, аналогичный анализ, проведенный теми же авторами в отношении другого сходного препарата индометацина, привел к отрицательным рекомендациям (Tabet N., Feldman H., 2002).
Результаты приведенных клинических исследований спровоцировали научную дискуссию, развивающуюся до сегодняшнего дня в двух направлениях: выяснение патогенетической обоснованности использования НПВС при БА и уточнение терапевтической эффективности этих препаратов, в т.ч., их индивидуальной активности. Первому направлению, в основном, посвящены нижеследующие разделы настоящей публикации.
Однако прежде целесообразно охарактеризовать патогенетические механизмы формирования БА. Данные современных научных исследований позволяют полагать, что в патогенезе БА ведущую роль играют нарушения активности ацетилхолиновой системы, главным образом, в коре головного мозга и гиппокампе — областях, участвующих в формировании высших интеллектуальных функций и процессов памяти. Менее известной остается роль нейрохимических этиологических факторов, приводящих к дефициту функционирования холинергических нейронов. Сложность создания ясной патогенетической картины развития БА обусловлена обилием фактов, свидетельствующих о возможной вовлеченности в патологический процесс многочисленных функциональных компонентов нервной системы.
Предполагается, что в качестве причины повреждения ацетилхолиновых нейронов могут выступать хронические воспалительные реакции, оксидативный (гиперпродукция активных форм кислорода) и нитрозилактивный (вызванный образованием реакционноспособных молекул, содержащих азот) стресс (Prasad K.N. et al., 2002). Ранние стадии патологии обусловлены повреждением митохондрий и ингибированием протеасом, тогда как более поздние процессы визуализируются гистологически и характеризуются накоплением и отложением бета-амилоида (Аβ) и образованием сенильных бляшек. Как видно на схеме, помимо Аβ в процессе образования сенильных бляшек принимают участие клубки фибрилл, в свою очередь, формирующиеся из гиперфосфорилированного тау-белка (Hull M.H. et al., 2000).
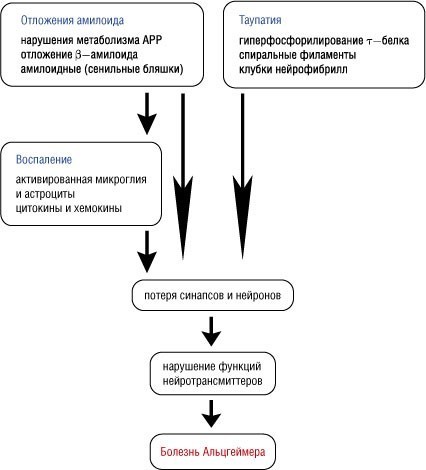
Схема. Основные патогенетические звенья болезни Альцгеймера (адаптировано из NeuroRx.- 2005.- 2(4).- P. 612–626.)
В основе нарушений функционирования медиаторных систем, главным образом ацетилхолиновых, лежит дегенерация нейронов, в свою очередь, вызванная действием трех факторов: нарушение метаболизма амилоида, воспалительные реакции (которые зависят от амилоидного пути) и накопление извращенных клубочковых форм нейрофибрилл (что обусловлено нарушениями обмена нормального компонента фибрилл — тау-белка). Большинство исследователей главным пусковым патогенетическим механизмом БА полагают амилоид-зависимый путь.
Известно, что белок амилоид представляет собой нормальный компонент плазматических мембран клеток и может подвергаться деградации при помощи двух ферментов: α- и β-секретаз. В первом случае продуктом реакции является непатогенный полипептид — α-предшественник амилоидных пептидов (α-APPs), во втором — более короткий фрагмент — β-предшественник амилоидных пептидов (β-APPs). Остающаяся в мембране после действия β-секретазы часть молекулы может расщепляться далее ферментом γ-секретазой с образованием коротких растворимых пептидов: Аβ-42, Аβ-40 и т.д. (число означает количество аминокислотных остатков в структуре Аβ). Короткие молекулы Аβ способны к агрегации, запуская каскад процессов, приводящих к гибели клеток.
Таким образом, согласно современным представлениям о механизмах развития БА, что поиск потенциальных терапевтических средств следует проводить среди (Zimmermann M. et al., 2005):
- веществ, снижающих гибель нейронов (например, блокаторов NMDA-рецепторов);
- противовоспалительных препаратов нестероидной и, возможно, стероидной природы;
- соединений, активирующих ацетилхолиновую нейротрансмиссию (ингибиторы ацетилхолинэстеразы, активаторы ацетилхолиновых рецепторов);
- антиоксидантов, поскольку перекисные процессы являются одним из главных повреждающих механизмов при воспалении;
- активаторов α-секретазы для сдвига обмена амилоида в сторону α-пути и минимизации образования Аβ;
- иммуноактивных веществ.
Из перечисленных групп препаратов к настоящему времени одобрены для клинического применения лишь ингибиторы ацетилхолинэстеразы, к которым в 2004 г. в США присоединился препарат мемантин, представляющий собой блокатор NMDA-рецепторов (Lleo A. et al., 2006). Представители остальных фармакологических групп пока используются только в исследовательских целях. Необходимо отметить, что эффективность фармакотерапии БА находится на очень низком уровне вне зависимости от применяемых препаратов (Frank B, Gupta S., 2005, Jelic V. et al., 2006). Однако вернемся к рассмотрению НПВС.
Противовоспалительное действие НПВС в ЦНС. Экспериментальное подтверждение возможности противовоспалительного действия препаратов основано на общих представлениях об основной мишени для НПВС — ЦОГ, доступность которой для субстрата (арахидоновой кислоты) уменьшается в присутствии этих лекарств (Vane J.R., Botting R.M., 1998).
В модельном исследовании, выполненном на препаратах крови людей 85-летнего возраста были получены данные, которые свидетельствовали об угнетении образования индометацином и ацетилсалициловой кислотой ПГЕ2. Снижение уровня ПГ приводило к уменьшению продукции ИЛ-6, усиленной после первичной стимуляции тромбином или липополисахардами (Bour A.M. et al., 2000).
В экспериментах на животных было установлено, что при введении индометацина на фоне стимуляции липополисахаридами наблюдается супрессия ИЛ-6-зависимой активации высвобождения ПГЕ2. Сдвиг биохимических параметров сопровождается поведенческими реакциями: индометацин в тесте активного избегания обращает амнезию, вызванную липополисахаридами (Ma T.C., Zhu X.Z., 1997). Ибупрофен при пероральном введении восстанавливает нарушенные когнитивные функции у экспериментальных животных. При прекращении приема НПВС эффект не сохраняется (Richardson R.L. et al., 2002).
В различных культурах клеток НПВС (ибупрофен, индометацин, сулиндак) ингибируют образование Аβ-42, максимально — на 80% (Weggen S. et al., 2001). Этот эффект, не связанный с ингибированием ЦОГ, специфичен по отношению именно к этому пептиду, поскольку уровень Аβ-38 увеличивается; вероятно, действие НПВС обусловлено влиянием на фермент гамма-секретазу. Помимо этого, НПВС демонстрируют уникальные свойства по отношению к биофизическим характеристикам Аβ. Они, с одной стороны, ингибируют агрегацию Аβ, в т.ч., вызванную Al3+, а с другой — предотвращают образование его складчатой бета-структуры (Thomas T. et al., 2001). Подобные эффекты не наблюдаются при применении других препаратов, использующихся для лечения БА.
Механизмы влияния НПВС на медиаторные системы. Считается, что влияние НПВС на нейромедиаторные и модуляторные системы головного мозга, в основном, опосредовано продуктами метаболизма липидов, изменяющегося вследствие их основного эффекта — ингибирования ЦОГ, имеющей отношение к метаболизму липидов, и в частности, к синтезу ПГ. В ранних исследованиях предполагалось, что эффективность НПВС в отношении того или иного патологического процесса подразумевает вовлеченность ПГ.
Например, с этих позиций рассматривались результаты о том, что индометацин в концентрациях, превышающих 100 мкМ, (но не ацетилсалициловая кислота) в экспериментах in vitro предотвращает дегенерацию нейронов в срезах мозжечка 7-дневных крыс после экспозиции с NMDA (Lehmann A., 1987). Другой представитель НПВС — кеторолак — предотвращает и блокирует электрическую активность нейронов, вызванную NMDA (Sotgiu M.L. et al., 1998).
Иная возможность реализации действия НПВС на рецепторы NMDA проиллюстрирована нейрохимическими исследованиями. При подкожном введении диклофенак обнаруживается в головном мозге и на этом фоне увеличивается концентрация кинуреиновой кислоты в ЦНС, главным образом, в среднем мозге и люмбо-сакральных отделах спинного мозга. Диклофенак опосредованно приводит к уменьшению активности системы возбуждающих аминокислот, что, с одной стороны, патогенетично по отношению к БА, а с другой — может служить объяснением одного из центральных механизмов обезболивающего действия НПВС (Edwards S.R. et al., 2000).
Таким образом, имеются как параклинические данные, так и результаты клинических наблюдений, свидетельствующие о патогенетически обоснованной эффективности НПВС при БА. Справедливости ради следует отметить, что подобно иным фармакотерапевтическим подходам к лечению БА, активность НПВС как препаратов, способствующих обратному развитию болезни, весьма незначительна. Доказанной представляется способность НПВС при длительном применении выражено снижать риск формирования этой патологии. Означает ли это, что адекватной является рекомендация длительного назначения НПВС с указанными целями? Однозначного ответа на этот вопрос пока нет.
Литература
Aisen P.S. Inflammation and Alzheimer disease// Mol. Chem. Neuropathol.- 1996.- 28.- P. 83–88.
Aisen P.S. The potential of anti-inflammatory drugs for the treatment of Alzheimer`s disease// Lancet. Neurol.- 2002.- 1.- P. 279–284.
Aisen P.S., Schafer K.A., Grundman M. et al. Effects of rofecoxib or naproxen vs placebo on Alzheimer`s disease progression: a randomized controlled trial// JAMA.- 2003.- 289.- P. 2819–2826.
Aisen P.S., Schmeidler J., Pasinetti G.M. Randomized pilot study of nimesulide treatment in Alzheimer`s disease// Neurology.- 2002.- 58.- P. 1050–1054.
Bas A., Ruitenberg A., Hofman A., Launer L.J., van Duijn C.M., Stijnen T., Breteler M.M.B, Stricker B.H.C. Nonsteroidal Antiinflammatory Drugs and the Risk of Alzheimer`s Disease// New England J. Med.- 2001.- Volume 345.- № 21.- P. 1515–1521.
Beard C.M., Kokman E., Kurland L.T. Rheumatoid arthritis and susceptibility to Alzheimer`s disease// Lancet.- 1991.- Jun. 8.- 337 (8754).- P. 1426.
Bour A.M., Westendorp R.G., Laterveer J.C. et al. Interaction of indomethacin with cytokine production in whole blood. Potential mechanism for a brain-protective effect// Exp. Gerontol.- 2000.- 35.- P. 1017–1024.
Breitner J.C. The role of anti-inflammatory drugs in the prevention and treatment of Alzheimer`s disease// Annu Rev. Med.- 1996.- 47.- P. 401–411.
Cutler N.R., Sramek J.J. Review of the next generation of Alzheimer`s disease therapeutics: challenges for drug development// Prog. Neuropsychopharmacol. Biol. Psychiatry.- 2001.- 25.- P. 27–57.
Edwards S.R., Mather L.E., Lin Y. et al. Glutamate and kynurenate in the rat central nervous system following treatments with tail ischaemia or diclofenac// J. Pharm. Pharmacol.- 2000.- 52.- P. 59–66.
Frank B., Gupta S. A review of antioxidants and Alzheimer`s disease// Ann. Clin. Psychiatry.- 2005.- Oct.-Dec.- 17(4).- P. 269–286.
Hoozemans J.J., Veerhuis R., Rozemuller A.J., Eikelenboom P. Non-steroidal antiinflammatory drugs and cyclooxygenase in Alzheimer`s disease// Curr. Drug Targets.- 2003.- 4.- P. 461–468.
Hull M.H., Fiebich B.L., Lieb K. Strategies to delay the onset of Alzheimer`s disease// EXS. 2000.- 89.- P. 211–225.
Jelic V., Kivipelto M., Winblad B.Clinical trials in mild cognitive impairment: lessons for the future// J. Neurol. Neurosurg. Psychiatry.- 2006.- Apr.- 77(4).- P. 429–438.
Lehmann A. Pharmacological protection against the toxicity of N-methyl-D-aspartate in immature rat cerebellar slices// Neuropharmacology.- 1987.- 26.- P. 1751–1761.
Lleo A., Greenberg S.M., Growdon J.H. Current pharmacotherapy for Alzheimer`s disease// Annu. Rev. Med.- 2006.- v. 57.- P. 513–533.
Ma T.C., Zhu X.Z. Suppression of lipopolysaccharide-induced impairment of active avoidance and interleukin-6-induced increase of prostaglandin E2 release in rats by indometacin// Arzneimittelforschung.- 1997.- 47.- P. 595–597.
Mackenzie I.R. Postmortem studies of the effect of anti-inflammatory drugs on Alzheimer-type pathology and associated inflammation// Neurobiol. Aging.- 2001.- 22.- P. 819–822.
Maillard M., Burnier M. Comparative cardiovascular safety of traditional nonsteroidal anti-inflammatory drugs// Expert Opin. Drug Saf.- 2006.- 5(1).- P. 83–94.
Nilsson S.E., Johansson B., Takkinen S. et al. Does aspirin protect against Alzheimer`s dementia? A study in a Swedish population-based sample aged >or = 80 years// Eur. J. Clin. Pharmacol.- 2003.- 59.- P. 313–319.
Poza-Aldea J.J., Marti-Masso J.F. Chronic NSAID consumption and Alzheimer`s disease// Neurologia.- 1992.- 7(2).- P. 85.
Prasad K.N., Cole W.C., Prasad K.C. Risk factors for Alzheimer`s disease: role of multiple antioxidants, non-steroidal anti-inflammatory and cholinergic agents alone or in combination in prevention and treatment// J. Am. Coll. Nutr.- 2002.- 21.- P. 506–522.
Reines S.A., Block G.A., Morris J.C. et al. Rofecoxib: no effect on Alzheimer`s disease in a 1-year, randomized, blinded, controlled study// Neurology.- 2004.- 62.- P. 66–71.
Richardson R.L., Kim E.M., Shephard R.A. et al. Behavioural and histopathological analyses of ibuprofen treatment on the effect of aggregated Abeta(1–42) injections in the rat// Brain. Res.- 2002.- 954.- P. 1–10.
Rogers J., Kirby L.C., Hempelman S.R. et al. Clinical trial of indomethacin in Alzheimer`s disease// Neurology.- 1993.- 43.- P. 1609–1611.
Scharf S., Mander A., Ugoni A. et al. A double-blind, placebo-controlled trial of diclofenac/misoprostol in Alzheimer`s disease// Neurology.- 1999.- 53.- P. 197–201.
Schnabel J. New Alzheimer`s therapy suggested// Science.- 1993.- 260 (5115).- P. 1719–1720.
Sotgiu M.L., Biella G., Formaglio F., Marchettini P. Central effect of ketorolac involving NMDA receptors activity// Brain. Res.- 1998.- 813.- P. 223–226.
Stewart W.F., Kawas C., Corrada M., Metter E.J. Risk of Alzheimer`s disease and duration of NSAID use// Neurology.- 1997.- 48.- P. 626–632.
Tabet N., Feldman H. Ibuprofen for Alzheimer`s disease// Cochrane Database Syst. Rev.- 2003.- 2.- CD004031.
Tabet N., Feldman H. Indomethacin for the treatment of Alzheimer`s disease patients// Cochrane Database Syst. Rev.- 2002.- 2.- CD003673.
Thomas T., Nadackal T.G., Thomas K. Aspirin and non-steroidal anti-inflammatory drugs inhibit amyloid-beta aggregation// Neuroreport.- 2001.- 12.- P. 3263–3267.
Vane J.R., Botting R.M. Mechanism of action of antiinflammatory drugs// Int. J. Tissue React.- 1998.- 20.- P. 3–15.
Weggen S., Eriksen J.L., Das P. et al. A subset of NSAIDs lower amyloidogenic Abeta42 independently of cyclooxygenase activity// Nature.- 2001.- 414.- P. 212–216.
Zandi P.P., Anthony J.C., Hayden K.M. et al. Reduced incidence of AD with NSAID but not H2 receptor antagonists: the Cache County Study// Neurology.- 2002.- 59.- P. 880–886.
Zimmermann M., Gardoni F., Di Luca M. Molecular rationale for the pharmacological treatment of Alzheimer`s disease// Drugs Aging.- 2005.- v. 22.- Suppl 1.- P. 27–37.
Zonderman A.B. Predicting Alzheimer`s disease in the Baltimore Longitudinal Study of Aging// J. Geriartr. Psychiatry Neurol.- 2005.- v. 18.- No 4.- P. 192–195.


