Селективный ингибитор обратного захвата серотонина и норадреналина Венлафаксин Органика: результаты исследования биоэквивалентности

Селективный ингибитор обратного захвата серотонина и норадреналина Венлафаксин Органика: результаты исследования биоэквивалентности
И.О. Гладышев1, Е.В. Бородулина2, О.О. Папсуев1
1Московский научно-исследовательский институт психиатрии – филиал ФГБУ «ФМИЦПН им. В.П. Сербского» Минздрава России.
2ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук» «Научно-исследовательский институт фармакологии и регенеративной медицины им. Е.Д.Гольдберга».
Резюме: В статье представлены результаты открытого, сравнительного, рандомизированного, двухэтапного перекрестного исследования биоэквивалентности двух препаратов (Венлафаксин Органика и Велаксин) при приеме здоровыми добровольцами. Проведен анализ фармакокинетики действующего вещества – венлафаксина и активного метаболита О-дезметилвенлафаксина. Полученные доверительные интервалы лежат в пределах, указывающих на сопоставимую биодоступность как венлафаксина, так и активного метаболита О-дезметилвенлафаксинапри приеме исследуемого препарата и препарата сравнения.
Несмотря на успехи «второй психофармакологической революции», ознаменовавшейся синтезом селективных ингибиторов обратного захвата серотонина (СИОЗС), существенная доля больных остается резистентной к лечению тимоаналептиками [13]. Такое положение определило актуальность поиска новых антидепрессантов. Особое внимание уделялось изучению эффективности и переносимости тимоаналептиков, обладающих специфическим серотонинергическим и норадренергическим действием – селективных ингибиторов обратного захвата серотонина и норадареналина (СИОЗСН). Представителем этой группы антидепрессантов является венлафаксин. По данным исследований [2, 25, 26], венлафаксин обладает своеобразным профилем фармакологической активности: согласно теории последовательной ингибиции обратного захвата моноаминов, сформулированной S.Preskorn, в низкой дозе проявляется серотонинергическое действие препарата, при повышении дозы до средней включается норадренергическое, а последующее увеличение дозы приводит к дофаминергическому эффекту венлафаксина [30]. Подобная дифференциация фармакологического действия приводит к повышению клинической эффективности данного препарата и расширяет показания для его применения. Венлафаксин не имеет сродства к м-холинорецепторам, α1-адренорецепторам, гистаминовым Н1-рецепторам, бензодиазепиновым и опиоидным рецепторам. Такой избирательный механизм действия препарата на нейротрансмиттерные системы обеспечивает достижение максимального эффекта с более широким профилем безопасности и переносимости при терапии аффективных расстройств. В ряде исследований была доказана прямая корреляционная связь между дозировкой венлафаксина, концентрацией препарата в крови и его эффективностью [16]. По выраженности антидепрессивного эффекта венлафаксин значимо превосходит плацебо, по данным ряда исследований процент респондеров при терапии венлафаксином составил 65% против 28% [27, 31, 32]. В низких и средних дозах препарат нашел свое применение как аналог СИОЗС для терапии депрессий легкой и умеренной тяжести, а также тревожных расстройств [17]. При реализации стратегии быстрого наращивания дозировок клинические эффекты венлафаксина приближаются к свойствам трициклических антидепрессантов, что обеспечивает высокую эффективность препарата при терапии тяжелых эндогенных депрессий [19, 23]. В серии сравнительных исследований получены данные, свидетельствующие о высокой эффективности венлафаксина при лечении рекуррентной депрессии в сравнении с такими эталонными препаратами как амитриптилин и имипрамин [25, 33], а также с препаратами класса СИОЗС [34]. Кроме того, в случаях, когда препарат назначают в высоких дозах, наблюдается быстрое начало действия, что, наряду с вышеописанными эффектами, имеет важные клинические последствия: снижение суицидального риска, необходимости в госпитализации амбулаторных пациентов, риска отказа от лечения.
Современные клинические исследования демонстрируют, что около 30% больных большой депрессией не поддаются лечению одним антидепрессантом, назначенным в адекватной дозе на период, достаточный для получения лечебного эффекта [3]. Резистентность к терапии ведет к нарушению фармакоэкономических соотношений, отражающих, в том числе эффективность, безопасность и качество жизни при использовании текущей схемы лечения. В ряде клинических исследований показана эффективность венлафаксина при смене антидепрессанта в случае терапевтической резистентности [12, 28, 35]. При выборе антидепрессивной терапии оправдано также учитывать противорецидивное действие препарата, что впоследствии благоприятно сказывается как на качестве жизни пациента, так и на фармакоэкономических показателях. Ряд публикаций свидетельствует о высокой эффективности венлафаксина для предотвращения экзацербации депрессии [20, 21]. Данные научных обзоров указывают на широкий спектр применения венлафаксина, этот препарат зарекомендовал себя при генерализованном тревожном расстройстве, паническом расстройстве, ОКР, социальной фобии, посттравматическом стрессовом расстройстве, депрессивных расстройствах у детей и подростков, головной боли напряжения и мигрени, кокаиновой наркомании, коморбидной с депрессивными расстройствами, трихотилломании, расстройстве дефицита внимания, хронической боли, фибромиалгии [1].
Материалы и методы
Целью изучения биоэквивалентности препарата Венлафаксин Органика (таблетки, покрытые пленочной оболочкой, 75 мг, производства АО «Органика» Россия) и зарегистрированного препарата Велаксин (таблетки 75 мг, производства АО «Фармацевтический завод ЭГИС» Венгрия) было проведено открытое, сравнительное, рандомизированное, двухэтапное перекрестное исследование биоэквивалентности двух препаратов при приеме здоровыми добровольцами однократной дозы каждого из них натощак (рис. 1). Дизайн исследования биоэквивалентности был разработан на основании литературных данных о фармакокинетических свойствах действующих веществ, клинических аспектах применения, форме выпуска, в соответствии с принципами Хельсинкской Декларации, законодательной базой РФ и другими регламентирующими документами [4, 6–9, 11, 18, 19).
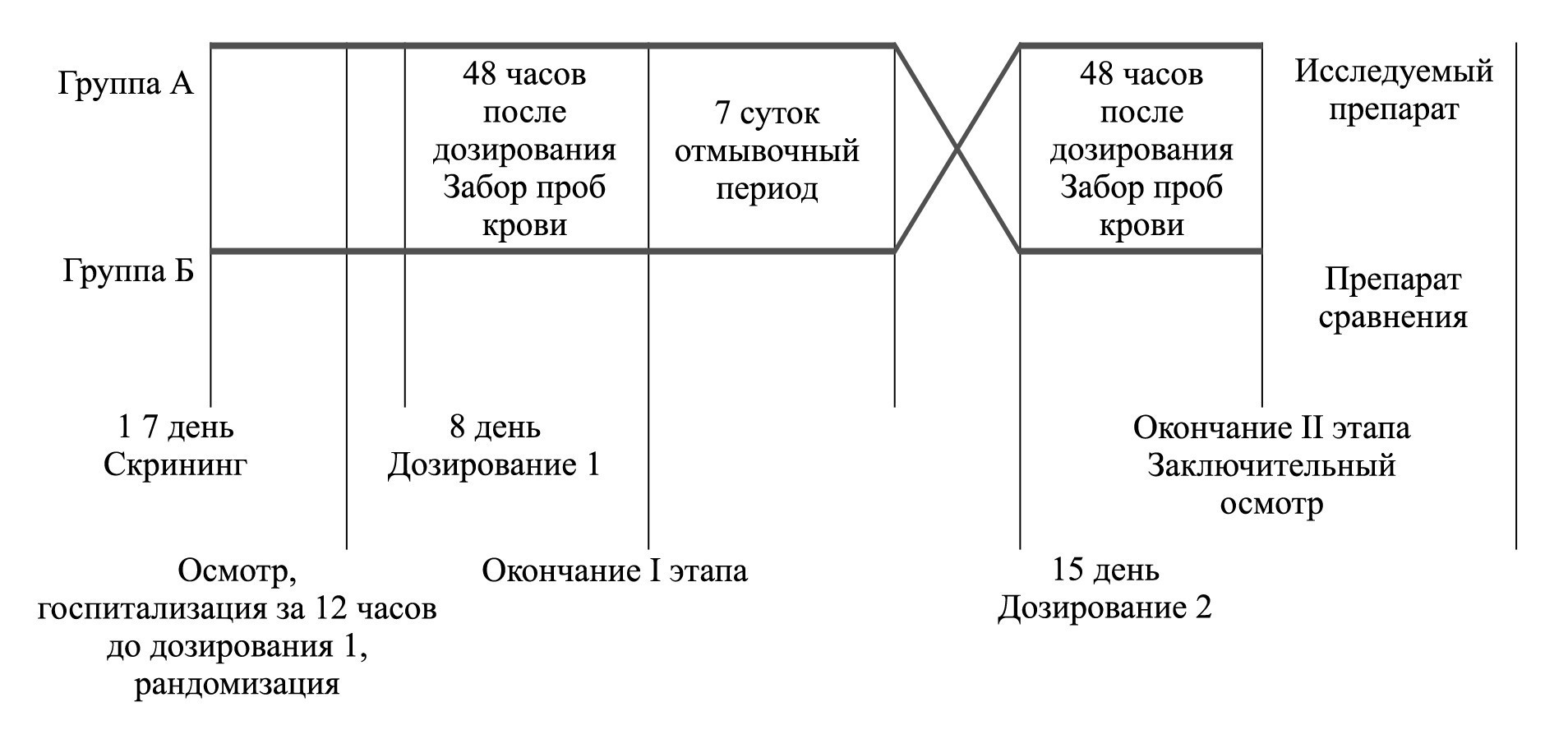
Рис.1. Дизайн исследования
Примечания: 1 Исследование проводилось на базе ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук» «Научно-исследовательский институт фармакологии и регенеративной медицины имени Е.Д.Гольдберга».
Задачи исследования:
1. Оценить фармакокинетические параметры венлафаксина и его активного метаболита О-дезметилвенлафаксина в крови после однократного приема внутрь препаратов Венлафаксин Органика, таблетки, покрытые пленочной оболочкой, 75 мг (производства АО «Органика», Россия) и Велаксин, таблетки 75 мг (АО «Фармацевтический завод ЭГИС», Венгрия).
2. Сопоставить фармакокинетические параметры венлафаксина и его активного метаболита О-дезметилвенлафаксина в крови после однократного приема внутрь препаратов Венлафаксин Органика, таблетки, покрытые пленочной оболочкой, 75 мг (производства АО «Органика», Россия) и Велаксин таблетки 75 мг (АО «Фармацевтическийзавод ЭГИС», Венгрия).
3. Оценить и сопоставить безопасность и переносимость препаратов Венлафаксин Органика, таблетки, покрытые пленочной оболочкой, 75 мг (производства АО «Органика», Россия) и Велаксин, таблетки 75 мг (АО «Фармацевтический завод ЭГИС», Венгрия) при однократном приеме натощак.
В качестве препарата сравнения было использовано соответствующее лекарственное средство, зарегистрированное в РФ.
В соответствии с Методическими указаниями Министерства здравоохранения и социального развития Российской Федерации [5] в исследование включались добровольцы, соответствующие критериям включения/исключения.
В исследовании приняло участие 24 добровольца мужского пола, европеоидной расы, в возрасте от 18 до 45 лет, не курящих, имеющих верифицированный диагноз «здоров» по данным стандартных клинических, лабораторных и инструментальных методов обследования, с индексом массы тела (ИМТ) от 18,5 до 28 кг/м2, подписавших Информационный листок добровольца с формой информированного согласия и обязавшихся соблюдать адекватный метод контрацепции на протяжении всего времени от момента подписания Информационного листка до момента завершения участия в исследовании. В ходе подготовки к исследованию был осуществлен также подбор четырех дублеров на случай замены выбывших из исследования добровольцев. Дублеры до начала исследования также подписали Информационный листок добровольца с формой информированного согласия и прошли обследование в том же объеме, что и включенные в исследование добровольцы.
Исследуемые препараты принимались внутрь и запивались определенным количеством воды (200 мл). Добровольцы были дополнительно проинструктированы о том, что они не должны разжевывать таблетки перед их проглатыванием. После приема препарата проводилась проверка рук и осмотр ротовой полости для того, чтобы убедиться, что препарат проглочен. Основываясь на фармакокинетических свойствах, концентрация венлафаксина и его активного метаболита О-дезметилвенлафаксина в плазме крови определялась исходно (перед приемом препарата) и через 30 минут, 1 час, 1 час 30 минут, 2 часа, 2 часа 30 минут, 3, 4, 6, 8, 12, 24, 36 и 48 часов (всего 14 образцов плазмы крови).
С целью изучения безопасности исследуемого препарата у добровольцев забирались образцы крови для лабораторных исследований, а также проводились клинические и физикальные обследования на протяжении исследования в соответствии с графиком исследования.
После подписания информированного согласия проводилось клиническое и параклиническое обследование добровольцев. В лабораторных показателях крови и мочи на этапе скрининга отклонений от референсных значений выявлено не было. Все 24 добровольца, включенные в исследование, соответствовали критериям включения/исключения. Добровольцы соблюдали ограничения по приемужидкости и пищи как на первом, так и на втором этапах. Отбор проб крови выполнялся из локтевой вены через запланированные интервалы времени для всех добровольцев. Отклонений от запланированных интервалов времени забора крови зафиксировано не было. Все образцы плазмы были приготовлены согласно инструкции, указанной в протоколе исследования. Во время исследования проводилось динамическое наблюдение за добровольцами в период отбора образцов крови. Перед вторым периодом исследования проводилось повторное обследование добровольцев, включавшее врачебный осмотр, клинико-инструментальные исследования и лабораторные тесты. Все добровольцы были допущены ко второму периоду исследования. Наблюдение за добровольцами в течение второго периода отбора образцов крови осуществлялось так же, как и в первом периоде. После завершения второго периода исследования проводились заключительный врачебный осмотр, лабораторные анализы крови и мочи, а также регистрация ЭКГ в 12 отведениях.
Полученные данные статистически обработаны в программе Phoenix WinNonlin 6.3.
Рассчитаны следующие статистические параметры: среднее арифметическое значение (СА), среднее геометрическое значение (СГ), стандартное отклонение среднего результата (СО), стандартная ошибка (СОш), доверительный интервал (ДИ), коэффициент вариации (КВ), медиана (Мед). Достоверность различий оценивалась с помощью программы ANOVA при доверительной вероятности 90% послелогарифмических преобразований значений фармакокинетических параметров.
Препараты считаются биоэквивалентными, если 90% доверительный интервал для геометрического среднего, вычисленного для индивидуальных отношений логарифмически преобразованных значений каждого из перечисленных фармакокинетических параметров за исключением Сmax для венлафаксина и О-дезметилвенлафаксина для исследуемого препарата к таковым для венлафаксина и О-дезметилвенлафаксина в составе препарата сравнения, находится в пределах 0,80–1,25. Для Сmax соответствующие пределы составляют 0,75–1,33.
Один из добровольцев (№8) был досрочно исключен из исследования в связи с развитием нежелательного явления (тошнота, рвота), данные, полученные при его обследовании, в анализе не использовались.
В ходе исследования определялись следующие фармакокинетические параметры: максимальное экспериментальное значение концентраций в плазме крови после однократного приема препарата (Cmax, время до достижения максимальной концентрации действующего вещества (Tmax), площадь под экспериментальной кривой концентрации в плазме крови после одной дозы препарата до последней временной точки определения концентрации (AUC0t), площадь под экспериментальной кривой концентрации в плазме крови после приема одной дозы препарата, экстраполированной в бесконечность (AUC0∞), рассчитываемая по формуле ![]() ,где Ct – расчетное значение лекарственного вещества в последней пробе и Kel – константа элиминации соответственно. Для вычисления данныхзначений моноэкспоненциальный участок фармакокинетической кривой описывался при помощи нелинейного регрессионного анализа. Параметры Cmax и Tmax получались непосредственно в ходе эксперимента, площадь под кривой вычислялась исходя из экспериментальных данных о концентрации венлафаксина и О-дезметилвенлафаксина по формуле трапеций. При достаточной длительности наблюдения, когда AUC0t>80% AUC0∞, для оценки полноты абсорбции исследуемого препарата использовалось значение AUC0t, а при условии, что AUC0t<80% AUC0∞, – значение AUCAUC0∞. Также оценивались: период полувыведения (Т1/2), среднее время удержания препарата в организме (MRT), относительная биодоступность препарата, определяемая отношением AUC0∞, Т/AUC0∞, R (f’), относительная степень абсорбции, определяемая отношением AUC0t,T/AUC0t, R (f), отношение Сmax, T/Сmax, R (f’’), отношение Сmax/AUC0t, отношение Сmax/AUC0∞.
,где Ct – расчетное значение лекарственного вещества в последней пробе и Kel – константа элиминации соответственно. Для вычисления данныхзначений моноэкспоненциальный участок фармакокинетической кривой описывался при помощи нелинейного регрессионного анализа. Параметры Cmax и Tmax получались непосредственно в ходе эксперимента, площадь под кривой вычислялась исходя из экспериментальных данных о концентрации венлафаксина и О-дезметилвенлафаксина по формуле трапеций. При достаточной длительности наблюдения, когда AUC0t>80% AUC0∞, для оценки полноты абсорбции исследуемого препарата использовалось значение AUC0t, а при условии, что AUC0t<80% AUC0∞, – значение AUCAUC0∞. Также оценивались: период полувыведения (Т1/2), среднее время удержания препарата в организме (MRT), относительная биодоступность препарата, определяемая отношением AUC0∞, Т/AUC0∞, R (f’), относительная степень абсорбции, определяемая отношением AUC0t,T/AUC0t, R (f), отношение Сmax, T/Сmax, R (f’’), отношение Сmax/AUC0t, отношение Сmax/AUC0∞.
Результаты
Основные результаты исследования представлены в таблицах 1–8.
Таблица 1. Параметры относительной биодоступности венлафаксина*
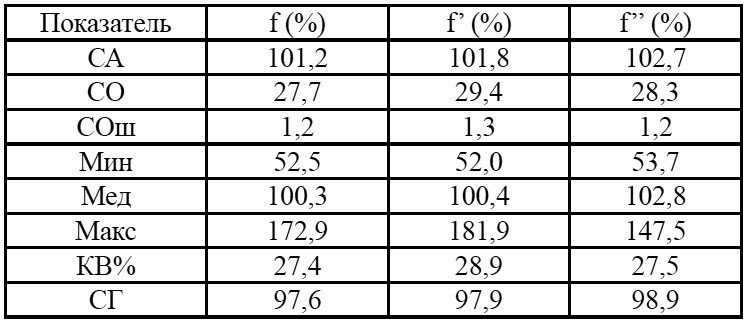
Примечания: * – после однократного приема препаратов Венлафаксин Opганика (T) и препарата сравнения Велаксин (R); f – относительная степень всасывания (относительная биодоступность) лекарственного средства, определяемая отношением AUC0∞, T/AUCAUC0∞, R; f’ – относительная степень всасывания лекарственного средства, определяемая отношением AUC0t, T/AUC0t, R; f” – отношение Сmax, T/Сmax, R.
Таблица 2. Параметры относительной биодоступности О-дезметилвенлафаксина*
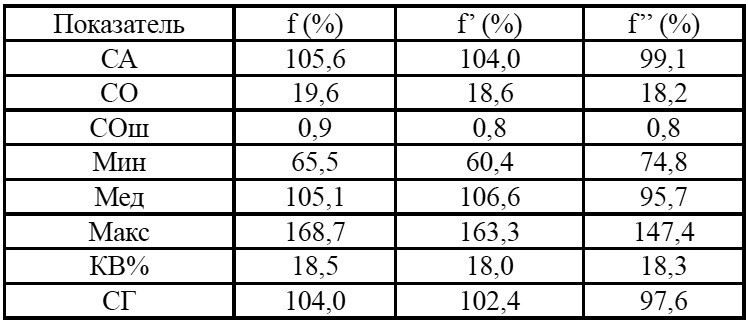
Примечания: * – после однократного приема препаратов Венлафаксин Opганика (T) и препарата сравнения Велаксин (R); f – относительная степень всасывания (относительная биодоступность) лекарственного средства, определяемая отношением AUC0t, T/AUC0∞, R; f’ – относительная степень всасывания лекарственного средства, определяемая отношением AUC0t, T/AUC0t, R; f” – отношение Сmax, T/Сmax, R.
Таблица 3. Статистическая оценка биоэквивалентности препаратов Венлафаксин Opганика и препарата сравнения по венлафаксину
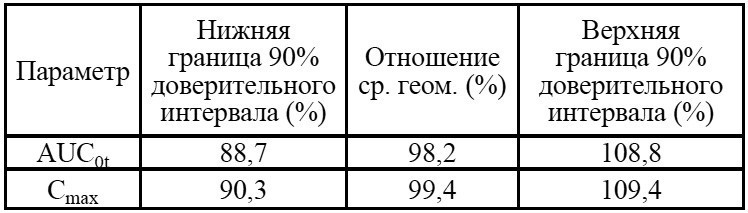
Таблица 4. Статистическая оценка биоэквивалентности препаратов Венлафаксин Opганика и препарата сравнения по О-дезметилвенлафаксину
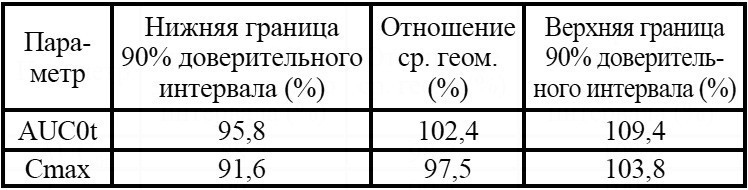
Таблица 5. Групповые значения фармакокинетических параметров венлафаксина после приема препарата Венлафаксин Opганика**
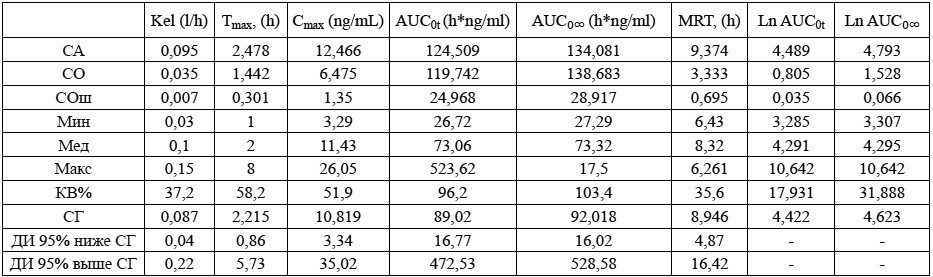
Примечания: ** – Венлафаксин, 75 мг, таблетки, АО «Opганика», Россия (T); Ln – натуральный логарифм.
Таблица 6. Групповые значения фармакокинетических параметров венлафаксина после приема препарата Велаксин**
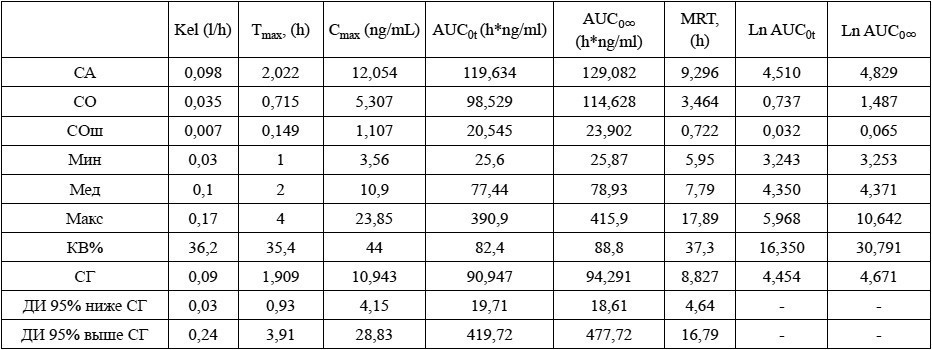
Примечания: ** – Венлафаксин, 75 мг, таблетки, АО «Фармацевтический завод ЭГИС», Венгрия (R); Ln – натуральный логарифм.
Таблица 7. Групповые значения фармакокинетических параметров О-дезметилвенлафаксина после приема препарата Венлафаксин Opганика**
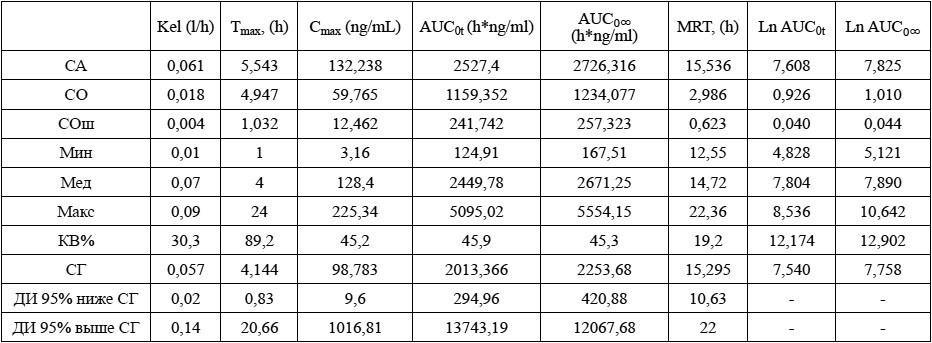
Таблица 8. Групповые значения фармакокинетических параметров венлафаксина после приема препарата Велаксин**
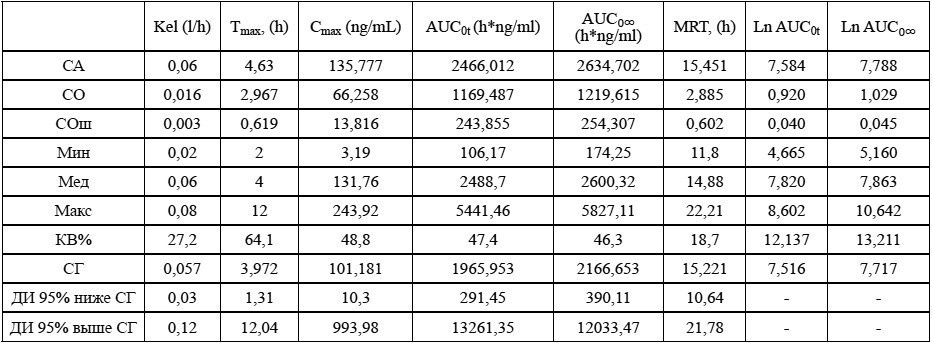
Примечания: ** – Венлафаксин, 75 мг, таблетки, АО «Фармацевтический завод ЭГИС», Венгрия (R); Ln – натуральный логарифм.
Обсуждение
Полученные доверительные интервалы лежат в пределах, установленных методическими указаниями «Оценка биоэквивалентности лекарственных средств» [5] и Руководством по экспертизе лекарственных средств [10], что является доказательством биоэквивалентности исследуемых препаратов Венлафаксин Opганика (венлафаксин, 75 мг, таблетки, АО «Opганика», Россия) (T) и препарата сравнения Велаксин (венлафаксин, 75 мг, таблетки, АО «Фармацевтический завод ЭГИС», Венгрия) (R).
Анализ показателей безопасности после приема исследуемого препарата и препарата сравнения не выявил клинически значимых отклонений в жизненно важных показателях добровольцев, завершивших участие в исследовании согласно протоколу. Одно нежелательное явление, приведшее к исключению добровольца из данного исследования, легкой степени, имеющее причинно следственную связь «вероятная», возникшее через 33 минуты после приема исследуемого препарата, разрешившееся без последствий, может быть объяснено фармакодинамическим эффектом последнего.
Согласно Методическим указаниям «Оценка биоэквивалентности лекарственных средств» [5] общая продолжительность наблюдения за концентрацией препарата при однократном приеме должна быть не менее чем в 4 раза больше его периода полувыведения. Т1/2 венлафаксина составляет 5 часов, таким образом, продолжительность наблюдения за его концентрацией в плазме крови должна составлять не менее 20 часов. Т1/2 активного метаболита О- дезметилвенлафаксина составляет 10–14 часов, соответственно заборы проб крови были увеличены до 48 часов. Продолжительность отмывочного периода также была рассчитана наосновании данных о периоде полувыведения венлафаксина. Согласно Методическим указаниям, отмывочный период должен составлять не менее 6 Т1/2. Для венлафаксина это 30 часов, а для активного метаболита 84 часа. С учетом вышеуказанных параметров всасывания и выведения венлафаксина и его активного метаболита О-дезметилвенлафаксина можно судить о том, что предлагаемый график забора крови обеспечил достаточное количество заборов крови для проведения достоверной оценки максимальной концентрации действующего вещества в крови. Также график заборов крови полностью охватывает профиль «концентрация в плазме – время», что обеспечивает надежную оценку длительности действия препарата (рис. 2 и 3).
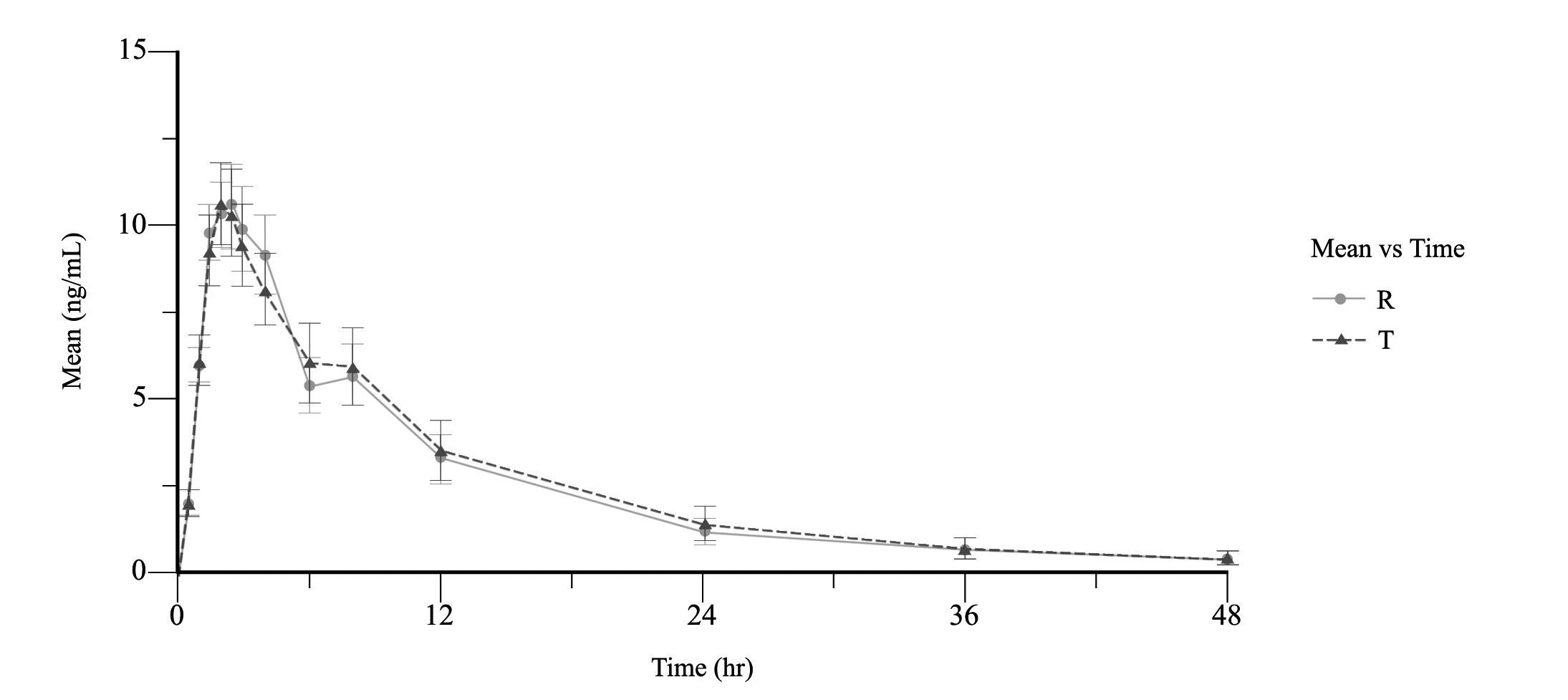
Рисунок 2. Усредненные фармакокинетические кривые венлафаксина*
Примечания: * – после приема препаратов Венлафаксин Opганика (венлафаксин, 75 мг, таблетки, АО «Opганика», Россия) (T) и препарата сравнения Велаксин (венлафаксин, 75 мг, таблетки, АО «Фармацевтический завод ЭГИС», Венгрия) (R), по оси абсцисс представлено время в часах, по оси ординат концентрация в нг/мл.
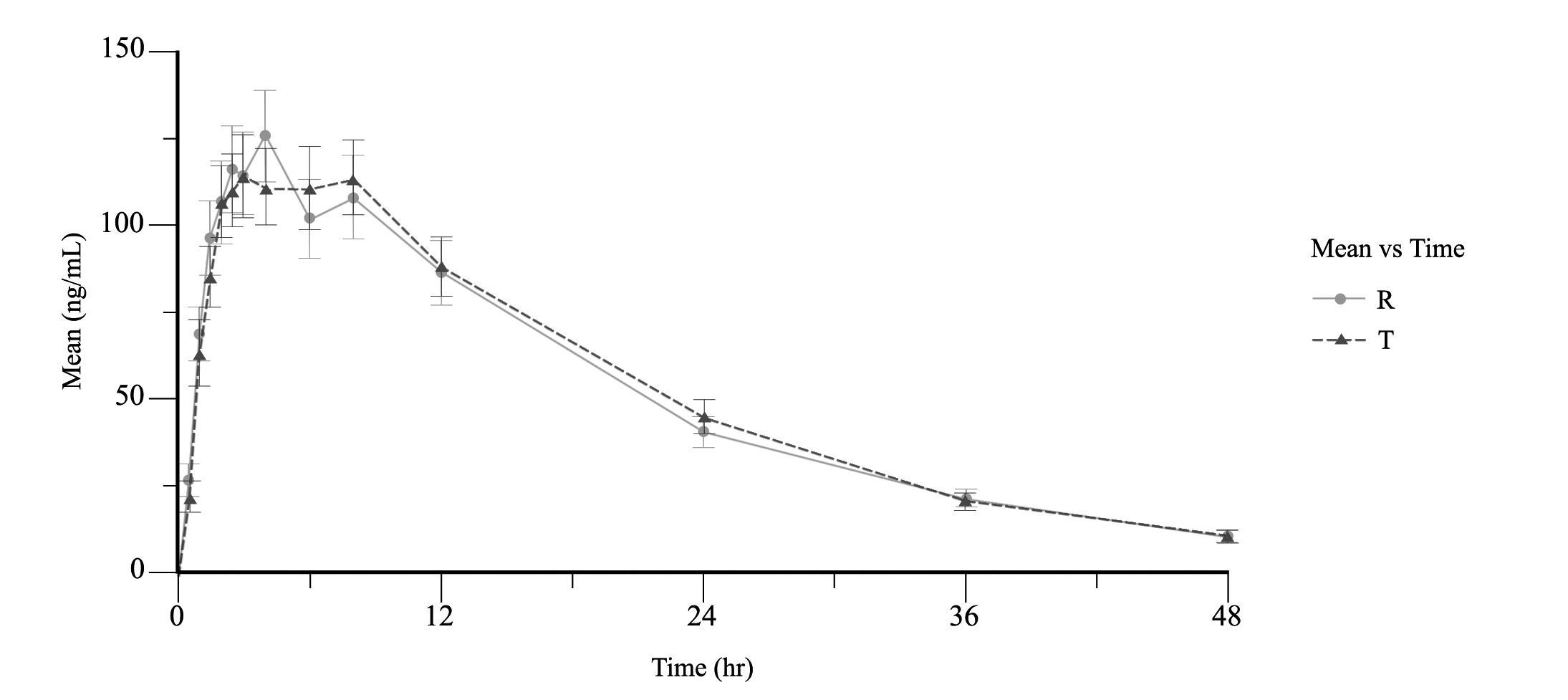
Рисунок 3. Усредненные фармакокинетические кривые О-дезметилвенлафаксина*
Примечания: * – после приема препаратов Венлафаксин Opганика (венлафаксин, 75 мг, таблетки, АО «Opганика», Россия) (T) и препарата сравнения Велаксин (венлафаксин, 75 мг, таблетки, АО «Фармацевтический завод ЭГИС», Венгрия), по оси абсцисс представлено время в часах, по оси ординат концентрация в нг/мл.
Появление дженериков – неминуемый этап существования лекарственного средства. Из экономических соображений замена оригинальных препаратов на дженерики достаточно распространена и нередко даже приветствуется [15, 29]. Такая практика основана на принципе биоэквивалентности, которая рассматривается равнозначной терапевтической эквивалентности. По стандартам ВОЗ отношения средних значений площади под кривой зависимости концентрации от времени (AUC; общая экспозиция препарата) и пиков концентрации в плазме (Cmax) у оригинального и воспроизведенного препаратов должны находиться в диапазоне от 0,8 до 1,25. Фактически действенная доза дженерика, принятая усредненным больным, может быть на 25% выше или на 20% ниже, чем эффективная дозировка оригинального средства. Разница становится весьма существенной, если препарат имеет узкий терапевтический индекс или есть необходимость тщательного подбора дозировки. Более высокая Cmax может привести к усилению или внезапному возникновению нежелательных явлений, тогда как снижение всасывания или минимальная концентрация препарата в плазме (Cmin) могут уменьшать лечебный эффект или провоцировать рецидив. Также следует отметить, что исследования биоэквивалентности базируются на применении однократных доз у здоровой выборки, которая не является в полной мере репрезентативной.
В связи с этим для более полной оценки биоэквивалентности препарата желателен анализ не только данных о фармакокинетической эквивалентности, но и методически грамотно спланированных сравнительных клинических испытаний по изучениютерапевтической эквивалентности [22].
В настоящем исследовании достоверно показана на высоком уровне сопоставимая биодоступность как венлафаксина, так и активного метаболита О-дезметилвенлафаксина при приеме однократной дозы 75 мг Венлафаксина Органика и препарата сравнения. Появление на рынке данного препарата увеличит возможности по эффективной фармакотерапии широкого спектра аффективных, тревожных и других расстройств, а также резистентных состояний в непростых экономических условиях.
Литература
1. Аведисова А.С. Венлафаксин (велаксин): результаты международных исследований антидепрессанта III поколения // Психиатрия и психофармакотерапия им. П.Б. Ганнушкина. 2006.№ 2.С. 33–38.
2. Вельтищев Д.Ю. Эффективность венлафаксина (велаксин) при лечении депрессии: результаты современных исследований // Журн. неврологии и психиатрии им. С.С. Корсакова. Депрессия.2013. Т. 13, № 11. С.79–81.
3. Мазо Г.Э., Иванов М.В. Терапевтически резистентные депрессии:подходы к лечению // Психиатрия и психофармакотерапия им. П.Б. Ганнушкина. 2007. Т 1. С.42–45.
4. Методические рекомендации Определения степени достоверности причинно-следственной связи «НПР лекарство». М, 2008.
5. Методические указания «Оценка биоэквивалентности лекарственных средств», 2008.
6. Национальный стандарт Российской Федерации ГОСТ Р 523792005 «Надлежащая клиническая практика».
7. Постановление Правительства РФ от 13 сентября 2010 г. N 714 «Об утверждении типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата».
8. Постановление Правительства РФ от 18 мая 2011 г. № 393 «О внесении изменений в типовые правила обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата».
9. Приказ Министерства здравоохранения и социального развития РФ от 31 августа 2010 года N 774н «О Совете по этике».
10. Руководство по экспертизе лекарственных средств Министерства здравоохранения РФ, том 1, 2013.
11. Федеральный закон от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств».
12. Ястребов Д.В. Терапевтически резистентные депрессии в клинике пограничной психиатрии // Журн. неврологии и психиатрии им. С.С. Корсакова. 2011. Т. 11. № 4. С. 47–50.
13. Anderson I.M. SSRIS versus tricyclic antidepressants in depressed inpatients: a meta-analysis of effi cacy and tolerability //Depr. Anxiety. 1998. Vol. 7, Suppl 1. P. 11–17.
14. Benkert O., Gründer G., Wetzel H., Hackett D. A randomized, doubleblind comparison of a rapidly escalating dose of venlafaxine and imipramine in inpatients with major depression and melancholia //J. Psychiatr. Res. 1996. Vol. 30, N 6. P. 441–451.
15. Carbon M., Correll C.U. Rational use of generic psychotropic drugs //CNS Drugs. 2013.Vol. 27. N 5. P. 353–365.
16. Charlier C., Pinto E., Ansseau M., Plomteux G. Venlafaxine: the relationship between dose, plasma concentration and clinical response in depressive patients //J. Psychopharmacol. 2002. Vol. 16, N 4. P. 369–372.
17. Clerc G.E., Ruimy P., Verdeau-Pailles J. A double blind comparison of fl uoxetine in patients hospitalised for major depression //Int. Clin. Psychopharmacol. 2000. Vol. 9. P. 139–143.
18. EMEA Guideline on the Bioanalytical Method Validation, 2011.
19. EMEA Guideline on the Investigation of Bioequivalence, London, 2010.
20. Entsuah A.R., Rudolph R.L., Hackett D., Miska S. Efficacy of venlafaxine and placebo during long-term treatment of depression: apooled analysis of relapse rates //Int. Clin. Psychopharmacol. 1996. Vol. 11, N 2. P. 137–145.
21. Entsuah R., Gao B. Global Benefi t-risk Evaluation of Antidepressant Action: Comparison of Pooled Data for Venlafaxine, SSRIs, and Placebo //CNS Spectr. 2002. Vol. 7, N 12. P. 882–888.
22. Guidance for Industry. Bioanalytical Method Validation. US Department of Health and Human Services, US FDA, Center of Drug Evaluation and Research, Center for Veterinary Medicine, US FDA, USA, 2001.
23. Kienke A.S., Rosenbaum J.F. Effi cacy of venlafaxine in the treatment of severe depression // Depr. Anxiety. 2000. Vol. 12, Suppl. 1. P. 50–54.
24. Lecable P., Letzelter J.-M., Lichtblau Е. et al. An open label study of the clinical acceptability of venlafaxine for depression // PrimaryCarePsychiatry. 1995. Vol. 1. P. 119–126.
25. Lecrubier Y., Bourin M., Moon C.A., Schifano F., Blanchard C., Danjou P., Hackett D. Effi cacy of venlafaxine in depressive illness in general practice //ActaPsychiatr. Scand. 1997. Vol. 95. N 6. P. 485–493.
26. Mendels J., Johnston R., Mattes J., Riesenberg R. Efficacy and safety of b.i.d. doses of venlafaxine in a dose-response study // Psychopharmacol. Bull. 1993. Vol. 29, N 2. P. 169–174.
27. Montgomery S.A., Entsuah R., Hackett D., Kunz N.R., Rudolph R.L. Venlafaxine 335 Study Group. Venlafaxine versus placebo in the preventive treatment of recurrent major depression //J.Clin. Psychiatry. 2004. Vol. 65, N 3. P. 328–336.
28. Nierenberg A.A., Feighner J.P., Rudolph R., Cole J.O., Sullivan J. Venlafaxine for treatment-resistant unipolar depression //J.Clin. Psychopharmacol. 1994. Vol. 14, N 6. P. 419–423.
29. Nuss P., Taylor D., De Hert M., Hummer M. The generic alternative in schizophrenia: opportunity or threat? // CNS Drugs. 2004. Vol. 18, N 12. P. 769–775.
30. Preskorn S.H. Pharmacotherapeutic profile of venlafaxine //Eur. Psychiatry. 1997. Vol. 12, Suppl. 4. P. 285s–294s.
31. Rudolph R.L., Fabre L.F., Feighner J.P., Rickels K., Entsuah R., Derivan A.T. A randomized, placebo-controlled, dose-response trial of venlafaxine hydrochloride in the treatment of major depression //J. Clin. Psychiatry. 1998. Vol. 59, N 3. P. 116–122.
32. Schweizer E., Weise C., Clary C., Fox I., Rickels K. Placebo-controlled trial of venlafaxine for the treatment of major depression //J.Clin. Psychopharmacol. 1991. Vol. 11, N 4. P. 233–236.
33. Shrivastava R.K., Cohn C., Crowder J., Davidson J., Dunner D., Feighner J., Kiev A., Patrick R. Long-term safety and clinical acceptability of venlafaxine and imipramine in outpatients with major depression // J.Clin. Psychopharmacol. 1994. Vol. 14, N 5. P. 322–329.
34. Silverstone P., Entsuah R., Hackett D. Two items on the HDPS are effective predictors of remission: comparison of SSRI with SNRI venlafaxine //Int. Clin. Psychopharmacol. 2002. Vol. 17. P. 273–280.
35. Thase M.E., Friedman E.S., Howland R.H. Venlafaxine and treatmentresistant depression //Depr. Anxiety. 2000. Vol. 12, Suppl. 1.P. 55–62.
Информация предоставлена АО «Органика», официальный сайт: www.organica-nk.ru
Статья опубликована в журнале: Социальная и клиническая психиатрия. 2017. №3. С. 86-93.


