д.м.н., проф. Александровский Ю.А.
Государственный научный центр социальной и судебной психиатрии им. В.П. Сербского
В терапии психически больных сконцентрированы все стороны организации психиатрической помощи: лекарственное и материальное обеспечение лечебных учреждений, квалификация и подготовка врачей и медицинского персонала. Современные дифференциально-диагностические, клинико-организационные, собственно терапевтические и реабилитационные подходы к оказанию помощи больным не только дополняют друг друга, но и позволяют “реализоваться” каждому из этих относительно самостоятельных направлений медицинской помощи. Отсутствие того или иного звена или его “блокирование” сказывается на всей системе помощи психически больным и в ряде случаев может привести к ее полной неэффективности.
Терапия любого психически больного включает комплекс медицинских (обследование и постановка диагноза, оказание экстренной помощи, проведение курсовой терапии с использованием различных медикаментозных средств, психотерапии, физиотерапии) и социотерапевтических мероприятий, направленных на его социально-психологическую коррекцию и реабилитацию.
“Точки приложения” терапевтических методов к патогенетическим звеньям, определяющим развитие психопатологических проявлений, свидетельствуют о больших возможностях лечебных, профилактических (первичных, вторичных) и компенсаторно-реабилитационных мероприятий. При этом терапевтическое воздействие может быть направлено на причины, вызвавшие заболевание (этиологическая терапия); патогенетические механизмы, обусловливающие течение заболевания; компенсаторные механизмы.
Все лечебно-реабилитационные мероприятия в психиатрии, так же как и в других областях медицины, должны осуществляться на прочной правовой базе с учетом общепринятых этических норм. В декларации Всемирной Ассоциации психиатров от 1996 г. подчеркивается, что психиатры в своей деятельности всегда должны руководствоваться уважением к больному и заботой о нем, проявляя “индивидуальное чувство ответственности”. В этой декларации утверждены следующие общие принципы поведения психиатров:
1. Психиатрия - медицинская дисциплина, связанная с предоставлением современных условий лечения психических расстройств... Психиатры должны разрабатывать пути терапевтического вмешательства, в наименьшей степени ограничивающие свободу больного. При этом в случае необходимости надо стремиться к получению совета компетентных коллег.
2. Психиатры обязаны идти в ногу с научными достижениями, расширяя свои знания и передавая их другим специалистам.
3. Пациент должен рассматриваться как соучастник терапевтического процесса. Взаимоотношения врач - пациент должны основываться на взаимном доверии и уважении.
4. Полученная в терапевтических взаимоотношениях информация должна оставаться конфиденциальной и использоваться только в целях улучшения психического здоровья больного. Психиатрам запрещается использовать такого рода информацию в личных целях, а также для финансовой выгоды.
Виды терапии психически больных
Основными видами терапии психически больных являются этиотропная, патогенетическая и компенсаторная.
К этиотропной терапии психических расстройств относятся мероприятия, устраняющие различные инфекционные, соматические, неврологические заболевания, последствия травм головного мозга, сопровождающиеся как психотическими, так и непсихотическими психопатологическими проявлениями. Применяя противомикробные, противопаразитарные, противовирусные, сердечно-сосудистые препараты, ноотропы, гормоны, нейрохирургические методы, можно устранить причину и прямые последствия основного заболевания или травмы и вслед за этим добиться редукции сопровождающих их психических расстройств. В истории психиатрии наиболее ярко это проявилось при лечении прогрессивного паралича. Основополагающим в этом случае стало выявление связи перенесенного сифилиса и прогрессивного паралича, протекающего со специфической картиной нервных и психических расстройств. Малярийная терапия прогрессивного паралича, предложенная в 1917 г. J. Wagner Jauregg, современные средства профилактики сифилиса, его раннее лечение сократили контингент больных с частотными и роковыми в недавнем прошлом диагнозами сифилитическая неврастения, сифилитический менингит, галлюцинаторная, параноидная и другими формами сифилиса.
К этиотропной терапии могут быть отнесены и некоторые методы психотерапии и социально-психологической коррекции состояния больных с психогенными расстройствами. Устранение психотравмирующей ситуации, вызвавшей невротические реакции, изменение отношения к ней больного способствует обратному развитию психопатологических проявлений. Назначение психотропных лекарственных средств в этом случае может быть вспомогательным лечебным мероприятием.
Патогенетическая терапия носит, как правило, неспецифический характер: достаточно эффективные лекарственные средства и терапевтические мероприятия используются при различных заболеваниях и психопатологических состояниях. Назначение психофармакологических препаратов и других лечебных средств, в первую очередь, способствует редукции синдромов и симптомов, на которые они оказывают клинически выявляемое преимущественное терапевтическое воздействие. Вслед за этим нормализуется вся клиническая картина с обратным развитием остальной симптоматики. Это, на первый взгляд, согласуется с известным положением о симптомах-мишенях, согласно которому адекватная оценка эффективности лекарственных средств в психиатрии связана с видоизменением под их действием отдельных симптомов. Однако симптомы-мишени являются лишь первым “ориентиром для подбора ключа” (необходимого лекарства) к “замку” (психическому расстройству). Эффективность лечения зависит от особенностей симптома и его места в динамике картины болезни в целом. Такое понимание “симптомов-мишеней” является, вероятно, наиболее правильным для определения симптомотропного и нозотропного действия “психоактивных” лечебных средств и методов. Их действие вряд ли всякий раз следует пытаться уложить в рамки “симптоматического” или “синдромологического”, наиболее точно оно оценивается как избирательно-патогенетическое. При этом имеется в виду, что избирательное влияние на симптом приводит к терапевтическому воздействию на одно из звеньев патологического процесса.
Лекарственные средства, используемые в психиатрии, не являются нозотропными. Однако максимальный терапевтический эффект при их назначении достигается в том случае, когда “психотропность” препарата находит наиболее благоприятную “почву” в характере психопатологической структуры состояния. О терапевтическом воздействии на разные патогенетические звенья при психических заболеваниях можно судить лишь косвенно. Психофармакологические (психотропные) препараты, а также средства, оказывающие общебиологическое воздействие, непосредственно не влияют на психологические и психопатологические феномены. Их клиническое действие реализуется опосредовано через так называемые первичные свойства организма.
Компенсаторная терапия включает различные биологические и социотерапевтические воздействия, которые способствуют не ликвидации причины заболевания (этиологическая терапия) или непосредственному “исправлению” патогенетических механизмов (патогенетическая терапия), а стимуляции компенсаторных процессов, благодаря чему ослабляются и нивелируются многие болезненные проявления. Компенсаторное влияние при психических болезнях оказывают многие лекарственные средства (сердечно-сосудистые, дегидратационные, снотворные, актопротекторы и другие препараты с неспецифическим стимулирующим или седативным эффектом) и терапевтические методы: рациональная и другие методы психотерапии, социальная реабилитация.
Выбор терапевтических средств для каждого из трех направлений - этиологического, патогенетического и компенсаторного - зависит от индивидуального плана лечения больного.
Методы терапии психически больных
К числу методов и средств, используемых в психиатрической практике, относятся терапия психофармакологическими (психотропными) препаратами (занимает ведущее место в лечении основных психических заболеваний), психотерапия, разгрузочно-диетическая терапия, рефлексотерапия и др. Наряду с этим для лечения как психосоматических расстройств, так и основных психических заболеваний используется весь арсенал медикаментозных средств, физиотерапия, курортное лечение и др. Особое место в психиатрической практике занимает система реабилитации больных и инвалидов. Каждый из указанных методов и средств имеет свои показания и противопоказания. Они основываются как на эмпирическом опыте клинической психиатрии, так и на научных исследованиях.
Различные методы и средства создают широкие возможности для разработки индивидуального терапевтического плана. При этом следует учитывать динамику заболевания в целом и ведущего психопатологического симптомокомплекса, в том числе соматическое состояние; эффективность предшествовавшей терапии; побочные явления и осложнения, наблюдавшиеся ранее; сопутствующие заболевания и т.д.
Нет и не может быть шаблонного средства и единой методики лечения больного. Это объясняет необходимость дифференцированного назначения препаратов и проведения лечебных мероприятий с обязательным учетом динамики заболевания при адекватном использовании средств и методов этиологической, патогенетической и компенсаторной терапии. При этом обязательным является привлечение (во всяком случае, не подавление) возможностей так называемого саногенеза (естественных биологических и психологических механизмов преодоления болезненных проявлений).
Принцип индивидуально-дифференцированной терапии больных в известной мере находится в противоречии с распространенными в некоторых странах и частично внедряемыми в последнее время в России “терапевтическими стандартами”. Стандартный набор симптомов влечет за собой стандартный выбор средств и методов терапии. Такой упрощенный подход порождает “фельдшеризм”, лишает врача не только творческой инициативы, но и снимает ответственность за проводимое лечение. Ответственность “перекладывается” на страховые компании и органы здравоохранения, утвердившие стандарты лечения. Наверное, можно согласиться с тем, что в ряде областей медицины “стандарты” необходимы. Особенно в работе недостаточно квалифицированных специалистов, которым трудно “увидеть” и “обосновать” наиболее рациональное терапевтическое решение. Однако в психиатрии, как свидетельствует лечебная практика, всегда необходимо обоснование и проведение индивидуального терапевтического плана. Он может включать отдельные “стандартные приемы” (регламентированный уровень доз препаратов, общепринятые, апробированные методы психотерапии и т.д.), но всегда должен адаптироваться к конкретному пациенту.
Современные лекарственные средства включают большое число препаратов, которые объединяются на основании специфического воздействия на психопатологические проявления. Их появление в середине XX века значительно расширило терапевтические возможности психиатрической практики, изменило представления о фатальной неизлечимости психических болезней, способствовало сближению специализированной психиатрической помощи с общемедицинской практикой. Наряду с этим психотропные препараты оказались “естественным терапевтическим инструментом”, позволяющим проводить экспериментально-теоретические исследования и анализировать различные корреляции между фармакокинетическими показателями, сопоставляя их с психотропным действием у больных. В последние десятилетия появились новые подходы к пониманию механизмов психической деятельности и целенаправленному созданию новых высокоэффективных психотропных препаратов. Их развитие привело к формированию на стыке клинической психиатрии и фармакологии особого раздела знаний - клинической психофармакологии.
У психофармакологических препаратов, наряду с их соматоформным и нейротропным действием, принято выделять несколько клинико-фармакологических особенностей. К ним относятся следующие.
Во-первых, наличие собственно психотропного эффекта, заключающегося в характерном для каждого препарата (группы препаратов) влиянии на аффективное состояние человека с различными психическими расстройствами. Психотропное действие выражается в затормаживающем (психолептическом) или активирующем (стимулирующем, психоаналептическом) влиянии на психическую активность.
Во-вторых, наличие спектра психотропной активности (индивидуален у каждого препарата или группы препаратов), отражающего “тропизм” его действия к психопатологическим проявлениям.
В-третьих, наличие избирательной антипсихотической (антиневротической) активности, выражающейся как в общем (глобальном влиянии на разные проявления психоза), так и в избирательном (элективном, “прицельном”) воздействии на симптомы-мишени, главным образом, на два основных уровня психопатологических проявлений - психотический и невротический.
С учетом системного понимания этиологии и патогенеза большинства психических расстройств и отсутствия точных знаний о биологических механизмах их развития, психофармакотерапия может рассматриваться как важное, но не единственно возможное терапевтическое действие. Поэтому любые находки причинно-следственных связей “лекарственный препарат” - “терапевтическое действие” в современной психофармакологии требуют специального анализа и пояснения. Они должны учитывать, по крайней мере, следующее.
Между любым лекарственным препаратом, вызывающим изменения в психической деятельности, и реализацией этого действия в виде терапевтического эффекта у больного стоит большое число метаболических преобразований самого лекарственного вещества и вызванных им изменений нейрохимической базы, которые обеспечивают работу нервной системы. Лекарственное средство, в принципе, не может непосредственно действовать на психологические или психопатологические феномены - тревогу, страх, бред, депрессию и т.д. Широко используемые в практике определения препаратов, как “анксиолитики”, “антидепрессанты”, “снотворные”, при строгом подходе к формулировкам могут быть оценены как жаргонные, хотя и отражают сущность конечного терапевтического эффекта.
Любое психическое расстройство имеет как неспецифические общебиологические механизмы, так и специфические нарушения, зависящие от индивидуальных особенностей организма (генотип, физиологическое состояние, соматическое здоровье) и личностных психологических характеристик. В связи с этим влияние препарата с психотропным действием может реализоваться через вмешательство в различные патогенетические звенья, приводящие к развитию психического расстройства. Таких “точек приложения” действия психотропных препаратов достаточно много.
Реализация терапевтического действия при психических нарушениях не имеет прямой зависимости от нормализации той или иной биологической системы. Эта нормализация, прежде всего при пограничных психических расстройствах, не устраняет психогенной (социогенной, соматогенной) причины, а лишь способствует созданию условий для адаптации больного к функциональным изменениям на уровне организма (привлечение резервных возможностей функционирования) или психологического состояния (решение конфликтной ситуации, нахождение путей приспособления к ней и др.).
Высокий процент доказанного плацебо-эффекта при назначении психотропных препаратов, особенно повышающийся “в руках” хорошего психиатра-психотерапевта, может вносить серьезную коррекцию в оценку действия того или иного психофармакологического препарата.
Указанные факторы не исчерпывают весь перечень возможных направлений критического анализа, необходимого для понимания принципа действия психофармакологических препаратов. Однако именно они позволяют сформулировать положение о невозможности вычленить отдельный фармакологический эффект, полученный в ходе экспериментов на животных и в клинико-фармакологических исследованиях, для прямой экстраполяции на больных. Из этого следует два основополагающих подхода к созданию новых психотропных препаратов, предназначаемых для лечения больных с психическими заболеваниями.
Во-первых, необходимо системное терапевтическое воздействие на больного как через неспецифические механизмы, лежащие в основе формирования собственно психических расстройств и психосоматических нарушений, так и через специфические этио-, патогенетические механизмы, определяющие развитие патологического процесса (в большинстве случаев лишь гипотетически предполагаемые).
Во-вторых, оценка наблюдаемого клинико-фармакологического эффекта как части лечебного процесса. В равной мере это относится к оценке действия различных психотерапевтических методов и социотерапевтических мероприятий, хотя они, в отличие от действия лекарственных препаратов, носят более индивидуальный характер.
С учетом представленных подходов методика многих исследований новых психофармакологических препаратов, включая и крайне дорогостоящие модельные изучения депрессии, тревожных и других расстройств, а также мультицентровые исследования, вероятно, нуждаются в определенной коррекции. Без системного учета их общего терапевтического эффекта, комплекса клинико-фармакологических свойств и сравнительного анализа антипсихотического, анксиолитического, антидепрессивного, снотворного, а также соматотропного и нейротропного влияния делать заключения об эффективности того или иного препарата и его месте среди других психотропных средств, крайне сложно.
Основные группы психотропных средств
В соответствии с Федеральным руководством по использованию лекарственных средств (выпуск IV, 2003 год) все психотропные (психофармакологические) препараты подразделяют на следующие клинико-фармакологические группы:
1. Нейролептики (антипсихотические препараты).
2. Анксиолитики (транквилизаторы) и снотворные средства (гипнотики).
3. Антидепрессанты (тимоаналептические препараты).
4. Психостимуляторы (психотоники).
5. Нормотимические средства.
6. Нейрометаболические стимуляторы.
По основному, собственно психотропному, действию различают психолептические и психоаналептические средства.
Психолептические средства оказывают успокаивающее, затормаживающее, депримирующее действие и включают следующие фармакологические группы:
– нейролептики (антипсихотические препараты) редуцируют психотическую симптоматику и психомоторное возбуждение;
– анксиолитики (транквилизаторы) и снотворные средства (гипнотики) оказывают успокаивающее, противотревожное, снотворное и антифобическое действие в основном при невротических расстройствах.
Психоаналептические средства оказывают стимулирующее, активирующее, психоэнергизирующее действие. Они включают:
– антидепрессанты (тимоаналептические препараты) нормализуют патологически пониженное настроение;
– психостимуляторы (психотоники) вызывают психомоторную активацию.
Особое место занимают нормотимические средства (нормотимики, модуляторы настроения), обладающие антиманиакальным действием и способные при длительном применении предотвращать развитие очередного обострения при аффективном и шизоаффективном психозах.
В самостоятельную группу выделяют нейрометаболические стимуляторы (ноотропы, а также корректоры мозгового кровообращения, адаптогены, ангиопротекторы и корректоры микроциркуляции, антигипоксанты и антиоксиданты), способные активизировать метаболизм и энергетические процессы в клетках головного мозга и/или оказывать церебропротективное действие. Эту группу иногда относят к психоаналептикам, однако, учитывая широту терапевтического действия и многообразие показаний к применению, их целесообразнее рассматривать отдельно. Препараты, проявляющие свойства нейрометаболических стимуляторов у пациентов, находящихся в экстремальных условиях (физическая перегрузка и т.д.), иногда называют актопротекторами.
В основе этого, в определенной мере условного, деления препаратов лежит своеобразие их основного клинико-фармакологического действия. В отдельных случаях у препаратов выявляется “комбинированный” спектр психотропной активности. Кроме того, внутри указанных основных групп психотропных препаратов, в зависимости от химической структуры (химической группы) или установленных механизмов действия, выделяются отдельные подгруппы.
Чрезвычайно важно при лечении психически больных создать и соблюдать на всех этапах терапии необходимую психотерапевтическую обстановку. Важна и социальная поддержка больного. По образному выражению одного из психиатров, “как хирургу невозможно оперировать без стерильного материала, так и психиатру невозможно лечить психически больных в неблагоустроенной лечебнице”. Продолжая эту мысль, следует подчеркнуть, что, если хирург, произведя операцию, не будет бороться с инфекцией, попавшей в рану, он никогда не добьется успеха. Точно так же и психиатр не вылечит больного, находящегося в “септической” психотравмирующей, а не в лечебной среде. Какое бы средство не назначалось больному, какой бы метод терапии не применялся, для того чтобы они могли наиболее эффективно действовать, необходимо в высшей степени доброжелательное “психотерапевтическое” отношение к больному.
Рассматривая принципиальные вопросы терапии психически больных, следует иметь в виду, что болезнь – это всегда “борьба” факторов, обусловливающих ее возникновение, и организма человека, стремящегося к сохранению своей не только органной, но и функциональной структуры. Поэтому, планируя активное терапевтическое вмешательство не только при эндогенно и соматогенно обусловленных, но и при психогенных заболеваниях, нельзя пренебрегать возможностью саногенеза и психогенеза с использованием внутренних терапевтических возможностей каждого больного. В первую очередь это относится к начальным и структурно не оформившимся проявлениям невротических (неврозоподобных) расстройств. В этом отношении современна идея Гиппократа о том, что природа “никем не наученная делает то, что нужно”. Иначе говоря, заболевший человек и его организм активно борются до определенного предела с негативными процессами, вызывающими те или иные психические расстройства. В этих случаях задача лечения состоит в создании благоприятных условий для этой борьбы. Требуется определенная осторожность в приписывании абсолютного значения тому или иному терапевтическому средству.
В терапевтической практике современной психиатрии достаточно часто возникают пока еще трудно разрешимые вопросы индивидуальной чувствительности к лекарственным средствам. Почему тот или иной препарат оказывает терапевтическое действие на одного больного и является неактивным при аналогичных расстройствах у другого? Какие механизмы предопределяют терапевтическую резистентность? Ответы на эти вопросы требуют глубоких исследований патогенеза психических заболеваний, а также фармакодинамики и фармакокинетики лекарственных средств.
Можно выделить следующие основные группы факторов, влияющих на индивидуальную эффективность терапии при психических болезнях:
1) особенности психопатологии и течения психической болезни (клинико-психопатологические, этиологические, патогенетические);
2) конституционно-личностная типология больного;
3) физиологические особенности организма и функционального состояния;
4) фармакокинетические факторы (абсорбция, распределение лекарственного препарата в организме, его связывание с белковыми фракциями биологических жидкостей, биотрансформация, выведение);
5) фармакодинамические факторы, в том числе основные механизмы действия лекарственного средства (влияние на рецепторы, медиаторы, взаимодействие с другими лекарствами и др.) и особенности психотропного терапевтического эффекта.
Столь большой круг значимых для наступления терапевтического эффекта факторов позволяет считать индивидуальную чувствительность к различным средствам и методам лечения психических болезней многоуровневым понятием. Наиболее общими, “сквозными” терапевтическими индикаторами являются характер и уровень выраженности психопатологических проявлений и общесоматических симптомов.
Широкий круг причин, определяющих возникновение и течение психических болезней, и индивидуальную чувствительность к действию лечебных факторов, объясняет эффективность комбинированного лечения лекарственными препаратами и различными терапевтическими средствами. В современной психиатрической практике обычно назначают несколько психофармакологических препаратов и других лечебных средств. По данным специальных исследований, в стационарах ФРГ для лечения большинства больных применяют сочетание двух, трех, четырех и более психофармакологических препаратов. В США и в ряде европейских стран все шире используют комбинации психотропных средств, включающие различные транквилизаторы, антидепрессанты и нейролептики. При этом их назначают одновременно с другими непсихотропными средствами, психотерапией, физическими методами лечения.
Интересны результаты исследования по выявлению наиболее часто применяемых в клинической практике комбинаций психотропных средств, которые назначаются больным с пограничными формами психических расстройств. Были проанализированы данные о лекарственной терапии в одной из московских психиатрических больниц, специализированной базы Федерального научно-методического центра пограничной психиатрии. Оказалось, что из 2993 больных с диагнозами реактивный психоз, невроз, психопатия (состояние декомпенсации), поступивших в больницу в течение 2 лет, 2620 человек (87,8%) получали комбинированную терапию. При этом наиболее часто (1418 человек, или 54,1%) назначалась комбинация анксиолитика (транквилизатора) и антидепрессанта. Комбинация анксиолитика и нейролептика назначалась 826 больным (31,1%), анксиолитика и психостимулятора – 114 больным (13,5%).
При изучении комбинаций психотропных препаратов, назначаемых в амбулаторных условиях, были проанализированы данные о терапии больных с теми же диагнозами, что и в стационаре, обратившихся в один из психоневрологических диспансеров Москвы. Оказалось, что более 80% больных также назначалось комбинированное лечение.
Из приведенных данных следует, что при лечении психических расстройств, как в амбулаторных, так и в стационарных условиях, комбинированная терапия используется примерно в 3–4 раза чаще, чем терапия отдельными препаратами. Не будет преувеличением сказать, что в настоящее время в лечебной практике преобладает полифармакотерапия, а не монотерапия одним лечебным средством или методом.
Как известно, фармакологический эффект различных медикаментозных средств, в том числе и психотропных препаратов, может существенно изменяться при совместном применении двух или более лекарственных средств. К сожалению, как показывает опыт, это далеко не всегда учитывается врачами-психиатрами, а также многими исследователями в области клинической психофармакологии. Даже при комбинации двух препаратов функциональные отношения между ними оказываются многоплановыми. Конечный результат совместного действия двух веществ проявляется синергизмом, антагонизмом или отсутствием взаимного влияния. Между психотропными и другими препаратами всегда есть взаимодействие синергического или антагонистического характера.
Клиническая и фармакологическая литература не позволяет обнаружить достаточные научные обоснования для составления комбинаций и использования в них отдельных препаратов. Как правило, основанием для назначения комбинированной терапии является оценка индивидуальной динамики психических расстройств сложного психопатологического синдрома. При этом зачастую имеются противоречивые клинические данные об эффективности комбинированной терапии, трудно объяснимые с точки зрения фармакодинамических исследований и экспериментальных данных.
В клинической фармакологии принято различать два, не исключающих друг друга, типа взаимодействия лекарств – фармакокинетический и фармакодинамический. Фармакокинетическое взаимодействие приводит к изменению абсорбции, распределения, связывания с белком, транспортировки к месту действия, биотрансформации и экскреции. В результате входящие в комплекс препараты взаимно изменяют активность и метаболизм каждого из них. Фармакодинамическое взаимодействие основывается на их влиянии на медиаторные системы, результатом чего является антагонистический или синергический эффект двух препаратов.
Без знания фармакокинетики и фармакодинамики комбинаций препаратов трудно обосновать наиболее рациональное лечебное назначение. Конечным результатом фармакокинетических и фармакодинамических взаимодействий разных препаратов является специфический терапевтический эффект, видоизменяющий болезненное состояние. Применительно к психическим заболеваниям этот эффект, как уже отмечалось, носит патогенетический характер. При этом действие комплекса двух или несколько психотропных препаратов, в принципе, может адресоваться к разным звеньям сложных функционально-органических нарушений при психозах и не только усиливать или ослаблять действие друг друга, но и проявлять более широкий спектр клинико-фармакологически психотропной активности.
Особое место в планировании и реализации лечебных мероприятий занимает взаимодействие биологических (в первую очередь психотропных) средств и психотерапии. Если рациональная психотерапия, так же как и организация психотерапевтического режима в условиях психиатрического стационара или поликлиники (диспансера), необходима для всех больных психическими заболеваниями, получающих биологическую терапию, то использование специальных методов психотерапии в этих случаях требует особого анализа. При этом должны учитываться возможные варианты взаимодействия комбинаций лекарственных препаратов и методов психотерапии. Снотворное действие нейролептических препаратов или анксиолитиков может способствовать повышению “чувствительности” к психотерапевтическому воздействию, в частности к внушению во время гипнотического сна. Напротив, назначение психостимуляторов будет препятствовать достижению глубоких стадий гипноза. Использование специальных методов психотерапии у больных с выраженным психомоторным возбуждением или заторможенностью, как правило, не только неэффективно, но и порой просто “технически” неосуществимо. Быстрое купирование “остроты” состояния с помощью психотропных средств “освобождает путь” для восприятия больным психотерапии и позволяет в полной мере использовать все возможности лечебного комплекса. При выборе средств и методов биологической терапии и психотерапии требуется индивидуальный анализ их возможного влияния друг на друга. Действуя на разные системы (психотерапия на систему социально-психологических связей больного, а психофармакотерапия нормализует патологическую активность ЦНС), возможное лечебное вмешательство достигает результат на уровне единой и неделимой функционально-динамической базы, определяющей возможности коррекции патологических нарушений и психической дезадаптации.
Результаты анализа действия анксиолитических средств, а в последующем и других групп психотропных препаратов, позволили представить индивидуальный барьер психической адаптации в виде схемы (рис.1).
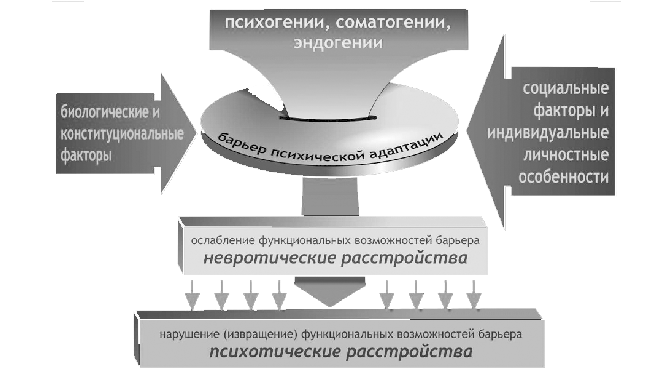
Рис. 1. Функциональный барьер психической адаптации (схема)
В этом барьере интегрируются биологические и социально-психологические механизмы, обеспечивающие психическую деятельность человека. Под влиянием различных факторов (эндогенных, психогенных, социогенных) происходит напряжение, а потом и ослабление функциональных возможностей барьера психической адаптации и приближение его к критической величине, определяющей исчерпанность функциональной стабильности защитных (барьерных) возможностей. На клиническом уровне это ведет к возникновению доболезненных непсихотических проявлений и нарушений невротического характера – тревоги, астении, расстройств системы “сон – бодрствование”, вегетативных дисфункций и др. В этих случаях цель терапии – укрепить ослабленные функциональные возможности барьера психической адаптации и недопустить его “прорыва”, который может привести к формированию и стабилизации психопатологических нарушений, развитию невротических, соматоформных, психосоматических расстройств, а в последующем – и патохарактерологических изменений.
Нарушение стабильности барьера психической адаптации может привести к формированию “извращенных” (а не “ослабленных”) проявлений психической деятельности, характерных для основных прогредиентно развивающихся психических заболеваний.
В этом случае цель терапии – восстановление нарушенных функциональных возможностей барьера психической адаптации. Различные лекарственные препараты, так же как психотерапия и другие лечебные средства и методы, могут иметь свои “точки приложения” в нарушенной системе психической адаптации. Поэтому рациональный план лечения каждого больного (и обоснованный терапевтический прогноз) может строиться с учетом знания звена (звеньев) в единой и неделимой системе психической адаптации, через которое будет осуществляться терапевтическое влияние. Во-первых, необходимо провести диагностику психического расстройства с позиции выбора лекарственного препарата, основываясь на его фармакокинетических и фармакодинамических свойствах. И, во-вторых, подобрать необходимые средства и методы, действие которых потенциально приложимо к нарушенному звену в системе психической адаптации. Это воздействие может быть прямым, направленным на конкретные патогенетические механизмы, участвующие в образовании патологического процесса, или косвенным, компенсирующим нарушенную вследствие болезни функцию.
Анализ динамики последствий нарушения барьера психической адаптации, проведенный в ГНЦ социальной и судебной психиатрии им. В.П.Сербского, позволил представить ее на рис. 2 и 3 в виде схем и рассмотреть принципиальные возможности используемых в этих случаях терапевтических воздействий (рис. 4).
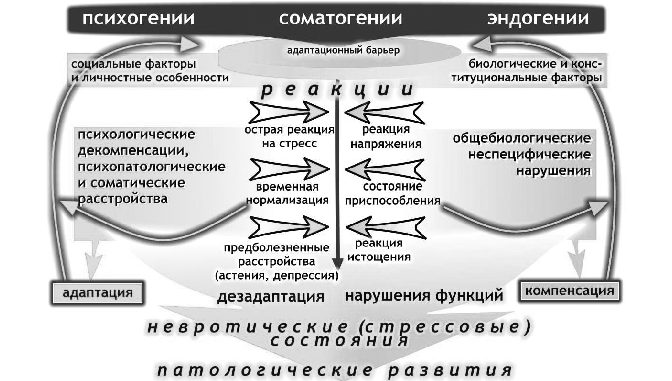
Рис. 2. Динамика основных форм пограничных психических расстройств,обусловленных стрессовыми воздействиями
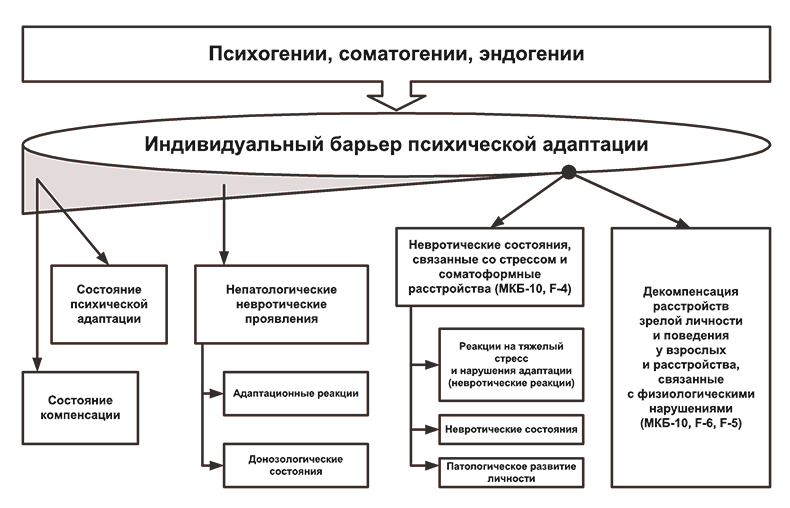
Рис. 3. Основные формы пограничных психических расстройств и варианты их динамики
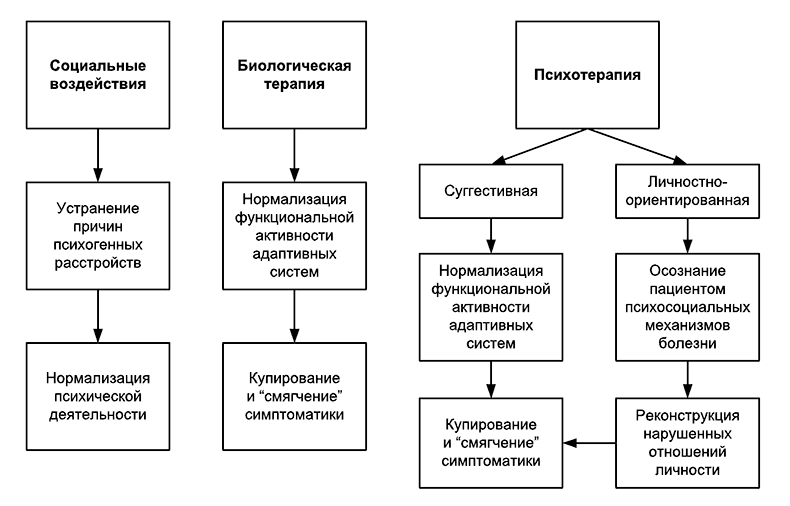
Рис. 4. Соотношение биологических, психологических и социальных воздействийпри невротических расстройствах
При этом при основных формах пограничных психических расстройств обнаружены следующие общебиологические неспецифические изменения.
При острой реакции на стресс (реакции напряжения):
– увеличение коркового слоя надпочечников с уменьшением в них липоидов и холестерина;
– инволюция тимико-лимфатического аппарата (лимфопения, эозинопения, полиморфно-ядерный лейкоцитоз);
– повышение уровня свободных и конъюгированных форм катехоламинов, концентрации адреналина, кортизола и их метаболитов в крови, высокая суточная экскреция этих веществ с мочой;
– увеличение содержания в организме всех молекул катаболического пула свободных и конъюгированных форм катехоламинов, скорость их накопления превышает прирост уровня несвязанных молекул;
– поступающие в циркуляцию катехоламины достаточно быстро переводятся в неактивную популяцию связанных форм;
– усиление интенсивности процессов перекисного окисления липидов в биологических мембранах организма;
– иммуносупрессия, вызываемая кортикостероидами, являющаяся защитной реакцией организма против гиперреактивных и аутоиммунных процессов. При этом наблюдается активизация функций тимических медиаторных систем, увеличение интенсивности биосинтеза цитокинов (интерлейкин, интерфероны) клетками иммунной системы, а также астроцитами и клетками микроглии, активизация биосинтеза иммуноглобулинов классов A и M плазматическими клетками, сопровождающаяся увеличением концентрации циркулирующих иммунных комплексов в кровотоке. В условиях невротической реакции (стресса) T-лимфоциты и макрофаги способны синтезировать кортикотропин-рилизинг фактор, АКТГ (адренокортикотропный гормон), бета-эндорфин, Met-энкефалин и другие нейропептиды, замыкающие “кольцо обратных связей” между нервной, эндокринной и иммунной системами. Изменения указанных биологических показателей отражают стадии развития стрессовой реакции, описанные Г. Селье – реакции напряжения, состояния приспособления и реакции истощения. В наибольшей мере при острой реакции на стресс они коррелируют с выраженностью тревоги. По мере ее редукции наблюдается нормализация большинства общебиологических неспецифических нарушений.
При невротических состояниях:
– повышение уровня циркулирующего кортизола при отсутствии торможения при его выработке (под влиянием агониста дексаметазона);
– увеличение неконтролируемого содержания глюкокортикоидов, что негативно влияет на состояние медиаторных систем головного мозга и вызывает дисфункции иммунной системы и противовоспалительные реакции;
– появление дефицита свободных форм катехоламинов и их метаболитов в крови и моче;
– уменьшение содержания в плазме крови как начальных, так и конечных продуктов перекисного окисления липидов (ПОЛ). Наиболее высокое значение показателей содержания продуктов ПОЛ характерны для больных с неврозом навязчивых состояний. Для неврастении и, в особенности, для истерического невроза типично их более низкое содержание. При оценке интенсивности процессов ПОЛ у больных в зависимости от ведущего психопатологического расстройства, обнаружена их наиболее значительная интенсивность у больных с фобическими и тревожно-депрессивными расстройствами. Более низкие показатели отмечены у больных с астеническими и ипохондрическими расстройствами;
– нарушение иммунного гомеостаза на разных уровнях биосистемы – клеточном (преобладание процессов катаболического расщепления рецепторных белков над анаболизмом), системном (изменения иммунного статуса по типу дефицита и дисбаланса), на уровне организма (формирование клинических признаков вторичной иммунной недостаточности). Отмечаются особенности иммунобиологического реагирования при различных проявлениях невротических расстройств. У больных неврастений на фоне астенической симптоматики выявлено снижение количества субпопуляций T-лимфоцитов с различными поверхностными рецепторами. У больных с диссоциативными и тревожно-фобическими расстройствами, несмотря на выраженную клиническую симптоматику, иммунологические нарушения менее значимы. Наибольшие изменения иммунитета и нейрогормонального обмена характерны для больных с нарушениями адаптации и посттравматическим стрессовым расстройством, которые проявляются в супрессии основных T-клеточных субпопуляций, активации оксидантных систем нейтрофилов, повышении сывороточных концентраций иммуноглобинов М и А, уровня циркулирующих иммунных комплексов. Для больных с невротическими реакциями характерен достаточно высокий уровень биологических механизмов адаптации, находящий отражение в значительных изменениях иммунного реагирования на психотравмирующее воздействие. Снижение содержания определенных клеточных популяций (T-лимфоцитов и T-хелперов) обусловливается не истинным иммунодефицитом, а носит транзиторный характер и связан с выбросом в циркуляцию из депо малодифференцированных форм лимфоцитов, не имеющих соответствующего рецепторного аппарата. Можно предположить, что этот процесс обусловлен адекватной реакцией организма на стресс.
При патологическом развитии:
– хроническая недостаточность функциональной активности катехоламинергической нейромедиации, выражающаяся в усилении процессов окислительного дезаминизирования катехоламинов, оцениваемых по активности МАО в тромбоцитах, содержанию диоксифенилуксусной кислоты и по соотношению дофамина и диоксифенилуксусной кислоты в моче и крови;
– увеличение интенсивности процессов сульфоконъюгирования катехоламинов, оцениваемых по соотношению свободные/конъюгированные формы катехоламинов в моче и плазме крови;
– снижение активности дофамин-B-гидроксилазы в плазме крови;
– увеличение скорости моноаминоксидазного и сульфоконъюгирующего путей катаболизма катехоламинов;
– адаптация тканей и органов к высоким концентрациям гормонов стресса (гипорегуляция рецепторов, ослабление систем внутриклеточных переносчиков сигнала);
– угнетение ключевой реакции биоэнергетики – окислительного фосфорилирования в коре головного мозга и лимбической системе;
– нарушение иммунного гомеостаза при цереброгенной астении, характеризуемое формированием дисбаланса цитокинов с преимущественным усилением продукции растворимого рецептора к интерлейкину IL–2R при его нормальном содержании, высоким уровнем фактора некроза опухоли TNF-a в крови, а также существенным усилением процессов программированной клеточной смерти иммуноцитов;
– для психогенной астении типичным является высокий уровень интерлейкина–2 в сыворотке крови при сохранении нормальной пропорции этого цитокина с количеством растворимого рецептора к нему, максимальный подъем числа CD25 и CD16 клеток, существенный подъем соотношения CD4/CD8 лимфоцитов и численности иммуноцитов с высоким уровнем готовности к апоптозу (CD95).
Выявление общебиологических изменений, наблюдаемых на разных этапах развития невротических расстройств, является важным для разработки лекарственных препаратов с целенаправленным действием. Как правило, под влиянием наиболее эффективных анксиолитиков, антидепрессантов и других психотропных препаратов, а также в процессе психотерапии, наряду с улучшением клинического состояния, наблюдается нормализация большинства указанных показателей.
Краткая характеристика основных психофармакологических препаратов
Нейролептики (антипсихотические препараты)
Нейролептики обладают широким спектром клинико-фармакологического действия. Их основными особенностями являются ослабление реакций на внешние стимулы, уменьшение выраженности психомоторного возбуждения, аффективной напряженности и агрессивности. Наиболее заметно эти особенности проявляются у больных с продуктивными психопатологическими расстройствами (бред, галлюцинации, автоматизмы и др.), что и обусловливает терапевтическое действие при шизофрении и других психозах. Нейролептики усиливают (потенцируют) влияние снотворных препаратов, наркотиков, анальгетиков, местных анестетиков и ослабляют эффекты психостимулирующих средств. Для большинства нейролептиков (производных фенотиазина, бутирофенона и др.) характерны побочные эффекты в виде так называемого нейролептического синдрома, который проявляется различной паркинсоноподобной симптоматикой.
Нейролептики изменяют нейрохимические (медиаторные) процессы в мозге: дофаминергические, адренергические, серотонинергические, ГАМКергические, холинергические, нейропептидные и др. Разные группы нейролептиков и отдельные препараты различаются по влиянию на образование, накопление, высвобождение и метаболизм нейромедиаторов и их взаимодействие с рецепторами в разных структурах мозга, что существенно отражается на их фармакологических свойствах.
Препараты группы фенотиазина, бутирофенона и др. блокируют дофаминовые (D2) рецепторы разных структур мозга. Полагают, что это обусловливает в основном антипсихотическую активность, тогда как угнетение центральных норадренергических рецепторов (в частности, в ретикулярной формации) – лишь седативную. С угнетением медиаторной активности дофамина связано в значительной мере не только антипсихотическое влияние нейролептиков, но и вызываемый ими “нейролептический” синдром (экстрапирамидные расстройства).
Влияние на центральные дофаминовые рецепторы приводит к некоторым эндокринным нарушениям. Блокируя дофаминовые рецепторы гипофиза, они усиливают секрецию пролактина, а, действуя на гипоталамус, – тормозят секрецию кортикотропина и соматотропного гормона. Нейролептиком с выраженной антипсихотической активностью, но практически не оказывающим экстрапирамидного действия, является клозапин – производное пиперазиндибензодиазепина.
Большинство нейролептиков хорошо всасываются при разных путях введения (внутрь, внутримышечно), проходят через ГЭБ, однако накапливаются в мозге в значительно меньших количествах, чем во внутренних органах (печени, легких), метаболизируются в печени и выделяются с мочой (частично через кишечник). Они имеют относительно небольшой T1/2 и после однократного применения действуют непродолжительно. Созданы препараты пролонгированного действия (флуфеназина деканоат, флуспирилен, пимозид и др.), дающие при парентеральном введении или приеме внутрь длительный эффект. В зависимости от особенностей психотропного действия, дополняющего антипсихотическое влияние выраженным седативным (левомепромазин, перициазин, клозапин, хлорпромазин, хлорпротиксен и др.) или активирующим, энергезирующим (амисульприд, перициазин, пимозид, тиоридазин, сульпирид и др.) эффектом, нейролептики условно разделяют на препараты с преимущественно седативным или активирующим действием.
Наряду с этим, специально выделяют группу нейролептиков с мощным антипсихотическим (“иницизивным”), малодифференцированным действием. Они используются главным образом для купирования психомоторного возбуждения и курсового лечения больных с психотической симптоматикой (галоперидол, дроперидол, зуклопентиксол, рисперидон, тиопроперазин, трифлуоперазин, флупентиксол). Особое место в терапевтической практике занимают нейролептики с пролонгированным действием (зуклопентиксола деканоат, пипотиазина пальмитат, флуфеназина деканоат, флуспирилен и др.).
Наряду с указанным разделением нейролептиков на основе их клинического действия, нередко используется и традиционная классификация, основанная на химической структуре этих средств.
С этой точки зрения выделяют (см. табл. 1):
- Фенотиазины алифатические: алимемазин, левомепромазин, промазин, хлорпромазин и др.
- Фенотиазины пиперидиновые и дифенилбутилпиперазиновые: перициазин, пипотиазин, тиоридазин, пенфлуридол, пимозид, флуспирилен и др.
- Фенотиазины пиперазиновые: метофеназин, перфеназин, прохлорперазин, тиопроперазин, трифлуоперазин, флуфеназин и др.
- Бутирофеноны (дифенилбутил-пиперидиновые и пиперазиновые производные): бенперидол, галоперидол, дроперидол и др.
- Тиоксантены: хлорпротиксен, зуклопентиксол, флупентиксол.
- Бензамиды: амисульпирид, сульпирид, сультоприд, тиаприд.
- Производные пиримидина и имидазолидинона: рисперидон, сертиндол.
- Производные индола: дикарбин.
- Препараты других групп: клозапин, оланзапин и др.
В последние годы многие исследователи начали подразделять нейролептики на две группы: так называемые традиционные антипсихотические средства (хлорпромазин, галоперидол, флуфеназин, трифлуоперазин, тиоридазин, пимозид и др.) и новые (“атипичные”) антипсихотические средства (клозапин, оланзапин, кветиапин, рисперидон и др.). Такое подразделение в меньшей степени зависит от времени их создания. Главное отличие – значительное снижение у новых препаратов побочных действий (прежде всего экстрапирамидных расстройств – “нейролептического синдрома”, с которым в первый период связывали и антипсихотическую активность всех нейролептиков) с сохранением и даже усилением собственно психотропного антипсихотического действия. Считается, что это связано с тем, что новые средства образуют меньше активных метаболитов, чем традиционные, и имеют избирательное сродство с дофаминовыми, серотониновыми, мускариновыми и гистаминовыми рецепторами.
Антипсихотическое действие нейролептиков связывают преимущественно с блокадой D2-дофаминовых рецепторов и изменением дофаминергической нейротрансмиссии, что, в свою очередь, может вызвать экстрапирамидные расстройства и пролактинемию. Некоторые средства в малых дозах способны блокировать пресинаптические D2- и D3-рецепторы и парадоксально облегчать дофаминергическую нейропередачу, что проявляется в клинике в виде дезингибирующего или активирующего эффекта. Атипичные нейролептики могут также блокировать серотониновые 5-HT2-рецепторы, с чем связывают их способность уменьшать выраженность негативной симптоматики и когнитивных нарушений у больных шизофренией.
Препараты разного химического строения различаются по их влиянию на образование, накопление, высвобождение и метаболизм нейромедиаторов и их взаимодействие с рецепторами в разных структурах мозга, что существенно отражается на их терапевтических и фармакологических свойствах. Например, алифатические фенотиазины (промазин, хлорпромазин) обладают сильной адреноблокирующей активностью, что клинически проявляется выраженным седативным эффектом и мягким действием на экстрапирамидную систему. Пиперазиновые фенотиазины (перфеназин, тиопроперазин, трифлуоперазин, флуфеназин) и бутирофеноны (галоперидол, дроперидол) обладают слабыми адреноблокирующими и холиноблокирующими, но сильными дофаминоблокирующими свойствами, т.е. характеризуются наиболее выраженным антипсихотическим действием и, в то же время, значительными экстрапирамидными и нейроэндокринными побочными действиями. Пиперидиновые фенотиазины (перициазин, пипотиазин, тиоридазин), тиоксантены (зуклопентиксол, флупентиксол, хлорпротиксен) и бензамиды (сульпирид, сультоприд, тиаприд) занимают промежуточное положение и оказывают среднее антипсихотическое действие и умеренно или слабо выраженные экстрапирамидные и нейроэндокринные побочные эффекты. Атипичные нейролептики, относящиеся к производным дибензодиазепина (клозапин, оланзапин, кветиапин) или бензизоксазола (рисперидон), составляют отдельную группу и характеризуются общим антипсихотическим действием и отсутствием или дозозависимыми экстрапирамидными и нейроэндокринными побочными эффектами.
Общими показаниями для нейролептиков являются острые и хронические психозы и синдромы психомоторного возбуждения различной этиологии у больных шизофренией с органическими и интоксикационными психозами, умственной отсталостью, при расстройствах личности (психопатиях); маниакальных состояниях, ажитированной депрессии, депрессивно-бредовых состояниях, некоторых обсессивно-компульсивных и соматоформных расстройствах; синдроме Жилля де ла Туретта, хорее и других гиперкинетических двигательных расстройствах, тяжелой бессоннице, затяжной икоте, некупирующейся рвоте, предоперационной премедикации, нейролептаналгезии (дроперидол). При купировании тяжелых состояний тревоги и бессонницы назначение нейролептиков возможно лишь на короткий срок в качестве крайней меры при неэффективности анксиолитиков.
Таблица 1. Группировка нейролептиков
| Традиционные нейролептики | Атипичные нейролептики | Нейролептики пролонгированного действия | |
| Фенотиазины | алимемазин, левомепромазин, перициазин, перфеназин, пипотиазин, промазин, тиопроперазин, тиоридазин, трифлуоперазин, флуфеназин, хлорпромазин | пипотиазина пальмитат, флуфеназина деканоат | |
| Бутирофеноны | галоперидол, дроперидол | галоперидола деканоат | |
| Тиоксантены | зуклопентиксол, флупентиксол, хлорпротиксен | зуклопентиксола деканоат, флупентиксола деканоат | |
| Бензамиды | сульпирид, сультоприд, тиаприд | ||
| Производные бензизоксазола | рисперидон | ||
| Производные индола | дикарбин | ||
| Производные дибензодиазепина | кветиапин, клозапин, оланзапин |
Определяющими параметрами в спектре клинической активности нейролептиков являются:
- глобальное антипсихотическое инцизивное действие – способность препарата равномерно редуцировать различные проявления психоза и препятствовать прогредиентности заболевания;
- первичное седативное (затормаживающее) действие, необходимое для быстрого купирования галлюцинаторно-бредового или маниакального возбуждения; сопровождается глобальным депримирующим влиянием на ЦНС, в т.ч. явлениями брадипсихизма, нарушениями концентрации внимания, снижением уровня бодрствования и снотворным действием;
- избирательное антипсихотическое действие – связано с воздействием на отдельные симптомы-мишени, например, на бред, галлюцинации, расторможенность влечений, нарушения мышления или поведения; обычно развивается вторично вслед за глобальным антипсихотическим эффектом;
- активирующее антипсихотическое действие (растормаживающее, дезингибирующее и антиаутистическое) – обнаруживается прежде всего у больных шизофренией с негативной (дефицитарной) симптоматикой;
- депрессогенное действие – способность некоторых (преимущественно седативных) антипсихотиков при длительном применении вызывать специфические (заторможенные) депрессии;
- экстрапирамидное действие – связано с влиянием на экстрапирамидную систему мозга и проявляется неврологическими нарушениями – от острых (пароксизмальных) до хронических (практически необратимых);
- соматотропное действие – связано в основном с выраженностью адреноблокирующих и антихолинергических свойств и проявляется в нейровегетативных и эндокринных побочных эффектах, в т.ч. гипотензивных реакциях и гиперпролактинемии.
Эти параметры имеют важное значение при клиническом выборе нейролептика, и в зависимости от соотношения глобального антипсихотического действия и других, дополняющих эффектов выделяют:
1) седативные нейролептики (левомепромазин, перициазин, промазин, хлорпромазин, хлорпротиксен и др.), которые независимо от дозы сразу вызывают определенный затормаживающий эффект;
2) иницизивные нейролептики, обладающие мощным глобальным антипсихотическим действием (галоперидол, зуклопентиксол, пипотиазин, тиопроперазин, трифлуоперазин, флуфеназин и др.). В малых дозах им свойственны активирующие эффекты, а с увеличением дозы нарастают и купирующие психотическую (галлюцинаторно-бредовую) и маниакальную симптоматику свойства;
3) дезингибирующие нейролептики (сульпирид, дикарбин и др.), преимущественно (т.е. в широком диапазоне доз) оказывающие растормаживающее, активирующее действие.
Атипичные нейролептики (кветиапин, клозапин, оланзапин, рисперидон), как уже указывалось выше, выделяют в отдельную группу, так как, оказывая отчетливое антипсихотическое действие, они не вызывают или вызывают дозозависимые экстрапирамидные расстройства и способны корригировать негативные и когнитивные нарушения у больных шизофренией.
Дифференцированный подход к назначению нейролептиков осуществляют с учетом клинической картины заболевания, индивидуальной переносимости и спектра психотропного действия и побочных эффектов препарата. При шизофрении нейролептики можно применять как курсом для купирования острого психоза, так и длительно для непрерывного подавления продуктивной симптоматики при хроническом течении болезни или для профилактики обострений и сдерживания темпа прогредиентности заболевания, а также для коррекции негативных (дефицитарных) расстройств. Применение пролонгированных форм существенно облегчает амбулаторное лечение, так как позволяет обеспечить максимальную непрерывность терапевтического воздействия.
Не рекомендуется назначать комбинации нейролептиков (особенно в сочетании с атипичными), поскольку возрастает риск развития побочных явлений. При сочетании галлюцинаторно-бредовой симптоматики с некупирующимся возбуждением иногда допустимо назначение в виде короткого курса двух нейролептиков – одного с седативным, другого с мощным антипсихотическим эффектом (например, галоперидола с левомепромазином, хлорпротиксеном или хлорпромазином), или сочетание иницизивного нейролептика с анксиолитиком (например, галоперидол с феназепамом или лоразепамом).
Дозы нейролептика подбирают индивидуально. При отсутствии ургентных показаний (например, острого психоза или сильного возбуждения) дозу обычно повышают постепенно или вводят сначала небольшую тестовую дозу, а при отсутствии в течение 2 ч аллергических или других реакций ее постепенно увеличивают.
При замене одного нейролептика другим следует руководствоваться следующими примерными эквивалентами доз для приема внутрь (так называемый “аминазиновый эквивалент”, см. табл. 2):
Подбор более высоких доз должен проводиться в специализированных учреждениях. Приведенные аминазиновые эквиваленты не могут быть экстраполированы на максимальные дозы препаратов.
Отмену нейролептиков необходимо производить постепенно, под тщательным контролем врача во избежание развития синдрома отмены или обострения симптоматики.
Экстрапирамидные побочные эффекты нейролептиков и их медикаментозная коррекция
Развитие побочных неврологических эффектов классических нейролептиков связано с блокадой дофаминовых D2-рецепторов в нигростриальной системе мозга. Их способность вызывать экстрапирамидные расстройства возрастает от алифатических к пиперазиновым производным фенотиазина и к бутирофенонам. Атипичные нейролептики избирательно действуют на мезолимбическую и мезокортикальную дофаминергическую систему мозга и менее выражено влияют на нигростриальную систему, что объясняет редкость возникновения экстрапирамидных побочных эффектов при их использовании.
Экстрапирамидные двигательные расстройства, связанные с приемом нейролептиков, разделяются на острую дистонию, паркинсонизм, острую акатизию и поздние дискинезии.
Острая дистония (острая, ранняя дискинезия) характеризуется неправильным положением головы и шеи по отношению к туловищу (ретроколлис, тортиколлис), спазмами жевательных мышц (тризм, зевание, гримасничанье), нарушением глотания (дисфагия), речи или дыхания (ларинго-фарингеальные спазмы, дисфония), смазанной и затрудненной речью, обусловленной гипертонусом или увеличением языка (дизартрия, макроглоссия), высовыванием языка, спазмами глазодвигательных мышц (окулогирные кризы). Эти симптомы развиваются в течение первых 7 дней с момента начала нейролептической терапии или повышения дозы ранее принимаемых нейролептиков и уменьшаются после назначения антипаркинсонических корректоров или спонтанно редуцируются.
Лечение. Антихолинергические средства (корректоры). Бипериден (в/м или в/в), бензодиазепины (диазепам, феназепам в/м или в/в), хлорпромазин (в/м), раствор кофеина (п/к). При генерализованных дистониях показано одновременное назначение нейролептиков (хлорпромазин или левомепромазин в/м) и холинолитиков (бипериден – в/м). Для предупреждения повторного развития дискинезий назначают противопаркинсонические средства или увеличивают их дозу.
Лекарственный паркинсонизм характеризуется тремором конечностей, головы, языка, мышечной ригидностью с пластическим повышением мышечного тонуса и симптомом “зубчатого колеса” и акинезией. Эти симптомы появляются в течение первых нескольких недель с момента начала нейролептической терапии или повышения дозы ранее принимаемых нейролептиков и уменьшаются после назначения противопаркинсонических средств.
Лечение. Антихолинергические средства (корректоры) – тригексифенидил, бипериден и др. При резидуальной церебральной органической недостаточности рекомендуется сочетание их с ноотропами, снижение дозы нейролептика или перевод больных на другой нейролептик, в т.ч. атипичный. Назначают плазмаферез и гемосорбцию.
Острая акатизия, вызванная приемом нейролептиков, характеризуется субъективными жалобами на беспокойство, cуетливостью, поведенческими нарушениями – раскачиванием, перетоптыванием с ноги на ногу, постоянным хождением, невозможностью сидеть или стоять спокойно в течение нескольких минут. Эти симптомы появляются в течение первых 4 нед с момента начала нейролептической терапии или повышения дозы нейролептиков и уменьшаются после назначения противопаркинсонических средств.
Таблица 2. Аминазиновый эквивалент нейролептиков*
|
Нейролептик |
Аминазиновый эквивалент, мг/сут |
|
Галоперидол |
2-3 |
|
Зуклопентиксол |
25 |
|
Кветиапин |
200 |
|
Клозапин |
50 |
|
Оланзапин |
5 |
|
Перфеназин |
10 |
|
Пипотиазин |
10–12 |
|
Рисперидон |
0,5–1 |
|
Сульпирид |
200 |
|
Тиаприд |
100 |
|
Тиопроперазин |
3-5 |
|
Тиоридазин |
100 |
|
Трифлуоперазин |
5–10 |
|
Флупентиксол |
5–10 |
|
Флуфеназин |
3 |
|
Хлорпромазин |
100 |
* Федеральное руководство по использованию лекарственных средств, вып. 3, 2002
Лечение. Антихолинергические средства (корректоры) – тригексифенидил, бипериден и др., анксиолитики (диазепам, клоназепам, феназепам), бета-адреноблокаторы (пропранолол).
Поздняя дискинезия характеризуется хореиформными, атетоидными и ритмическими (стереотипии) непроизвольным движениями языка, челюсти, туловища, конечностей, возникающими в связи с назначением нейролептиков. Эти симптомы чаще наблюдаются при длительной терапии нейролептиками.
Лечение. При появлении первых признаков развития поздних дискинезий необходима отмена нейролептиков или перевод больного на другой нейролептик (тиаприд, тиоридазин и др.), в т.ч. атипичный. Применение противопаркинсонических средств с центральной холинолитической активностью при хроническом экстрапирамидном нейролептическом синдроме малоэффективно. Назначаются антиоксиданты (альфа-токоферол), ноотропы (пирацетам, пикамилон, пантогам, фенибут и др.), общеукрепляющая терапия, физиотерапия, плазмаферез и гемосорбция. Применяются миорелаксанты (баклофен), нормотимики (вальпроат натрия), анксиолитики (диазепам, клоназепам).
Злокачественный нейролептический синдром относится к неотложным состояниям и характеризуется внезапным развитием гипертермии, кататонических и сомато-вегетативных расстройств, токсикозом, помрачением сознания. Часто осложняется явлениями легочной и почечной недостаточности. Летальность достигает 20–38%.
Лечение. Отмена нейролептиков, назначение интенсивной инфузионной терапии (от 2,5 до 6 л/сут), ноотропов, дофаминергических препаратов (бромокриптин, амантадин и др.), плазмафереза и гемосорбции.
Антидепрессанты (тимоаналептические препараты)
К антидепрессантам относятся психотропные средства, оказывающие влияние на патологически сниженное настроение (депрессию). Антидепрессивное действие разных препаратов сопровождается психоседативным (особенно важным при назначении больным с тревожно-депрессивными расстройствами) или психостимулирующим эффектом (имеющим особое значение при лечении астенодепрессивных и депрессивных состояний, сопровождающихся заторможенностью). В соответствии с этим антидепрессанты условно можно разделить на седативные и активирующие, а также выделить группу препаратов со сбалансированным типом действия, занимающую промежуточное положение.
К антидепрессантам относят ингибиторы МАО: необратимые (ниаламид) и обратимые (моклобемид), тетра- и трициклические соединения (миансерин, имипрамин, амитриптилин, пипофезин, пирлиндол), вторичные амины (дезипрамин).
Наиболее изученными являются трициклические соединения. Механизм действия трициклических антидепрессантов связан с блокадой обратного захвата норадреналина пресинаптическими нервными окончаниями, вследствие чего содержание норадреналина в синаптических щелях увеличивается. В местах накопления норадреналина (различные структуры головного мозга, а также сердце и легкие, селезенка и другие органы) повышается активность адренергической передачи нервных импульсов, происходит возбуждение центральных и периферических альфа- и бета-адренорецепторов. Аналогичное действие трициклических антидепрессантов наблюдается в отношении дофамина и серотонина. Препараты этой группы блокируют центральные и периферические м-холинорецепторы, оказывая атропиноподобное действие.
Ингибиторы МАО блокируют МАО, вызывающую окислительное дезаминирование и инактивацию моноаминов (норадреналина, дофамина, серотонина) с накоплением этих аминов в структурах головного мозга. Некоторые антидепрессанты сочетают в себе действие ингибиторов МАО и тетра- и трициклических соединений.
Как и при подразделении нейролептиков на старые и новые, антидепрессанты в последнее время принято рассматривать в группах старых (“классических”) и новых препаратов. К первым относятся трициклические антидепрессанты (амитриптилин, кломипрамин, доксепин, имипрамин, нортриптилин и др.) и препараты иной структуры (миансерин). Они являются неселективными ингибиторами поглощения норадреналина и серотонина. Трициклические антидепрессанты имеют сродство к широкому кругу постсинаптических рецепторов, что, вероятно, определяет не только их потенциально терапевтическое действие, но и побочные эффекты. Вторая группа (новые антидепрессанты) включает главным образом селективные ингибиторы обратного захвата серотонина, которые способны тормозить обратное поглощение серотонина в синаптической щели и имеют сродство к допаминовым, ацетилхолиновым, гистаминовым и адреналиновым рецепторам. Именно с этими механизмами связывают и высокую эффективность новых антидепрессантов и их сравнительно незначительные (в сравнении с группой старых препаратов) побочные эффекты. К числу новых антидепрессантов относят пароксетин, сертралин, флувоксамин, флуоксетин, циталопрам, а также моклобемид (обратимый ингибитор МАО-А), нафазодон (селективный постсинаптический серотониновый антагонист).
Анксиолитики (транквилизаторы)
Анксиолитики – лекарственные средства, уменьшающие выраженность или подавляющие тревогу, страх, беспокойство и эмоциональное напряжение.
Принято выделять несколько эффектов, в той или иной степени характерных для всех анксиолитиков. Однако соотношение и выраженность эффектов значительно варьируют у разных препаратов этой группы.
1. Анксиолитический – уменьшение тревоги, страха, эмоциональной напряженности.
2. Седативный (успокаивающий) эффект – уменьшение психомоторной возбудимости, сопровождается снижением дневной активности, концентрации внимания, уменьшением скорости реакции и др.
3. Миорелаксирующий (расслабление скелетной мускулатуры), может проявляться в ощущении вялости, слабости и др.
4. Противосудорожный – проявляется в подавлении распространения эпилептогенной активности, возникающей в эпилептогенных очагах в коре, таламусе и лимбических структурах.
5. Снотворный (гипнотический) – выражается в облегчении наступления сна и увеличении его продолжительности, усилении действия снотворных, наркозных и анальгезирующих средств.
6. Вегетостабилизирующий – связан с нормализацией функциональной активности вегетативной нервной системы. Клинически этот эффект может выражаться уменьшением вегетативных проявлений тревоги (нестабильность АД, тахикардия, потливость, нарушение функции ЖКТ и др.).
В спектре действия некоторых транквилизаторов иногда выделяют дополнительные эффекты – активизирующий, антифобический и др. Сочетание анксиолитического действия с активизирующим эффектом характерно для медазепама, гидазепама, тофизопама и др. Антифобическое действие выражено у алпразолама, диазепама, клоназепама, лоразепама, хлордиазепоксида и др.
При выборе анксиолитика для клинического применения учитывают различия в спектре действия препаратов.
Выраженным анксиолитическим действием обладают феназепам (по анксиолитической активности превосходит многие бензодиазепины, в т.ч. диазепам), диазепам, лоразепам, алпразолам и др. Умеренно выраженное анксиолитическое действие отмечено у хлордиазепоксида, бромазепама, гидазепама, клобазама, медазепама, оксазепама и др. Выраженными противосудорожными свойствами обладают клоназепам, диазепам, а также (в меньшей степени) нитразепам и др. Миорелаксирующая активность характерна для диазепама, хлордиазепоксида, лоразепама и др. Выраженным вегетотропным действием обладают тофизопам, диазепам, гидазепам и др.
Среди транквилизаторов можно выделить препараты с выраженным анксиолитическим действием при относительно слабом миорелаксирующем и снотворном (тофизопам, медазепам и др.), в связи с чем они более удобны для применения в дневные часы (так называемые дневные транквилизаторы).
Наиболее широкое применение в медицинской практике из группы анксиолитиков получили производные бензодиазепина (бензодиазепины): алпразолам, диазепам, клоназепам, медазепам, тофизопам, хлордиазепоксид и др. Более старые средства – анксиолитики небензодиазепиновой структуры (гидроксизин, мепробамат, бензоклидин и др.) не потеряли своего значения, но имеют ограниченное применение.
Действие анксиолитиков проявляется за счет снижения возбудимости подкорковых областей головного мозга (лимбическая система, таламус, гипоталамус), ответственных за осуществление эмоциональных реакций, за счет торможения взаимодействия этих структур с корой головного мозга, а также угнетения полисинаптических спинальных рефлексов.
Механизм действия бензодиазепинов связан с тем, что они взаимодействуют со специфическими бензодиазепиновыми рецепторами (являются агонистами этих рецепторов), входящими в состав постсинаптического ГАМКА-рецепторного комплекса в лимбической системе мозга, таламусе, гипоталамусе, восходящей активирующей ретикулярной формации ствола мозга и вставочных нейронах боковых рогов спинного мозга. Бензодиазепины повышают чувствительность ГАМК-рецепторов к медиатору (ГАМК), что обусловливает повышение частоты открытия в цитоплазматической мембране нейронов каналов для входящих токов ионов хлора. В результате происходит усиление тормозного влияния ГАМК и угнетение межнейронной передачи в соответствующих отделах ЦНС.
Основными показаниями к назначению бензодиазепинов являются невротические и тревожные расстройства, паническое расстройство, генерализованное тревожное расстройство, посттравматические стрессовые реакции; нервное напряжение, тревога при психосоматических заболеваниях; состояние беспокойства, сопровождающее заболевания внутренних органов; соматоформные расстройства; тревожный синдром при эндогенных психозах (как вспомогательное средство в составе комплексной терапии, в комбинации с антидепрессантами, нейролептиками); спазмы, ригидность мышц, контрактуры; заболевания, сопровождающиеся повышенным мышечным тонусом, спастичностью или гиперкинезами; эклампсия, столбняк и все виды судорожных состояний; психические заболевания с двигательным беспокойством, возбуждением, резкой тревогой, явления абстиненции и делирий при алкоголизме; расстройства сна различного генеза; премедикация, вводный наркоз; начинающиеся преждевременные роды и угроза преждевременных родов вследствие мышечного спазма (только в конце III триместра беременности); облегчение родовой деятельности, преждевременная отслойка плаценты (для парентерального введения); невротические расстройства у детей; эпилептический статус (для парентерального введения).
При пересчете суточной дозы бензодиазепинов необходимо иметь в виду, что 5 мг диазепама приблизительно эквивалентны 15 мг хлордиазепоксида, 0,5 мг лоразепама, 5 мг нитразепама, 15 мг оксазепама, 10 мг темазепама.
При назначении бензодиазепиновых анксиолитиков для лечения тревожных расстройств следует соблюдать принцип постепенного повышения дозы, начиная с минимально эффективной до оптимальной для получения терапевтического эффекта (исключением являются острые состояния). В связи с возможностью привыкания и лекарственной зависимости курс лечения должен быть как можно более коротким (2–4 нед). После этого необходима повторная оценка состояния больного для принятия решения о дальнейшей терапии. При необходимости длительного лечения (несколько месяцев) курс следует проводить по методу прерывистой терапии, прекращая прием на несколько дней с последующим назначением той же индивидуально подобранной дозы. Отмену следует проводить постепенно снижая дозу, чтобы уменьшить риск развития синдрома отмены.
Анксиолитики (преимущественно бензодиазепины) эффективны при всех видах тревожных расстройств. Однако применение бензодиазепинов для лечения непродолжительных состояний легкой тревоги не всегда оправданно. Не следует назначать эти препараты при любых стрессовых состояниях, в частности при реакциях горя или соматических заболеваниях. Применение некоторых анксиолитиков у здоровых людей может быть оправдано при острых стрессовых состояниях в экстремальных ситуациях (пожар, промышленная катастрофа, землетрясение и др.).
Основными противопоказаниями к назначению анксиолитиков являются индивидуальная гиперчувствительность, тяжелые нарушения функции печени и/или почек, миастения, порфирия, глаукома, тяжелая сердечная и дыхательная недостаточность, атаксия, суицидальные наклонности, наркотическая или алкогольная зависимость (исключение – острый абстинентный синдром).
Следует избегать приема анксиолитиков во время беременности (особенно в I триместре) и в период кормления грудью, т.к. эти препараты проходят через плаценту, а также проникают в грудное молоко. Имеются данные о том, что некоторые бензодиазепины (хлордиазепоксид и диазепам) повышают риск врожденных пороков развития при назначении в I триместре беременности. Другие ЛС этой группы также могут увеличивать такую опасность, поэтому к назначению в период беременности следует подходить очень осторожно и применять их в том случае, если нет альтернативы, сопоставляя возможный риск для плода и пользу для матери.
При назначении бензодиазепинов (клоназепам, диазепам и др.) во время беременности женщинам, больными эпилепсией, следует учитывать, что имеются сообщения о повышении частоты врожденных пороков у детей, матери которых принимали противосудорожные препараты во время беременности, однако причинно-следственная связь пока не установлена. В то же время, у женщин, принимающих противосудорожные препараты (например, клоназепам), отмена до или во время беременности возможна только в случаях, когда эпилептические припадки являются слабыми и редкими при отсутствии лечения и если вероятность эпилептического состояния и симптомов отмены оценивается как невысокая.
Применение производных бензодиазепина в III триместре беременности (особенно в последние недели) может привести к накоплению препарата в тканях плода и, как следствие, к угнетению ЦНС у новорожденных. При этом у новорожденных может отмечаться мышечная слабость, гипотермия, возможно угнетение дыхания, нарушение сосательного рефлекса.
Длительный прием бензодиазепинов на протяжении беременности, в т.ч. на поздних стадиях, может привести к формированию физической зависимости и развитию симптомов отмены у новорожденного.
С осторожностью используют бензодиазепины в период родовой деятельности (только по строгим показаниям, например, парентеральное введение диазепама для облегчения родовой деятельности, при преждевременных родах или преждевременной отслойке плаценты). Диазепам в низких дозах, как правило, не оказывает неблагоприятного влияния на плод, однако использование высоких доз может вызвать у новорожденных нарушение сердечного ритма, понижение давления, приступы удушья, мышечную слабость, гипотермию и др.
Поскольку бензодиазепины в значимых количествах проникают в грудное молоко, не следует применять средства этой группы кормящими матерями. У новорожденных метаболизм бензодиазепинов происходит медленнее, чем у взрослых, вследствие чего эти ЛС и их метаболиты могут накапливаться в организме и вызывать седативный эффект. При этом возможны трудности при кормлении новорожденных, потеря веса.
Применение анксиолитиков у детей и подростков до 18 лет оправдано только в исключительных случаях, при четко обоснованных показаниях, при этом продолжительность лечения должна быть минимальной.
Неблагоприятными побочными эффектами при приеме анксиолитиков являются признаки угнетения ЦНС, в т.ч. сонливость в дневное время, вялость, мышечная слабость, притупление эмоций, головная боль, головокружение, атаксия и др.
В связи со снижением скорости психомоторных реакций, ослаблением концентрации внимания следует с осторожностью применять анксиолитики у пациентов, работа которых требует быстрой психической и физической реакции, а также связана с повышенной концентрацией внимания (водители транспортных средств и др.).
При приеме анксиолитиков бензодиазепинового ряда возможна парадоксальная реакция (двигательное возбуждение, раздражительность, агрессивность, неадекватное поведение, усиление тревоги, галлюцинации и др.). Парадоксальная реакция чаще проявляется у детей, больных старческого возраста, при злоупотреблении алкоголем, наркотиками, на фоне приема других средств, угнетающих ЦНС. При возникновении парадоксальной реакции препарат следует немедленно отменить.
Применение анксиолитиков, особенно бензодиазепинового ряда, может приводить к развитию привыкания к препарату с необходимостью постоянного повышения дозы для достижения эффекта, а также к формированию лекарственной зависимости (физической и/или психической). Риск возникновения зависимости возрастает при длительном применении (свыше 6 мес), особенно в высоких дозах, а также у пациентов с лекарственной и алкогольной зависимостью в анамнезе.
При резкой отмене препарата на фоне лекарственной зависимости может возникнуть синдром отмены. В ряде случаев признаками синдрома отмены являются тремор, судороги, рвота, повышенная потливость, в тяжелых случаях – деперсонализация, галлюцинации, эпилептические припадки (резкая отмена при эпилепсии).
Снижению риска зависимости и трудностей, возникающих при отмене препарата, способствует правильно выбранная тактика проведения лечения и его отмены.
При лечении анксиолитиками следует учитывать возможное взаимодействие с другими лекарственными средствами и алкоголем. При приеме анксиолитиков недопустимо употребление алкогольных напитков, поскольку алкоголь усиливает угнетающее влияние этих средств на ЦНС (что может сопровождаться тяжелыми побочными эффектами, в т.ч. потерей сознания, угнетением дыхания). В свою очередь, транквилизаторы усиливают токсическое действие алкоголя на ЦНС. При одновременном применении с алкоголем возможны также парадоксальные реакции (психомоторное возбуждение, агрессивное поведение, состояние патологического опьянения).
Анксиолитики потенцируют эффекты других средств, угнетающих ЦНС (наркотические анальгетики, наркозные средства, снотворные, нейролептики с выраженным седативным действием, антигистаминные средства с выраженным седативным эффектом), миорелаксантов и др. Одновременный прием бензодиазепинов с другими средствами, угнетающими ЦНС, может привести к передозировке и опасным для жизни последствиям (в случае серьезной передозировки требуется врачебное вмешательство).
Симптомы передозировки могут проявляться в угнетении ЦНС различной степени выраженности (от сонливости до комы). Специфическим антагонистом бензодиазепиновых рецепторов является флумазенил. Его применение в качестве специфического антидота при передозировке бензодиазепинами возможно только в условиях стационара.
Анализ известных в настоящее время данных о действии транквилизаторов позволяет считать, что их клинический эффект может рассматриваться в двух аспектах. Во-первых, в отношении основной для психофармакологических препаратов собственно психотропной активности, имеющей у транквилизаторов специфическую направленность на невротическую структуру психопатологических проявлений. Во-вторых, в отношении группы клинических эффектов, не имеющих непосредственного отношения к психотропному действию, хотя и значительно дополняющих его (эта группа эффектов представляет собой, прежде всего, выражение нейровегетотропной направленности действия транквилизаторов). Разделение психопатологических, неврологических и других расстройств, изменяющихся в процессе лечения (рис. 5), носит условный характер, они не бывают изолированными и лишенными взаимосвязей.
Рис. 5. Основные компоненты клинического действия анксиолитиков
Снотворные средства (гипнотики)
Каждому врачу, который в своей практике сталкивается с больными, жалующимися на нарушения сна, еще до выбора медикаментозного лечения необходимо провести правильную диагностику инсомнии. Ее цель – дифференцированная оценка нарушений сна, возникающих при разных соматических и психических заболеваниях. Для лечения инсомнии раньше использовались барбитураты, хлоралгидрат, производные пропандиола (мепробамат), которые из-за своей токсичности, частоты возникновения побочных эффектов, развития зависимости, нежелательных взаимодействий с другими лекарственными средствами в настоящее время практически не применяются. Основными препаратами, которые пришли им на смену, являются анксиолитики с выраженным снотворным действием, или так называемые гипнотики.
В психофармакологии существует понятие “идеального” гипнотика, который характеризуется быстротой всасывания, легкостью прохождения через ГЭБ, продолжительностью действия, перекрывающей период сна, но не распространяющейся на дневное время. “Идеальный” гипнотик не вызывает седативный эффект в дневное время. Последняя характеристика гипнотиков особенно важна в амбулаторной практике, когда лечение больного не должно приводить к сонливости в дневные часы, вялости, замедленному течению мыслей, трудностям концентрации внимания и снижению работоспособности. Кроме того, желаемые свойства гипнотиков включают отсутствие толерантности к гипнотическому эффекту при непрерывном применении препарата, эффектов отмены, нежелательных взаимодействий с алкоголем. Более того, они должны иметь широкое терапевтическое действие, позволяющее использовать гипнотики у больных пожилого возраста, с легкой и средней степенью выраженности заболеваний печени и почек. Риск несчастных случаев при приеме мегадоз (например, с целью суицида) должен быть минимален.
При лечении нарушений сна применяются этиологический, патогенетический и симптоматический подходы. При этом используются различные методы и средства, эффективность которых различна и зависит от характера заболевания, клинических синдромов, особенностей личности больных.
Исследования последних десятилетий в значительной мере приоткрыли сложные механизмы регуляции сна. Известно, что в их организации принимают участие нейрогуморальные структуры ствола мозга, лимбической системы, базальных ганглиев и коры мозга. Однако внутренняя организация регуляторной системы, ее характеристики и особенно возможности активного вмешательства в эти процессы с целью коррекции расстройств сна все еще изучены недостаточно.
Учитывая важную роль эмоций в механизмах сна, для регуляции его расстройств широко используются методы и средства с непосредственным воздействием на эмоционально-мотивационную сферу. Отсюда – использование анксиолитиков, постепенно вытесняющих в широкой клинической практике традиционные еще в недавнем прошлом фармакологические препараты группы барбитуратов.
При фармакотерапии важен не только выбор препарата, но и правильное распределение его доз в течение суток. Терапия нарушений сна не может ограничиваться назначением снотворных препаратов. Она должна быть комплексной и предусматривать лечение основного заболевания.
Нормотимические средства (нормотимики)
Объединяет группу нормотимиков клинико-фармакологическое действие, заключающееся во влиянии на расстройства аффективной сферы. Благодаря этому “выравниваются” колебания настроения у больных с маниакальными состояниями и депрессией. Препараты этой группы применяются как для лечения аффективных расстройств, так и для профилактики рецидивов и обострений (поддерживающая, амбулаторная терапия) у больных шизофренией, маниакально-депрессивным психозом, с личностными расстройствами и др.
К числу нормотимиков относят соли лития (карбонат, глюконат, сульфат, оксибутират и др.), карбамазепин, производные вальпроевой кислоты (вальпроат натрия), блокаторы кальциевых каналов (верапамил, нифедипин и др.).
Ряд указанных препаратов, обладая широким диапазоном клинико-фармакологической активности, с успехом используются в различных областях медицины. У препаратов солей лития, особенно у средств с замедленным выведением, могут наблюдаться значительные отличия фармакокинетических параметров. Тем не менее, по сравнению с другими психотропными средствами фармакокинетика солей лития отличается значительной стабильностью и, что особенно важно, наличием корреляционной связи между дозой препарата, его концентрацией в крови и клинико-терапевтическим эффектом. Поэтому дозы препаратов лития устанавливают на основании определения его содержания в крови или по клинической картине.
Психостимуляторы (психотоники)
Психостимуляторы способны оказывать стимулирующее влияние на функции головного мозга, активируя психическую и физическую деятельность, повышая физическую выносливость и темп интеллектуальной деятельности. В известной степени к психостимуляторам можно отнести некоторые нейрометаболические стимуляторы (см. ниже), действующие на пациентов, которые находятся в экстремальных условиях (физическая перегрузка и т.д.). Такие средства называют также актопротекторами, и к ним относятся вещества, отличительной особенностью которых являются их высокая антигипоксическая активность и влияние на энергетический обмен головного мозга. Препараты этой группы высокоэффективны при лечении астенических нарушений за счет влияния на гипоксические механизмы физического и психического утомления.
В основе механизма психостимулирующего действия – центральный симпатомиметический эффект. Он обусловлен выбросом эндогенных катехоламинов из пресинаптических депо, угнетением обратного захвата медиатора и увеличением его концентрации в синаптической щели, прямым воздействием на постсинаптические адренорецепторы, торможением МАО. К психостимуляторам относят производные фенилалкиламина (амфетамин), фенилалкилсиднонимина (мезокарб, фепрозиднин), метилксантина (кофеин).
В российской психиатрической практике из этой группы препаратов наиболее часто применяются мезокарб (психостимулятор) и этилтиобензимидазола гидробромид (актопротектор). К числу психостимуляторов, редко используемых в настоящее время, относится фепрозиднин (по химическому строению и характеру действия близок к мезокарбу, отличается от него менее “резким” психостимулирующим эффектом и незначительно выраженным антидепрессивным действием).
Поиск новых, перспективных психотропных средств среди препаратов метаболического действия позволил использовать в качестве стимуляторов ЦНС препараты из группы актопротекторов – класса фармакологических средств, первично предложенных для стимуляции работоспособности и обладающих специфическими фармакологическими свойствами.
Нейрометаболические стимуляторы
Термин “ноотропы” (от греч. ноос – мышление, разум и тропос – стремление) был впервые предложен в 1972 г. после внедрения в медицинскую практику пирацетама. По определению экспертов ВОЗ, ноотропные препараты – это средства, оказывающие прямое активирующее влияние на обучение, улучшающие память и умственную деятельность, а также повышающие устойчивость мозга к агрессивным воздействиям.
К ноотропам относят, в первую очередь, пирацетам и его гомологи (анирацетам, оксирацетам, прамирацетам, этирацетам и др.), пиритинол, меклофеноксат, а также некоторые средства, структурно связанные с гамма-аминомасляной кислотой – натрия оксибат, пантогам, гамма-амино-бета-фенилмасляной кислоты гидрохлорид, никотиноил-гамма-аминомасляная кислота и др.).
Наиболее важными проявлениями действия ноотропов являются активация интеллектуальных и мнестических функций, повышение способности к обучению и улучшение памяти. Они в той или иной степени стимулируют передачу возбуждения в центральных нейронах, облегчают передачу информации между полушариями головного мозга, улучшают энергетические процессы и кровоснабжение мозга.
Характерным свойством ноотропов является их антигипоксическая активность. Способность уменьшать потребность тканей в кислороде и повышать устойчивость организма к гипоксии характерна в той или иной степени для всех ноотропных препаратов. Механизм действия ноотропных средств изучен недостаточно. Пирацетам имеет по химической структуре сходство с ГАМК и может рассматриваться как производное этой аминокислоты, являющейся основным центральным тормозным нейромедиатором. Однако в организме пирацетам в ГАМК не превращается и содержание ГАМК в мозге после применения пирацетама не увеличивается. Вместе с тем, в относительно больших дозах и при повторном введении пирацетам способен усиливать ГАМКергические тормозные процессы. Таким образом, не исключаются ГАМКергические элементы и значение ГАМКергических процессов в механизме действия пирацетама. Имеет значение, вероятно, влияние ноотропных средств на другие нейромедиаторные системы мозга, в том числе на глутаматергические процессы, на синтез дофамина и уровень норадреналина. Под влиянием пирацетама и меклофеноксата увеличивается концентрация ацетилхолина на уровне синапсов и плотность холинергических рецепторов. Некоторые ноотропы повышают содержание в мозге серотонина. Особо важным в механизме действия ноотропов является влияние на метаболические и биоэнергетические процессы в нервной клетке: активация синтеза белка и РНК, улучшение утилизации глюкозы, усиление синтеза аденозинтрифосфата, антигипоксическое и мембраностабилизирующее действие и др.
Болезни в статье:



