- Эпидемиология и факторы риска
- Рак внепеченочных желчных протоков (рак ВЖП)
- Рак большого дуоденального сосочка (рак БДС)
- Молекулярно-генетические и биологические особенности рака ВЖП
- Патологическая анатомия, особенности клинического течения рака ВЖП и БДС
- Гистологические формы рака ВЖП
- Рак БДС
- Клинико-анатомическая классификация рака БДС по TNM (5 редакция, 1997)
- Эмбриональная рабдомиосаркома внепеченочных желчных протоков
- Меланома ВЖП
- Первичная лимфома ВЖП
- Диагностика злокачественных опухолей ВЖП и БДС
- Методы диагностики и визуализации
- Методы купирования механической желтухи у больных раком ВЖП и БДС
- 1. Чрескожные чреспеченочные методы желчеотведения
- 2. Эндоскопические транспапиллярные методы желчеотведения
- 3. Хирургическое и эндохирургическое формирование билиодигестивных анастомозов
C24 Злокачественное новообразование других и неуточненных частей желчевыводящих путей, МКБ-10
- C24.0 Внепеченочного желчного протока
- C24.1 Ампулы фатерова сосочка
- C24.8 Поражение желчных путей, выходящее за пределы одной и более вышеуказанных локализаций
- C24.9 Желчных путей неуточненное
Отредактировано: 02.04.2024
Эпидемиология и факторы риска
Экзокринные микроскопические формы рака являются абсолютно преобладающими среди первичных злокачественных опухолей органов билиопанкреатодуоденальной области (желчный пузырь, внепеченочные желчные протоки, большой дуоденальный сосочек, поджелудочная железа, двенадцатиперстная кишка). Данные о заболеваемости раком внепеченочных желчных протоков (ВЖП) отсутствуют. Относительная частота поражения экзокринным раком ВЖП среди других локализаций рака в органах билиопанкреатодуоденальной области составляет 9,2–15%, большого дуоденального сосочка (БДС) — 12,7–18,3% (Nakase A. et al., 1977; Блохин Н.Н. и др., 1982; Лапкин К.В. и др., 1991). По данным ГУ РОНЦ им. Н.Н. Блохина РАМН, среди 1173 больных экзокринным раком органов билиопанкреатодуоденальной зоны, наблюдавшихся с 1990 по 2002 г., рак ВЖП диагностирован у 132 (11,3%) пациентов, рак БДС — у 149 (12,7%) пациентов. Другие первичные злокачественные опухоли внепеченочных желчных протоков имеют неэпителиальное происхождение — эмбриональная рабдомиосаркома, меланома, лимфома — и встречаются крайне редко. В БДС кроме рака другие первичные злокачественные опухоли практически не встречаются.
Рак внепеченочных желчных протоков (рак ВЖП)
В структуре злокачественных новообразований на рак ВЖП приходится не более 1% заболевших. По данным ГУ РОНЦ им. Н.Н. Блохина РАМН, среди всех заболевших раком ВЖП доля больных раком проксимального отдела ВЖП (общий печеночный проток, правый и левый печеночные протоки) — 56%, относительное количество больных раком общего желчного протока несколько меньше — 44%. В пузырном протоке рак практически не встречается. Мужчины болеют в 1,5–2 раза чаще, чем женщины. Факторы риска аналогичны факторам риска при раке желчного пузыря:
— желчнокаменная болезнь;
— аномалии развития внепеченочных желчных протоков, в частности — аномально высокое соединение общего желчного и главного панкреатического протоков;
— врожденная кистозная дилатация желчных путей;
— первичный склерозирующий холангит;
— бактериальная инфекция (тифо-паратифозная инфекция) и паразитарная инвазия (описторхоз, клонорхоз);
— неспецифический язвенный колит.
Предполагается, что в развитии рака общего желчного протока и экзокринного рака поджелудочной железы в качестве индукторов канцерогенеза выступают одни и те же экзогенные и эндогенные вещества.
Рак большого дуоденального сосочка (рак БДС)
В доступной авторам литературе нет данных по эпидемиологии рака БДС. В структуре заболеваемости злокачественными новообразованиями на рак БДС приходится около 1% случаев. Мужчины и женщины болеют одинаково часто. Рак БДС развивается на фоне аденом, гиперпластических полипов БДС (гиперпластические полипы устья, гиперпластические интрапапиллярные полипы), железисто-кистозной гиперплазии переходной складки БДС и аденомиоза. Фактором, способствующим образованию гиперпластических полипов устья БДС, является раздельное впадение холедоха и панкреатического протока на верхушке БДС (Misra S.P.et al., 1990; Caygill C.P.J. et al., 1994; Патютко Ю.И. с соавт., 1997; Пономарев А.А. с соавт., 2000; Bucles D.C. et al., 2002).
Молекулярно-генетические и биологические особенности рака ВЖП
О молекулярно-генетических изменениях, играющих роль при раке ВЖП, известно очень мало.
Мутации гена p53 обнаружены приблизительно у 30% больных. У большинства больных отмечается повышеная экспрессия онкогена mdm–2. У половины больных раком желчных протоков обнаружены мутации гена-супрессора p16 и утрата гетерозиготности для гена-супрессора APC. У половины больных раком дистального отдела ВЖП и несколько реже — при раке проксимального отдела ВЖП — отмечена мутация Smad–4.
Мутации онкогена k-ras обнаруживаются у 21–100% больных раком желчных протоков без прямой корреляции со стадией заболевания. Ни в одном случае доброкачественных изменений в желчных протоках мутации k-ras не обнаружены. Мутации протоонкогенов c-myc и c-erbB–2 имеют место у 94 и 76% больных раком желчных протоков соответственно (Reeves M.E. et al., 2000). Клетки аденокарциномы желчных протоков содержат РНК рецепторов соматостатина.
При раке ВЖП диплоидность в опухолевых клетках характерна для 48% больных, анеуплоидия — для 52%. Анеуплоидия ассоциируется с периневральной инвазией опухоли. Продолжительность жизни больных раком ВЖП выше при диплоидном наборе хромосом. При анеуплоидии выживаемость ниже (Douglass H.O. et al., 1977).
Высокая экспрессия факторов клеточной адгезии Е-катгерина, альфа-катенина в опухолевых клетках ассоциируется с высокодифференцированной опухолью и лучшим прогнозом. Наиболее часто отмечается в клетках макроскопической папиллярной формы рака ВЖП (Mikami T. et al., 2001).
Патологическая анатомия, особенности клинического течения рака ВЖП и БДС
Гистологические формы рака ВЖП
Рак ВЖП представлен в основном аденокарциномами различной степени дифференцировки.
Значительно реже встречается недифференцированный рак.
Плоскоклеточный рак встречается крайне редко.
Скиррозная аденокарцинома — самая частая микроскопическая форма рака ВЖП, образована узкими трубочками, иногда содержит кисты, расположенные в соединительной ткани. Эти железистые образования выстланы однослойным кубическим или призматическим эпителием. Для опухолевых клеток характерна выработка слизи. Ее количество различно, отдельные участки содержат клетки с большим количеством слизи, слизь присутствует в просвете железистых структур, что гистологически напоминает коллоидный рак. В ряде опухолей внутриклеточная слизь расположена в виде капелек, что позволяет говорить о перстневидно-клеточном раке. В метастазах такого рака продукция слизи может быть выражена еще сильнее, чем в первичной опухоли.
Папиллярная аденокарцинома представлена сосочковыми разрастаниями, образованными нежной фиброваскулярной стромой и удлиненными клетками.
Источником развития рака ВЖП является покровный эпителий или слизистые железы.
Макроскопически рак ВЖП представлен 3 формами:
1) узловая,
2) папиллярная,
3) диффузно-инфильтрирующая.
Узловая форма. — наиболее частая. Имеет вид плотного узла серо-белого цвета. Встречается в 50% случаев.
Диффузно-инфильтрирующая макроскопическая форма рака ВЖП по частоте занимает второе место — 43,8%. Представлена инфильтрацией протоков без четких границ и видимой инвазии слизистой. Диагностически наиболее сложна, поскольку напоминает протоки, например, при первичном склерозирующем холангите.
Папиллярная форма рака — самая редкая, встречается у 6,2% больных раком ВЖП. Представлена в виде полиповидных образований, выступающих в просвет желчных протоков. Мультицентричное поражение раком ВЖП не является характерным (Пономарев А.А. и др., 2000).
Важное прогностическое значение имеют макроскопическая форма и локализация рака ВЖП. Есть основания считать, что узловая и папиллярная формы рака обусловливают лучший прогноз, чем диффузно-инфильтрующая. Отчасти это связано с достаточно четко определяемыми границами опухоли, что при хирургическом удалении образования, как правило, позволяет выполнить резекцию протоков в их непораженной части. Кроме того, при папиллярной макроскопической форме рака механическая желтуха может носить перемежающийся характер, что связано с распадом и изъязвлением опухоли. При диффузно-инфильтративной форме рака вероятность радикальной операции ничтожна.
Деление опухолей ВЖП по локализации на две группы — опухоли проксимального отдела и опухоли дистального отдела — основано на существенных патолого-анатомических и клинических различиях между этими локализациями.
Выделение проксимального отдела ВЖП (правый и левый печеночный протоки, место их слияния, общий печеночный проток) и дистального отдела ВЖП (общий желчный проток) условно, поскольку носит не анатомический, а клинический характер. Ведь в ряде случаев пузырный проток сливается с общим печеночным протоком дистально, вблизи от БДС. Холедох в этих случаях имеет протяженность всего 1,5–3 см. Опухоли, расположенные в дистальной части общего печеночного протока, будут иметь клинико-патологические характеристики опухолей дистального отдела ВЖП.
Локализация рака в проксимальном отделе ВЖП — опухоль Клатскина (Klatskin G., 1965; Altmeier W.A., 1958) — характеризуется следующими признаками:
— во-первых, при узловой и папиллярной формах рака образование небольшого размера проявляется механической желтухой;
— во-вторых, относительно длительное время опухоль не метастазирует;
— в-третьих, обычна инвазия в проксимальном направлении, включая устья сегментарных желчных протоков обеих долей, основного ствола и ветвей воротной вены, паренхимы печени.
Важнейшими характеристиками опухоли Клатскина являются точная локализация и местная распространенность процесса, в связи с чем H. Bismuth (1985) выделил 4 типа таких опухолей:
I тип — опухоль локализуется в общем печеночном протоке и не распространяется на место слияния долевых печеночных протоков;
II тип — опухоль локализуется в общем печеночном протоке и распространяется на место слияния долевых протоков без инвазии протоков до уровня впадения ближайших внутридолевых протоков;
IIIA тип — опухоль распространяется по правому долевому протоку до слияния внутридолевых желчных протоков (правого латерального и правого парамедианного);
IIIB тип — опухоль распространяется по левому долевому протоку до впадения внутридолевых желчных протоков (чаще — протока 4-го сегмента печени);
IV тип — опухоль распространяется одновременно вправо и влево до слияния внутридолевых желчных протоков.
Указанная классификация H. Bismuth имеет важное клиническое значение, поскольку позволяет с высокой вероятностью прогнозировать возможность хирургического лечения и объем операции (см. раздел «Лечение») (Bismuth H. et al., 1985; Журавлев В.А., 1992).
Для локализации опухоли в дистальном отделе ВЖП (общий желчный проток) характерны ранняя местная инвазия окружающих проток органов и структур (соединительная ткань, периневральная инвазия, крупные сосуды, поджелудочная железа) и раннее лимфогенное метастазирование.
Основной путь лимфогенного метастазирования при этой локализации рака: регионарные лимфоузлы вокруг общего желчного протока, по верхнему краю головки поджелудочной железы (по ходу общей печеночной артерии), лимфоузлы задней панкреатодуоденальной группы. Далее поражаются юкстарегионарные лимфоузлы — чревные, мезентериальные и парааортальные. По данным ГУ РОНЦ им. Н.Н. Блохина РАМН, частота метастазов в регионарные лимфоузлы в момент операции составляет 80–100%, в юкстарегионарные — 50%, внеорганная ретроперитонеальная инвазия и инвазия в ПЖ наблюдаются у 100% больных.
Основные мишени гематогенного метастазирования: печень, брюшина, отдаленные группы лимфоузлов (лимфоузлы средостения, шеи, надключичных областей), легкие, яичники, почки, надпочечники.
Механическая желтуха при локализации рака в общем желчном протоке не является ранним признаком заболевания, при котором хирургическое удаление опухоли редко бывает радикальным. У незначительного количества больных раком общего желчного протока (приблизительно 7%) до развития синдрома механической желтухи отмечаются дискомфорт, несильные боли в эпигастрии, снижение аппетита, тошнота, рвота. Болевой синдром, как и при раке головки поджелудочной железы, связан с внутрипанкреатической и билиарной гипертензией, ретроперитонеальной периневральной инвазией. Синдром механической желтухи является ведущим в клинике заболевания, развивается у 97% больных. Механическая желтуха носит стойкий нарастающий характер. Словом, патологическая анатомия и клиническое течение рака общего желчного протока чрезвычайно схожи с патологической анатомией и клиническим течением протокового рака головки ПЖ.
Ведущим, а в ряде случаев — первым, симптомокомплексом заболевания является механическая желтуха, которая развивается при нарушении поступления желчи в 12ПК. Сопровождается синдромом эндотоксемии, печеночно-почечной недостаточностью, угнетением свертывающей системы крови, снижением иммунобиологического статуса больного, нарушением пищеварения и обмена веществ, инфекционным воспалением желчных протоков.
Клинико-лабораторная картина синдрома механической желтухи известна: кожные покровы, слизистые оболочки, склеры глаз окрашены в темно-желтый цвет, темная моча (цвета “пива”), светлый кал. На коже видны следы расчесов — частота и интенсивность кожного зуда максимальны именно при холестазе опухолевого происхождения. Больные жалуются на постоянные, тупые, как правило, неинтенсивные боли в эпигастрии, отмечается гепатомегалия, менее, чем у половины больных раком ВЖП, осложненным механической желтухой, пальпируется увеличенный желчный пузырь (симптом Курвуазье). В моче появляется билирубин, перестает определяться уробилиноген. В биохимическом анализе крови — повышенная концентрация билирубина, преимущественно за счет коньюгированной фракции (прямой билирубин), повышена активность ЩФ (за счет печеночной фракции) и гамма-ГТ, увеличивается концентрация желчных кислот и общего холестерина.
Синдром механической желтухи, обусловленный опухолями ВЖП, чаще всего не является начальным проявлением болезни. Но его появление сразу становится ведущим звеном патогенеза, который неумолимо приведет больного к смерти в течение 3–4 ближайших месяцев. Смерть наступает от прогрессирующей печеночно-почечной недостаточности и холемических кровотечений. Больные, как правило, не успевают дожить до развития билиарного цирроза печени.
Клинико-анатомическая классификация рака ВЖП по TNM (5 редакция, 1997)
Критерий Т
T1 — инвазия слизисто-мышечных слоев стенки протока;
T1a — инвазия до подслизистого слоя;
T1b — инвазия мышечно-соединительнотканного слоя;
T2 — опухоль распространяется на околомышечную соединительную ткань;
T3 — опухоль распространяется на соседние структуры (ПЖ, 12ПК, печень, сосуды).
Критерий N
N1 — метастазы в лимфоузлы, прилежащие к холедоху;
N2 — метастазы в лимфоузлы вокруг головки ПЖ и брыжеечных сосудов.
Группировка по стадиям приведена в таблице 7.
Таблица 7
Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия III | T1-2 | N1-2 | M0 |
| Стадия IVA | T3 | N0-2 | M0 |
| Стадия IVB | T1-3 | N0-2 | M1 |
Рак БДС
Микроскопически рак БДС представлен различными типами аденокарциномы. В участках эндофитного роста выявляются структуры менее дифференцированной аденокарциномы. Дифференцированная аденокарцинома более часто представлена в зонах экзофитного роста опухоли.
Рак БДС обычно имеет экзофитную форму роста, легко кровоточит при инструментальной пальпации. Желтуха часто носит ремиттирующий характер из-за распада опухоли и уменьшения воспалительного отека. Развивается у 90–100% больных. Более редкие эндофитные формы рака БДС обусловливают стойкую желтуху. Рак БДС обладает выраженным инфильтрирующим ростом — уже к моменту желтухи может быть инвазия стенки 12ПК, ПЖ, метастазы в регионарных, юкстарегионарных лимфоузлах и отдаленные метастазы. Пути лимфогенного метастазирования такие же, как при раке головки ПЖ. Перигастральные лимфоузлы бывают поражены у 4% больных. По данным ГУ РОНЦ им. Н.Н. Блохина РАМН, метастазы рака БДС в регионарные лимфоузлы (непосредственно прилежащие к головке ПЖ, особенно — задняя панкреатодуоденальная группа) в момент операции есть у 50–66% больных, юкстарегионарные (по верхнему и нижнему краю тела ПЖ, вокруг чревного ствола и верхней брыжеечной артерии, парааортальные) лимфоузлы поражены у каждого третьего больного.
Благодаря сравнительно раннему развитию синдрома механической желтухи и сравнительно неагрессивному течению, рак БДС чаще опухолей других локализаций является показанием к ГПДР.
Клинико-анатомическая классификация рака БДС по TNM (5 редакция, 1997)
Критерий Т
T1-опухоль в пределах БДС;
T2-инвазия 12ПК;
T3-инвазия опухоли в ПЖ не более 2 см;
T4-инвазия в ПЖ более 2 см или в другие органы.
Критерий N
N1-метастазы в регионарных лимфоузлах
Группировка по стадиям приведена в таблице 8.
Таблица 8
Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2-3 | N0 | M0 |
| Стадия III | T1-3 | N1 | M0 |
| Стадия IV | T4 | N0-1 | M0 |
| T1-4 | N0-1 | M1 |
Другие, кроме рака, злокачественные опухоли ВЖП представляют большую редкость.
Эмбриональная рабдомиосаркома внепеченочных желчных протоков
Редчайшая неэпителиальная опухоль, встречающаяся у детей в возрасте от 1 года до 11 лет. В литературе опухоль описывается в виде образования, напоминающего гроздь винограда. Основным проявлением опухоли является механическая желтуха.
Меланома ВЖП
Диагноз и гистогенез опухоли вызывают сомнения. Гистологически структура опухоли неоднородна. В одних участках имеются крупные светлые клетки, напоминающие клетки рака, в других участках — очаги невусоподобных клеток. Клетки опухоли с выраженными признаками атипии, часты митозы. Строма опухоли содержит кровеносные сосуды и имеет выраженную лимфогистиоцитарную инфильтрацию. Макроскопически описывается рыхлая опухоль желто-коричневого цвета, напоминающая гематому. В клиническом течении превалирует синдром механической желтухи.
Первичная лимфома ВЖП
Единичные наблюдения не позволяют сколько-нибудь убедительно характеризовать клинико-патолого-анатомические особенности опухоли (Блохин Н.Н. с соавт., 1982; Пономарев А.А. с соавт., 2000).
Диагностика злокачественных опухолей ВЖП и БДС
Почти у всех больных раком ВЖП и БДС поводом для обследования является механическая желтуха. Данные клинического осмотра и биохимического анализа крови позволяют диагностировать холестатическую желтуху. В ряде случаев возможно определить опухолевую природу и приблизительный уровень опухолевого стеноза ВЖП (см. раздел “Патологическая анатомия, особенности клинического течения рака ВЖП и БДС”).
Среди многочисленных иммунохимических маркеров при раке ВЖП и БДС практическое значение имеет только СА 19–9. Величины СА 19–9 коррелируют с распространением опухоли: более высокая концентрация маркера у лиц с распространенным раком ПЖ, желчного пузыря и ВЖП и БДС. Отмечена зависимость от степени дифференцировки опухоли — высокодифференцированным опухолям соответствуют бóльшие значения СА 19–9. Специфичность маркера ограничена из-за повышенных показателей (более 40 Е/л) у 90% больных острым холангитом, у 40% больных острым панкреатитом, у 10% больных хроническим рецидивирующим панкреатитом. Данный онкомаркер выводится исключительно с желчью, поэтому даже незначительный холестаз может быть причиной повышения уровня СА 19–9 в крови. Это обязывает выполнять иммунохимическое исследование крови на СА 19–9 после купирования механической желтухи. Повышение концентрации маркера отмечается при раке других локализаций: желудка, толстой кишки, гепатоцеллюлярном и холангиоцеллюлярном (Белохвостов А.С. с соавт., 2002).
Вначале инструментальная диагностика призвана обнаружить расширение желчных протоков проксимальнее опухолевого стеноза, т.е. подтвердить механический характер желтухи, затем дифференцировать внутри- или внепеченочный холестаз.
Далее решается комплекс диагностических задач, связанных с опухолью:
- Природа опухоли (доброкачественная или злокачественная).
- Характер опухоли (первичная или метастазы в лимфоузлы).
- Распространенность на прилежащие органы и структуры (головка ПЖ, 12ПК, печень, воротная вена и ее ветви, ветви печеночной артерии).
- Отдаленные метастазы (печень, брюшина).
- Наличие асцита.
Методы диагностики и визуализации
Обычно применяется УЗИ. Кроме УЗИ используются РКТ, МРТ, АГ, ЧЧХГ, ЭРХПГ, дуоденоскопия, ПБ.
УЗИ
Ультразвуковая диагностика степени расширения желчных протоков основана на градации Laing F.C., Jeffrey R.B.-Jr. (1983):
— внутренний диаметр общего печеночного и общего желчного протока до 5 мм — норма,
— возможное расширение — 6–7 мм;
— расширение 8 мм и более — патологическое расширение.
Диаметр правого и левого печеночных протоков не должен превышать в норме 3 мм. Сегментарные протоки печени в норме не визуализируются, их диаметр не должен превышать 1 мм. Основным ультразвуковым признаком желчной гипертензии является выявление расширенных желчных протоков, расположенных параллельно ветвям воротной вены — эхографический симптом двойных каналов (Sample W.F. et al., 1978). При длительной желтухе (больше 2 нед), чаще визуализируются протоки в виде звездчатых структур (это происходит в силу извитости протоков и утолщения их стенок).
Shim Chan-Sup (1995) предложил удобную схему эхографической диагностики уровней окклюзии билиарного тракта:
- 1 уровень — окклюзия внутрипеченочных протоков (расширение протоков внутри печени, разница в калибре желчных протоков правой и левой долей).
- 2а уровень — окклюзия печеночных протоков в области их конфлюенса (разница в калибре протоков правой и левой долей отсутствует или выражена слабо).
- 2b уровень — окклюзия общего печеночного протока (определяются расширенные правый и левый печеночные протоки, желчный пузырь спавшийся).
- 3а уровень — окклюзия общего желчного протока (увеличение желчного пузыря, проксимального отдела ВЖП, протоков внутри печени, главный панкреатический проток не расширен).
- 3b уровень — окклюзия дистальной части общего желчного протока (расширение внутри- и внепеченочных желчных протоков, желчного пузыря, расширение главного панкреатического протока).
К сожалению, визуализировать саму опухоль ВЖП, в силу ее изоэхогенности с окружающими структурами, часто бывает невозможно. Дополнительные методики УЗИ — цветовой калорайзинг, ЦДК — позволяют дифференцировать узловую форму рака ВЖП, ориентировочно судить о связи опухоли с прилежащими крупными сосудами, печенью, головкой ПЖ. При локализации опухоли в дистальном отделе ВЖП отмечается расширение, помимо внутрипеченочных, проксимального отдела ВЖП, желчного пузыря. В диагностике рака ВЖП ультразвуковой метод часто опирается не на прямую визуализацию опухоли, а на косвенные признаки: расширение желчных протоков проксимальнее уровня стеноза, расширение желчного пузыря, отсутствие данных, указывающих на наличие конкрементов в желчных протоках как возможной причины механической желтухи. Для дифференцировки протоков от сосудов прибегают к ЦДК (Пономарев А.А. и др., 2000; Шотемор Ш.Ш. и др., 2001).
РКТ
РКТ практически ничего не добавляет к квалифицированно проведенному УЗИ. РКТ позволяет дифференцировать внутри- и внепеченочный холестаз, определить место опухолевого стеноза протоков. Учет денситометрических показателей позволяет достаточно точно дифференцировать расширенные желчные протоки, сосуды, просвет 12ПК, увеличенные панкреатодуоденальные лимфоузлы. Судить об инвазии опухолью Клатскина печени возможно на основании различающихся денситометрических характеристик опухоли (32,5±4,2 ед.H) и паренхимы печени (51,2±1,9 ед.Н). При внутривенном болюсном контрастировании опухоль становится более отличимой в силу сохранения гиперконтрастности в отсроченную фазу, а расширенные протоки печени и внутрипанкреатическая часть холедоха достаточно хорошо определяемы. Весьма сложна дифференциальная диагностика первичных опухолей ВЖП и метастазов в ворота печени. Определяемые при РКТ-сканировании резкий обрыв протока и его деформация в большей степени соответствует первичной злокачественной опухоли протока. При интерпретации данных РКТ, как впрочем и данных других исследований, необходимо учитывать анамнез, особенности клинического течения заболевания, лабораторные показатели.
РКТ-холангиография — метод, обеспечивающий изображение (на базе спиральной РКТ) всего контрастированного билиарного дерева, позволяет подтвердить билиарную обструкцию. Информативность РКТ-холангиографии в определении уровня стеноза протоков и природы билиарной обструкции выше, чем непрямой холангиографии, но существенно ниже, чем ЧЧХГ (Кармазановский Г.Г. и др., 1997; Шотемор Ш.Ш. и др., 2001).
МРТ в диагностике опухолей ВЖП и БДС
Заслуживает внимания бесконтрастная магнитно-резонансная холангиопанкреатография, обеспечивающая хорошее изображение билиарного дерева. Метод позволяет точно установить уровень обструкции протоков, а вместе с МРТ — выявить образование, обусловившее холестаз. Информативность метода в установлении природы обструкции протоков высока и конкурирует с методами прямого контрастирования билиарного дерева (ЧЧХГ и ЭРХПГ). МРТ лучше, чем РКТ, отображает элементы гепатодуоденальной связки и инвазию воротной вены. Если учесть относительно высокую информативность МРТ в оценке местной распространенности опухоли, то МРТ вместе с бесконтрастной магнитно-резонансной холангиопанкреатографией можно считать всеобъемлющим методом визуализации второй, после УЗИ, очереди (Шотемор Ш.Ш. с соавт., 2001).
Методы прямого контрастирования билиарного дерева
При наличии механической желтухи, обусловленной опухолью ВЖП, и при отсутствии множественных метастазов в обеих долях печени, разобщающих сегментарные желчные протоки печени, показана прямая холангиография: ЧЧХГ и эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ).
ЧЧХГ сопровождает выполнение ЧЧХС. Осуществляется из трех доступов — переднего, бокового, заднего.
Предпочтение отдается боковому доступу (пункция в VIII, IX, X межреберьях по средней подмышечной линии справа), так как обеспечивает возможность выполнения последующих рентгеноэндобилиарных вмешательств без изменения положения тела больного, возможность пунктировать протоки правой и левой долей печени, достаточную длину пункционного канала и тем самым предотвращает желчеистечение. Больной находится в удобном положении, позволяющем, в случае необходимости, осуществить наркоз и реанимационные мероприятия.
Техника пункции и катетеризации внутрипеченочных желчных протоков разработана в деталях, вероятность осложнений сведена к минимуму.
Чрескожная холангиостомия может осуществляться под ультразвуковым контролем.
Достоверным признаком желчной гипертензии является выявление расширения внутри- и внепеченочных желчных протоков. Расширение просвета внепеченочных протоков при желчной гипертензии может быть умеренным (до 1,5 см), выраженным (до 2–2,5 см) и резким (до 3–4 см).
ЧЧХГ — самый информативный метод диагностики уровня блока билиарного дерева. Диагностическая точность близка к 100%.
Причины крайне редких ошибок у больных с опухолевой окклюзией билиарного дерева:
1) нетугое заполнение билиарного дерева,
2) плохое перемешивание контрастного средства и желчи,
3) наличие гнойных масс, детрита в протоках,
4) наличие воспалительного отека стенок желчных протоков.
В характеристике проксимальной границы окклюзии желчных протоков при ЧЧХГ отражаются уровень окклюзии относительно позвонков, конфлюэнса печеночных протоков и устья пузырного протока, форма и протяженность культи протока, характер блока (полный или неполный), протяженность опухолевого канала при неполном блоке.
При полном опухолевом блоке ЧЧХГ не позволяет судить об уровне и характере дистальной границы окклюзии.
Наиболее частая форма культи ВЖП при различной локализации опухоли:
— рак проксимального отдела ВЖП — полный блок, в ряде случаев распространяющийся на долевые протоки, с цилиндрической формой культи;
— метастазы в лимфоузлы ворот печени — полный блок конической формы без распространения на долевые протоки;
— рак общего желчного протока — чаще полный блок на уровне LII с различной формой культи протока;
— рак БДС — блок на уровне LIII с культей конической формы и нечеткими контурами.
Уровень блока ВЖП при раке БДС определяется локализацией БДС в 12ПК:
— в средней трети 12ПК — 90%,
— в дистальной трети — 6%,
— в проксимальной трети — 4% случаев (Нидерле Б., 1982).
Точность ЧЧХГ в определении природы (доброкачественная или злокачественная) и характера (первичное опухолевое поражение протока) блока ВЖП при раке ВЖП — 95,6%, при раке БДС — 97,4% (Ившин В.Г. с соавт., 2000).
ЭРХПГ
Процедура может быть использована при раке ВЖП для определения дистальной границы стеноза протоков, природы и характера стеноза протоков. ЭРХПГ предшествует транспапиллярному дренированию и эндопротезированию ВЖП. При раке ВЖП рентгенологически определяется участок неравномерного сужения протока большей или меньшей протяженности. При полной окклюзии протоков ЭРХПГ не позволяет судить о протяженности опухоли и проксимальной границе. Метод высокоинформативен в установлении опухолевой природы изменений в ВЖП. В ряде случаев для катетеризации и полноценного контрастирования ВЖП осуществляется ЭПСТ. При этом диагностическая ценность метода увеличивается. При раке БДС необходимость в ЭРХПГ возникает, если планируется ретроградное транспапиллярное дренирование и протезирование ВЖП (см. раздел «Методы купирования механической желтухи у больных раком ВЖП и БДС»). Данных дуоденоскопии бывает достаточно, чтобы диагностировать рак БДС и осуществить биопсию опухоли.
Необходимость осуществления ЧЧХГ и ЭРХПГ у одного больного практически никогда не возникает, поскольку для выработки лечебной тактики необходима точная информация о распространении опухоли в проксимальном направлении на протоки правой и левой доли печени (см. классификацию Bismuth H.). Эту информацию получают с помощью ЧЧХГ. Данные о распространении опухоли на ПЖ и 12ПК получают с помощью дуоденоскопии, рентгенографии 12ПК, УЗИ, РКТ, МРТ и при интраоперационной ревизии.
АГ
Прямое контрастирование артерий чревного ствола, возвратная спленопортография или мезентерикопортография — необходимые исследования при раке как проксимального, так и дистального отделов ВЖП, поскольку позволяют определить состояние печеночных артерий, воротной вены и ее ветвей. Рентгенологическое исследование сосудов с их прямым контрастированием пока не может быть заменено оценкой денситометрических показателей при РКТ или оценкой интенсивности сигнала при МРТ, т.е. АГ — важнейший метод оценки резектабельности опухоли. Кроме того, при планируемом хирургическом вмешательстве весьма уместно знание особенностей сосудистой анатомии рассматриваемых областей. Последнее соображение является поводом к проведению АГ при раке БДС.
ПБ
ПБ занимает скромное место в диагностике рака ВЖП и БДС. Необходимость в ПБ возникает при подозрении на макроскопически узловой рак ВЖП, когда биопсия через холангиостому не подтверждает наличия опухоли. При диффузно-инфильтрующей форме рака ПБ не применяется. В последнем случае дооперационная морфологическая верификация диагноза может быть получена при биопсии, осуществленной через холангиостому.
Лабораторные анализы и УЗИ подтверждают внепеченочный холестаз и его опухолевую природу, уровень блока ВЖП; позволяют отвергнуть метастазы в печени и лимфоузлах ворот печени, асцит; помогают судить об инвазии опухолью ткани печени.
Далее осуществляются ЧЧХГ и холангиостомия. Если протоки анатомических половин печени разобщены, то чаще всего производится раздельное чрескожное чреспеченочное дренирование протоков правой и левой полупечени. В процессе купирования механической желтухи осуществляется биопсия опухоли через холангиостому.
В результате указанных исследований возможно классифицировать опухоль проксимального отдела ВЖП. Если диагностирован IV тип опухоли по классификации H. Bismuth (см. выше), осуществление МРТ, РКТ и АГ нецелесообразно. В будущем для мониторинга эффективности лечения желательно после купирования механической желтухи исследование крови на СА 19–9. Если диагностированы I, II, IIIA и IIIB типы опухоли Клатскина, уточняющие местную распространенность (инвазия печени, органов панкреатодуоденальной зоны, крупных сосудов) обследования необходимы и включают выполнение МРТ и АГ. Вместо МРТ может быть выполнена РКТ.
Последовательность диагностических мероприятий при опухоли общего желчного протока, осложненной механической желтухой, повторяет таковые при опухоли Клатскина. Допустимо вместо ЧЧХГ осуществлять ЭРХПГ и эндоскопическое транспапиллярное дренирование (эндопротезирование) ВЖП (см. раздел «Лечение»).
Представленный диагностический алгоритм опирается на УЗИ и биопсию опухоли во время дуоденоскопии (практически все вопросы, связанные с морфологическим подтверждением опухоли, ее местной распространенностью, решены).
Далее осуществляется холангиография тем или иным методом.
Наконец, АГ уточняет сосудистую анатомию панкреатодуоденальной области.
РКТ и МРТ при раке БДС не несут дополнительной к УЗИ информации.
После купирования механической желтухи целесообразно определение в крови СА 19–9.
Естественно, все диагностические мероприятия при подозрении на опухоль ВЖП и БДС требуют выполнения рентгенографии легких, оценки функционального статуса органов больного. Это особенно важно, если планируется хирургическое лечение.
Методы купирования механической желтухи у больных раком ВЖП и БДС
Опухоли головки ПЖ осложняются механической желтухой в 47–92% случаев, опухоли ВЖП и БДС — в 90–100%, опухоли парапапиллярной области 12ПК — в 50% случаев.
Подавляющее большинство больных билиопанкреатодуоденальным раком, осложненным внепеченочным холестазом, нуждаются в билиарной декомпрессии.
Желчеотведение по поводу механической желтухи не показано при опухолевом поражении обеих долей печени с разобщением сегментарных протоков в обеих долях печени.
При непродолжительной механической желтухе и невысоких цифрах общего билирубина, при отсутствии признаков нерезектабельности опухоли билиопанкреатодуоденальной области и общем удовлетворительном состоянии больного допустимо оперировать в полном объеме без предварительного желчеотведения. При этом называется разный пороговый уровень общего билирубина, который достоверно повышает вероятность осложнений в послеоперационном периоде, если радикальная операция, например ГПДР, выполняется без предварительной билиарной декомпрессии. Самый высокий из них — 170 мкмоль/л (Armstrong C.P. et al., 1984; Greig J.D. et al., 1988).
Желчеотведение показано как первый этап лечения для больных с резектабельными опухолями органов билиопанкреатодуоденальной области, осложненными механической желтухой; для больных с нерезектабельными опухолями органов билиопанкреатодуоденальной области, но при отсутствии внутрипеченочных метастазов, разобщающих сегментарные желчные протоки в обеих долях печени.
Современные методы желчеотведения включают:
1. Чрескожные чреспеченочные.
2. Эндоскопические транспапиллярные.
3. Хирургические и эндохирургические.
1. Чрескожные чреспеченочные методы желчеотведения
Методы билиарной декомпрессии этой группы основаны на применении ЧЧХС, которая осуществляется по методике Сельдингера (или ее модификациям) и сопровождается антеградной холангиографией. ЧЧХС может обеспечить наружное или наружно-внутреннее дренирование желчи.
Наружно-внутреннее дренирование желчи может быть выполнено одноэтапно с ЧЧХС (Каримов Ш.И., 1996; Smith A.C. et al., 1994), а может быть осуществлено 7–10 дней после ЧЧХС (Ившин В.Г., 1996). При этом нормализация клинико-биохимических показателей больного происходит быстрее (в течение 3–4 нед), чем при наружном желчеотведении, легче осуществляется коррекция волемических нарушений и метаболического состояния больного. Наружно-внутреннее дренирование позволяет осуществить внутрипротоковое лучевое лечение и эндопротезирование стенозированных протоков в случае неоперабельности опухолевого процесса. Правда, при наружно-внутреннем желчеотведении существенно возрастает риск развития рефлюкс-холангита, в позднем периоде он встречается у 28% больных (Watanapa P. et al., 1992). При наружном неуправляемом желчеотведении в течение первой недели может усугубиться печеночно-почечная недостаточность: усугубляется гипопротеинемия, повышается активность АСТ и АЛТ, снижается диурез, в крови увеличивается концентрация креатинина и мочевины. Этот синдром “быстрой декомпрессии” билиарного дерева обусловлен грубыми изменениями внутрипеченочной портальной гемодинамики, когда в печени резко снижаются объемный и линейный портальный кровоток. Ившин В.Г. с соавт. (1996) рекомендуют выполнять дозированную билиарную декомпрессию в течение 4–28 ч с одномоментными перепадами давления в билиарном тракте не более 10 мм водн. столба. После снижения давления в протоках до 160 мм водн. столба необходимо удерживать его на таком уровне еще сутки. Дозированная декомпрессия билиарного тракта осуществляется путем регулирования просвета катетера.
К сожалению, ЧЧХС все еще сопровождается осложнениями, в том числе летальными. Это:
— миграция катетера,
— желчеистечение в брюшную полость и желчный перитонит,
— кровотечение в брюшную полость,
— гемобилия,
— холангит,
— холангиоплевральный свищ,
— парахолангиостомический абсцесс,
— печеночно-почечная недостаточность.
Осложнения развиваются у 10–50% больных, летальность составляет 2,4–16,6% (Ившин В.Г. и др., 1996; Каримов Ш.И., 1996; Данилов М.В. и др., 1997; Капранов С.А. и др., 1997; Шкроб О.С. и др., 1998).
В ГУ РОНЦ им. Н.Н. Блохина РАМН ЧЧХС является наиболее часто выполняемым методом желчеотведения. К настоящему времени выполнено более 400 ЧЧХС. Осложнения развились у 16% пациентов, умерли от осложнений 2,4% больных. Наиболее частые осложнения, связанные непосредственно с ЧЧХС:
— миграция стомы — у 7,6% больных,
— окклюзия холангиостомы — у 11,5% пациентов,
— кровотечение (гемобилия, внутрибрюшное кровотечение) — у 4,9% больных,
— желчеистечение в брюшную полость — у 4,9% больных.
Наиболее опасными осложнениями, которые и обусловливают летальность после ЧЧХС, являются внутрибрюшное кровотечение и печеночно-почечная недостаточность.
При опухолевой обструкции слияния печеночных протоков с разобщением билиарного дерева выполняется раздельное чрескожное чреспеченочное дренирование правой и левой долей печени (Шкроб О.С. и др., 1998).
В случае неоперабельности опухоли после установления наружно-внутреннего дренажа возможно выполнить эндопротезирование желчных протоков, формирование компрессионного магнитного билиодигестивного анастомоза, левостороннюю гепатикогастростомию.
В качестве эндопротезов используются синтетические (полиэтиленовые) протезы с неизменяемой конфигурацией, металлические спиральные протезы с неизменяемой конфигурацией, металлические расширяющиеся (с “памятью формы”) эндопротезы (Wall-stent, нитиноловые протезы, PALMAZ-stent, Gianturco-stent).
Клиническая оценка эндопротезов неоднозначна. Большинство авторов положительно характеризуют металлические эндопротезы с “памятью формы”, мотивируя лучшими результатами такого эндопротезирования (меньше частота рецидивов желтухи, не происходит миграция эндопротеза) (Davids P.H.P. et al., 1992; Smith A.C. et al., 1994; Капранов С.А. и др., 1997). Другие исследователи не находят существенной разницы или отдают предпочтение пластмассовым эндопротезам, указывая на то, что срок функционирования тех и других одинаковый, а стоимость пластмассовых существенно ниже.
Заслуживает внимания такая методика эндопротезирования. Катетер диаметром 12F проводится дистальнее окклюзии, наружный конец срезается и герметизируется на уровне кожи, погружается в подкожную клетчатку, рана кожи ушивается. Достоинства такого эндопротезирования: исключается смещение и полное выпадение катетера, при окклюзии стента его легко заменить (Ившин В.Г. и др., 1996).
Формирование рентгенэндоскопического компрессионного магнитного билиодигестивного анастомоза применяется при дистальном опухолевом стенозе и основано на имплантации магнитных элементов через холангиостому в ВЖП проксимальнее опухолевой обструкции и эндоскопически перорально в 12ПК (желудок, тощую кишку) дистальнее опухолевой обструкции. При этом желчеотведение до образования соустья между протоками и 12ПК в месте сопоставления магнитов (обычно происходит на 8–9 день после их имплантации) осуществляется наружу по чрескожной гепатикохолангиостоме. Формирование компрессионного магнитного билиодигестивного анастомоза невозможно, если 12ПК не подлежит пероральной эндоскопии (дистальная резекция желудка по Бильрот-II в анамнезе, грубая опухолевая или рубцовая деформация 12ПК). Операция (без учета осложнений после ЧЧХС) в целом легко переносится большинством больных. Чаще отмечаются поздние осложнения, включающие рецидив желтухи — у 18,8% больных, непроходимость 12ПК — у 12,5% больных, рефлюкс-холангит — у 14,3% больных (Авалиани М.В. и др., 1998).
Левосторонняя гепатикогастростомия
Рентгенэндобилиарная и эндоскопическая операция осуществляется при неоперабельных опухолях проксимального отдела ВЖП или метастазах в лимфоузлы ворот печени, осложненных механической желтухой.
I этап. Под контролем рентгенотелевидения через правый чреспеченочный доступ мультиперфорированный катетер устанавливается справа налево через слияние долевых протоков — во 2-й или, предпочтительнее, в 3-й сегментарный проток.
II этап, через 9–10 дней. Под общим наркозом и лапароскопическим контролем гибкой иглой, проведенной через дренированные протоки, перфорируются висцеральная поверхность печени и желудок. Катетер из печени проводится в желудок. С помощью гастроскопа к катетеру фиксируется дренаж (например, педиатрическая гастростомическая трубка), который проводится из полости желудка в печень. С помощью перекрестной пластинки на дренаже, плотно примыкающей к слизистой желудка, и фибринового клея, наносимого на серозу желудка и капсулу печени, желудок плотно фиксируется к печени. Операция завершена.
Разработана методика подобной операции без лапароскопии. Вторым этапом (через 10–14 дней) транспеченочный мультиперфорированный дренаж может быть заменен на металлический эндопротез.
Ранняя летальность не превышает 10%. Причины смерти: внутрибрюшное кровотечение, холангит, осложненный сепсисом, инфаркт миокарда.
Другие (нефатальные) осложнения раннего периода: холангит — у 11% больных, эмпиема плевры — у 2,9% пациентов.
Поздние осложнения: рецидив желтухи — у 17% больных (всегда связан с прогрессированием опухолевого заболевания), холангит — у 20%, гастрит — у 8,6% больных (Soulez G. et al., 1997; Tipaldi L., 1995).
Наружная холецистостомия
Выполняется при дистальном опухолевом стенозе. Может осуществляться как ЛХС, так и ЧЧХС под контролем УЗИ. Осложнения развиваются у 20% больных. Летальность составляет 3%. Характер и частота осложнений: перфорация желчного пузыря — у 6,3%, миграция холецистостомы — у 4,7%, подкапсульная гематома печени — у 1,6%, внутрипузырное кровотечение с тампонадой желчного пузыря — у 4,7%, деструктивный холецистит — у 1,6%, желчный перитонит — у 4,7%, рецидив желтухи — у 3,1% больных.
При наружной холецистостомии не развивается синдром “быстрой декомпрессии” билиарного дерева.
Ограничения методики:
1) Больные плохо переносят лапароскопию из-за пневмоперитонеума.
2) Лапароскопия не всегда эффективна из-за рубцово-спаечного и воспалительного процесса в подпеченочной области.
3) Холецистостомия под контролем УЗИ в случае, если желчный пузырь прикрыт печенью на очень ограниченном участке, несет реальную угрозу желчеистечения в брюшную полость (Брискин Б.С. и др., 1996; Данилов М.В. и др., 1997; Шаповальянц С.Г. и др., 1997).
4) Наконец, желчеотведение через холецистостому существенно ограничено ввиду опухолевого стеноза устья пузырного протока или угрозы его развития в будущем.
Таким образом, чрескожные чреспеченочные методы билиарной декомпрессии при относительно удовлетворительной переносимости обеспечивают желчеотведение как при дистальном, так и при проксимальном опухолевом стенозе билиарного дерева (в т.ч. при метастазах в печени), что позволяет характеризовать ЧЧХС как наиболее универсальный метод желчеотведения.
2. Эндоскопические транспапиллярные методы желчеотведения
Эти методы стали широко использоваться в последнее десятилетие, во-первых, когда ЭРХПГ стала широко распространенной методикой обследования больных и, во-вторых, когда стало ясно, что ЧЧХС несет угрозу летальных осложнений.
Показание к применению эндоскопических транспапиллярных методов желчеотведения — опухолевая обструкция дистального отдела ВЖП, осложненная механической желтухой.
При невозможности визуально оценить БДС и значительном распространении опухоли на оба печеночных протока эндоскопическое транспапиллярное желчеотведение не показано.
Эндоскопическим транспапиллярным методам желчеотведения предшествует ЭРХПГ.
Далее могут быть применены: ЭПСТ, назобилиарное дренирование тонким катетером, ЭПСТ + эндопротезирование ВЖП вплоть до раздельного эндопротезирования печеночных желчных протоков.
ЭПСТ может оказаться эффективным самостоятельным методом желчеотведения только при опухоли БДС. Но риск осложнений, летальности и диссеминации опухоли при этом достаточно высок (Данилов М.В. и др., 1997), что не позволяет рекомендовать процедуру в качестве метода желчеотведения при раке БДС. Кроме того, ЭПСТ может обеспечить желчеотведение только на непродолжительное время.
Ранними осложнениями эндоскопического транспапиллярного дренирования являются кровотечение, острый холангит, острый панкреатит, перфорация 12ПК. Уровень ранних осложнений в настоящее время не превышает 8–10%.
Довольно часты поздние осложнения, такие как холангит, рецидив механической желтухи, вследствие окклюзии просвета эндопротеза.
Последнее осложнение развивается у 60% больных в сроки от 3 до 6 мес после эндопротезирования и требует замены эндопротеза. Большинство авторов указывает на “Wall-stent”, как наиболее предпочтительный с точки зрения профилактики рецидива желтухи эндопротез (Smith A.C. et al., 1994; Van den Bosch R.P. et al., 1994).
Учитывая хорошую переносимость эндоскопического ретроградного дренирования и эндопротезирования ВЖП, высокую частоту холангита и рецидивов желтухи в позднем периоде, эндоскопические транспапиллярные методы желчеотведения предпочтительны для неоперабельных больных с прогнозируемым временем жизни менее 6 мес и для операбельных пациентов, которым в ближайшие 3–4 нед планируется хирургическое удаление опухоли.
3. Хирургическое и эндохирургическое формирование билиодигестивных анастомозов
Эти подходы все еще не вытеснены из арсенала желчеотводящих методов, поскольку имеют ряд положительных особенностей, которых пока лишены первые две группы методов. Применяемые в настоящее время анастомозы для купирования механической желтухи опухолевого происхождения включают:
— холецистодуоденоанастомоз,
— холецистогастро- и холецистоеюноанастомоз,
— холедоходуодено- и холедохоеюноанастомоз,
— гепатикоеюноанастомоз.
Использование в соустье желчного пузыря должно быть ограничено, поскольку у 12–20% больных раком головки ПЖ, не говоря об опухоли ВЖП, осложненной механической желтухой, уже имеется стеноз или есть реальная угроза опухолевого стеноза устья пузырного протока. Использование в соустье 12ПК и желудка также существенно ограничено реальной угрозой опухолевого стеноза 12ПК. При раке головки ПЖ, приблизительно 17% больных, которым планируется желчеотводящая операция, показано формирование обходного гастроеюноанастомоза (Watanapa P. et al., 1992). Поэтому наиболее широкие показания имеет наложение гепатикоеюноанастомоза с профилактическим гастроеюноанастомозом (особенно, если не планируется радикальное удаление опухоли).
При этом в соустье с тощей кишкой могут участвовать как общий печеночный проток, так и печеночные протоки более мелкого калибра. Анастомоз лучше формировать с мобилизованной по Ру петлей тощей кишки. Это сводит до минимума риск рефлюкс-холангита.
Техника формирования анастомозов хорошо разработана отечественными хирургами: применяется однорядный узловой шов с узелками наружу без “захвата в шов” слизистых, т.е. внутристеночное проведение нити. Необходим рассасывающийся монофиламентный (например, Максон) или нерассасывающийся монофиламентный (Пролен) шовный материал 4/0–5/0 на атравматичной игле. По мнению проф. Лапкина К.В. (1998) — разработчика прецизионной хирургической техники — важнейшим принципом является, наряду с вышеуказанным, полное отсутствие натяжения линии формируемого шва (Кузовлев Н.Ф., 1996; Лапкин К.М., 1998). С онкологических позиций гепатикоеюноанастомоз предпочтительнее формировать впередиободочно. В настоящее время хирургическое формирование билиодигестивных анастомозов сопровождается уровнем осложнений не более 30%, летальностью 2,5–6%.
Формирование гепатикоеюноанастомоза при опухоли проксимального отдела ВЖП на высоте желтухи сопряжено с большей частотой осложнений (до 48%) и летальности (до 20%), что побудило отказаться от указанных анастомозов и применять ЧЧХС (Журавлев В.А., 1992).
Лапароскопическое формирование холецистоэнтеро- и межкишечного анастомозов осуществляется ручным или аппаратным швом. Наркоз, пневмоперитонеум и минилапаротомия — все это делает формирование указанного анастомоза мало отличным от обычно принятого (Емельянов С.И. и др., 1996).
Уровень поздних осложнений при хирургическом формировании билиодигестивных анастомозов (особенно гепатикоеюноанастомоза) минимален. Формирование гепатикоеюноанастомоза на мобилизованной по Ру петле тощей кишки практически исключает рецидив желтухи и холангит в позднем периоде. Указанный анастомоз предпочтителен для больных неоперабельным билиопанкреатодуоденальным раком, осложненным механической желтухой, с прогнозируемым временем жизни более 6 мес.
Таким образом, при выборе метода желчеотведения необходимо учитывать следующие факторы:
1. Уровень опухолевой обструкции билиарного дерева — проксимальный или дистальный.
2. Распространенность опухолевого поражения и состояние больного, т.е. планируется ли после билиарной декомпрессии удаление опухоли.
3. Прогнозируемое время жизни больного после желчеотведения, если радикальная операция не планируется.
4. Угрозу осложнений и степень технологического исполнения того или иного метода желчеотведения (Патютко Ю.И. с соавт., 2002).
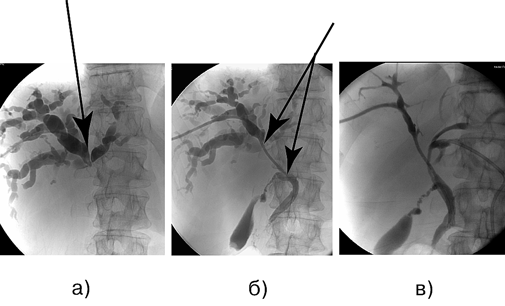
Рисунок 4. Больной К., 61 год. Аденокарцинома проксимального отдела внепечёночных желчных протоков (опухоль Клатскина), Bismuth — IV тип, состояние после раздельного чрескожного чреспеченочного дренирования протоков правой и левой доли печени:
а — ЧЧХС, наружное дренирование, холангиография, блок на уровне конфлюэнса желчных протоков; б — ЧЧХС, наружно-внутреннее дренирование, холангиография, блок на уровне конфлюэнса желчных протоков; в — ЧЧХС, раздельное наружно-внутреннее дренирование долевых протоков, холангиография, блок на уровне конфлюэнса желчных протоков
Описание проверено экспертом
Оцените статью:
- Рак желчевыводящих путей
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).



