C22.2 Гепатобластома, МКБ-10
Отредактировано: 16.07.2025
Гепатобластома
Определение
Гепатобластома (ГБ) – это злокачественная опухоль печени эмбрионального происхождения, развивающаяся из клеток предшественников гепатоцитов – гепатобластов [1]. ГБ является редкой опухолью, однако она представляет собой наиболее распространенное первичное злокачественное новообразование печени в детском возрасте, составляя до двух третей первичных опухолей печени у детей [2]. В 90% случаев ГБ диагностируется у детей младше пяти лет, пик заболеваемости приходится на возраст до двух лет. У взрослых ГБ встречается крайне редко [3].
Несмотря на низкую общую частоту встречаемости, в последние десятилетия отмечается рост заболеваемости ГБ во всем мире.
Этиология
Этиология и патогенез ГБ остаются недостаточно изученными. Известно, что в отличие от гепатоцеллюлярной карциномы (ГЦК), ГБ у детей и молодых взрослых, как правило, не ассоциирована с хроническими заболеваниями печени. Большинство случаев носят спорадический характер, однако описан ряд наследственных синдромов, ассоциированных с повышенным риском развития ГБ, включая [4]:
- синдром Беквита-Видемана,
- синдром Эдвардса (трисомия 18),
- синдром Дауна (трисомия 21),
- синдром Айкарди,
- синдром Ли-Фраумени,
- синдром Гольденхара,
- гликогеноз типа Ia (болезнь фон Гирке),
- семейный аденоматозный полипоз.
Для некоторых из этих состояний рекомендовано проведение скрининга на ГБ, включающего УЗИ брюшной полости и определение уровня альфа-фетопротеина (АФП) каждые 3 месяца до достижения возраста 6-8 лет (в зависимости от конкретного синдрома).
Курение родителей также рассматривается в качестве потенциального фактора риска развития ГБ у ребенка. В 2009 году Международное агентство по изучению рака включило ГБ в список опухолей, ассоциированных с курением табака [5].
Профессиональные вредные факторы, включая постоянный контакт родителей с тяжелыми металлами, нефтепродуктами и лакокрасочными материалами, рассматриваются как возможные факторы риска развития ГБ у ребенка.
К неонатальным факторам риска ГБ относятся следующие [6]:
- низкая масса тела при рождении (обнаружена обратная зависимость между массой тела и риском развития ГБ),
- длительная искусственная вентиляция легких (ИВЛ),
- продолжительная кислородотерапия,
- частое проведение диагностических рентгенологических исследований,
- прием фуросемида и фенобарбитала,
- воздействие фталатов (содержатся в медицинских изделиях).
Многие из перечисленных факторов связаны с низкой массой тела при рождении, что затрудняет определение их независимого влияния на риск развития ГБ. Гипотеза о потенциальной гепатоканцерогенной активности фталатов, используемых в медицинских изделиях, требует дальнейшего научного подтверждения.
Патогенез
Гепатобластома относится к эмбриональным опухолям, происходящим из клеток-предшественников гепатоцитов, сохраняющих способность к мультилинейной дифференцировке [7]. Опухоль демонстрирует сложный морфологический состав, включающий фетальные или эмбриональные гепатоциты, а также гетерологичные элементы (хрящевую и костную ткань, поперечнополосатые мышечные волокна, плоский эпителий). При патоморфологическом исследовании ГБ выявляется высокая экспрессия маркеров печеночных прогениторных клеток.
Редкие случаи сочетанного наличия ГБ и ГЦК (преимущественно у взрослых) позволяют предположить, что обе опухоли происходят из единого клеточного предшественника, находящегося на разных стадиях печеночного онтогенеза [8, 9].
Спорадические случаи ГБ тесно связаны с гиперактивацией сигнального пути WNT/β-катенин, что часто обусловлено соматическими мутациями в гене CTNNB1 (кодирующем β-катенин) [10]. Отмечалось, что для дифференцированных типов ГБ характерно накопление β-катенина в цитоплазматической мембране, в то время как недифференцированные агрессивные формы характеризуются локализацией β-катенина в ядрах клеток. Таким образом, ядерная экспрессия β-катенина может рассматриваться в качестве потенциального маркера неблагоприятного прогноза.
С агрессивным течением ГБ также может быть связана активация сигнальных путей TERT и MYC [1, 11].
Клиническая картина
У детей гепатобластома, как правило, не сопровождается специфическими клиническими проявлениями. Наиболее часто ГБ выявляется в виде бессимптомного объемного образования в печени, однако возможны и следующие клинические проявления [7]:
- боль в животе,
- тошнота,
- рвота,
- желтуха (редко),
- коагулопатия (редко),
- преждевременное половое развитие (из-за эктопической секреции бета-хорионического гонадотропина),
- остеопения и патологические переломы (из-за нарушения кальциевого обмена).
Преимущественная локализация опухоли в правой доле печени отмечается в большинстве случаев, однако патогенетические механизмы этого явления остаются не до конца изученными. Как правило, ГБ развивается в интактной печени без фоновых заболеваний.
Диагностика
Для постановки диагноза ГБ проводят сбор анамнеза, физикальное обследование пациента, а также лабораторные и инструментальные исследования. Гистологическое и иммуногистохимическое исследование ткани опухоли, полученной при биопсии, проводится для верификации диагноза.
Лабораторные исследования
При подозрении на ГБ рекомендуется выполнить общий и биохимический анализ крови, а также определить уровень онкомаркеров – альфа-фетопротеина (АФП) и бета-субъединицы хорионического гонадотропина человека (β-ХГЧ).
При проведении анализа могут выявляться следующие отклонения:
- Биохимические показатели функции печени обычно нормальные или незначительно повышены.
- В общем анализе крови часто выявляются анемия и тромбоцитоз.
- В редких случаях наблюдается эктопическая продукция гормонов (АКТГ, ПТГ-подобный белок), приводящая к электролитным нарушениям и гиперкальциемии.
- У большинства пациентов уровень АФП значительно повышен.
Уровень АФП менее 100 нг/мл* ассоциирован с более агрессивным течением заболевания и сниженной чувствительностью к химиотерапии.
Инструментальные обследования
Для инструментальной диагностики ГБ применяются:
- УЗИ органов брюшной полости и забрюшинного пространства;
- КТ и МРТ органов брюшной полости с внутривенным болюсным контрастированием с соблюдением всех фаз контрастирования;
- КТ органов грудной клетки для выявления возможных метастазов (исследование может выполняться без контрастного усиления).
Гистологическое и иммуногистохимическое исследование
Гистологическое и иммуногистохимическое исследование (ИГХ) является ключевым этапом диагностики, позволяющим подтвердить диагноз, определить гистологический подтип опухоли и уточнить прогноз.


Источник: López-Terrada D. et al. Towards an international pediatric liver tumor consensus classification: proceedings of the Los Angeles COG liver tumors symposium //Modern pathology. – 2014. – Т. 27. – №. 3. – С. 472-491.
Прогностически значимыми гистологическими подтипами являются [9, 12]:
- Высокодифференцированная фетальная ГБ (чисто фетальный тип с низкой митотической активностью – менее 2 митозов на 10 полей зрения) – благоприятный прогноз.
- Мелкоклеточный недифференцированный подтип – характеризуется агрессивным течением и часто ассоциирован с нормальным уровнем АФП. Характерна сохраненная экспрессия INI1.
Некоторые эксперты, включая Международную группу по оптимизации лечения опухолей печени (SIOPEL – Childhood Liver Tumors Strategy Group), допускают возможность установления диагноза ГБ без биопсии у детей младше 5 лет при наличии:
- объемного образования печени,
- повышенного уровня АФП,
- отсутствия хронических заболеваний печени.
Этот подход оправдан в случаях, когда проведение биопсии сопряжено с высоким риском осложнений. Однако гистологическая верификация предпочтительна, поскольку позволяет исключить другие опухоли из дифференциального ряда.
Своевременная диагностика имеет решающее значение для прогноза и определения дальнейшей тактики лечения. У пациентов с локализованной формой ГБ около двух третей опухолей являются нерезектабельными на момент постановки диагноза. При этом у 20% больных на момент постановки диагноза уже имеются отдаленные метастазы, чаще всего в легкие. Поражение лимфатических узлов встречается редко.
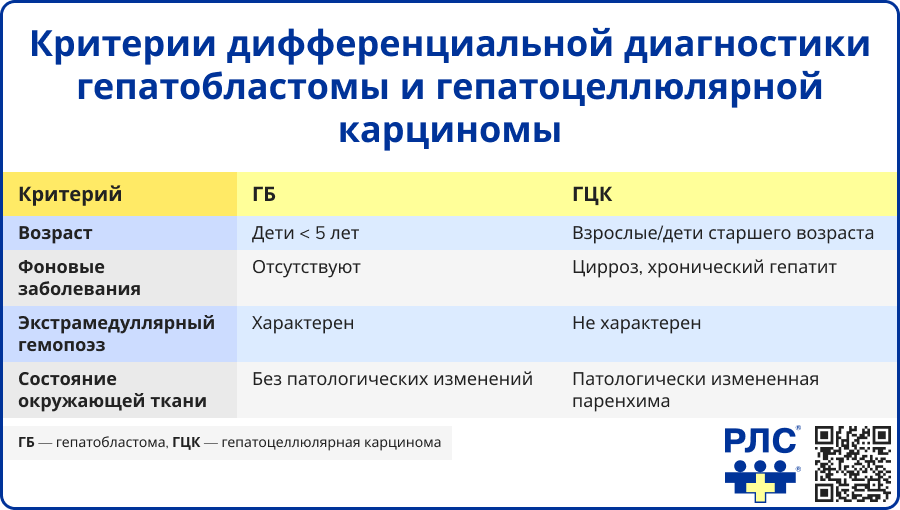
Дифференциальная диагностика
Даже при выполнении биопсии диагностика ГБ может быть затруднена ввиду морфологического сходства с другими опухолями печени. Ключевые заболевания, требующие дифференциальной диагностики с ГБ, включают [9, 13, 14]:
- ГЦК,
- рабдоидную опухоль печени,
- недифференцированную эмбриональную саркому печени,
- оссифицирующую стромально-эпителиальную опухоль,
- переходные печеночноклеточные опухоли,
- тератомы (при наличии рабдомиобластической дифференцировки).
Наиболее затруднительной является дифференциальная диагностика между ГБ и ГЦК из-за их гистологических и макроскопических сходств, а также часто малой информативности результатов ИГХ исследования.
Стадирование и стратификация на группы риска
После проведения инструментальных исследований обязательным компонентом диагностики является стадирование по системе PRETEXT (Pretreatment Extent of Disease) [9, 15].
Эта система разработана на основе анализа международной базы данных CHIC (Children's Hepatic tumors International Collaboration), включающей сведения о более чем 1600 пациентах из 8 многоцентровых исследований за 25 лет.

Дополнительные оцениваемые факторы:
- V – вовлечение печеночных вен или нижней полой вены;
- P – вовлечение воротной вены;
- E – экстрапеченочное распространение;
- M – отдаленные метастазы;
- C – поражение хвостатой доли;
- F – мультифокальные опухолевые узлы;
- R – разрыв опухоли до диагностики.
Для пациентов с изначально нерезектабельными опухолями после неоадъювантной химиотерапии проводится повторная визуализация (POST-TEXT). Критерии оценки при POST-TEXT соответствуют системе PRETEXT.

Неблагоприятными прогностическими признаками являются:
- высокая стадия PRETEXT,
- сосудистая инвазия (V/P),
- экстрапеченочное распространение (E),
- мультифокальность (F),
- разрыв опухоли (R),
- возраст ≥8 лет,
- низкий уровень АФП (<100 нг/мл),
- метастатическое заболевание.
Современная стратификация пациентов на группы риска при ГБ согласно стратегии группы SIOPEL основана на данных PRETEXT и клинико-морфологических характеристиках опухоли [16, 17]:
- Группа стандартного риска включает пациентов с локализованными опухолями (PRETEXT I-III) без признаков сосудистой инвазии (V3/P2), экстрапеченочного распространения, разрыва опухоли, отдаленных метастазов, а также при возрасте ≤8 лет (за исключением PRETEXT I).
- Группа высокого риска представлена пациентами с локализованными формами заболевания, не попадающими под критерии стандартного риска, но также не имеющими признаков крайне неблагоприятного прогноза. Как правило, это PRETEXT II-IV с вовлечением сосудов.
- Группа очень высокого риска характеризуется наличием хотя бы одного из следующих факторов:
- отдаленные метастазы (преимущественно в легкие – один очаг ≥5 мм или два и более очага ≥3 мм),
- спонтанный разрыв опухоли,
- возраст старше 8 лет в сочетании с PRETEXT II-IV.
Лечение
В последние годы достигнуто улучшение показателей выживаемости при ГБ, что обусловлено следующими факторами:
- совершенствованием химиотерапевтических протоколов,
- развитием хирургических техник,
- внедрением трансплантации печени при нерезектабельных опухолях.
Основные принципы терапии включают:
- Междисциплинарный подход
- На дооперационном этапе обязательна оценка состояния пациента детским онкологом, хирургом и анестезиологом;
- Для стратификации риска и планирования терапии необходимо проведение мультидисциплинарного консилиума;
- Пациентов с PRETEXT III-IV направляют в трансплантационный центр не позднее одного месяца с момента начала терапии.
- Комбинированный подход
- Основу составляет сочетание хирургического лечения и химиотерапии.
- Конечной целью лечения является полное удаление опухоли.
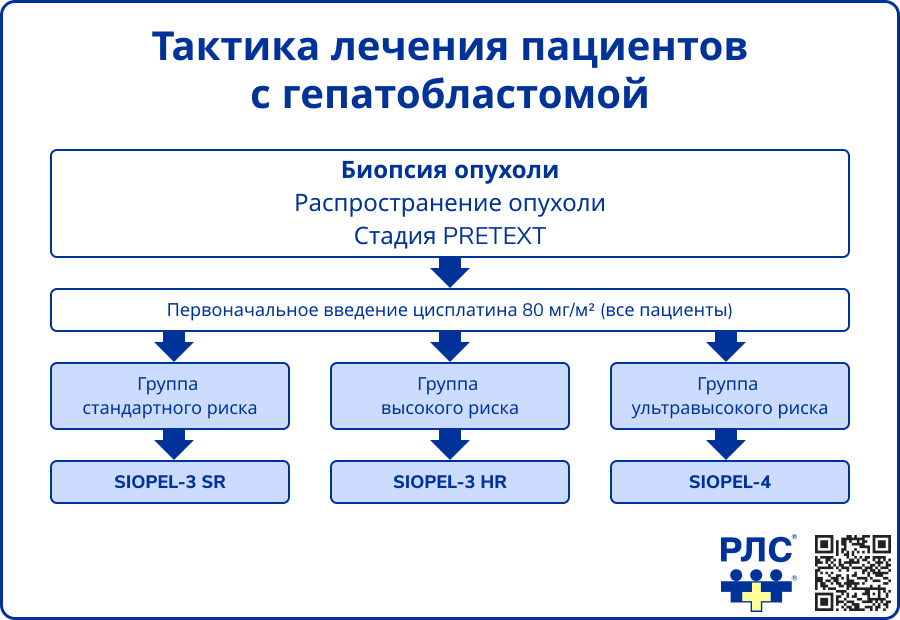
Всем пациентам детского возраста (от рождения до достижения 18 лет) с диагнозом ГБ рекомендуется выбор риск-адаптированной терапии [16].
Медикаментозное лечение
Лечение гепатобластомы по протоколам группы SIOPEL зависит от категории риска и включает сочетание неоадъювантной и адъювантной химиотерапии с последующим хирургическим вмешательством.
У пациентов группы стандартного риска применяется схема SIOPEL-3 SR, предусматривающая 6 курсов химиотерапии: четыре неоадъювантных до операции и два адъювантных после резекции опухоли.
- В качестве основного препарата в неоадъювантной терапии используется цисплатин в дозе 80 мг/м² в виде 24-часовой инфузии каждые 14 дней. У детей с массой тела менее 10 кг доза рассчитывается из расчета на массу тела.
- Адъювантная терапия включает введение цисплатина в те же дозах на 1-й и 15-й дни. При недостаточном эффекте возможно усиление химиотерапевтического воздействия.

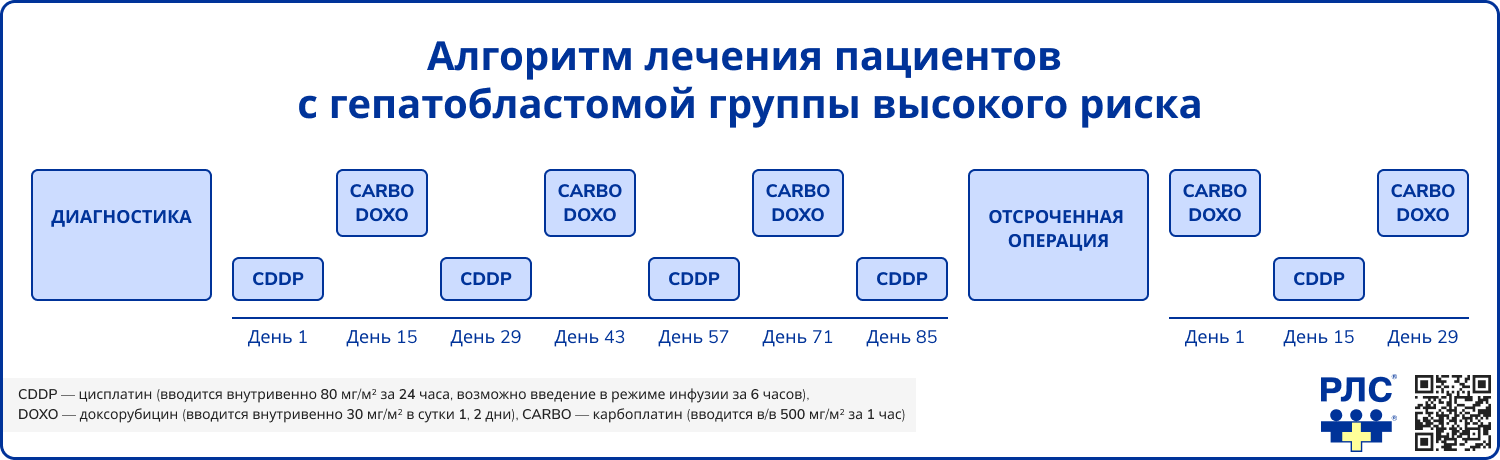
Пациентам группы высокого риска показана схема SIOPEL-3 HR, включающая 10 курсов: 7 неоадъювантных и 3 адъювантных. Оперативное лечение проводится на 85-й день от начала терапии, после завершения четырех курсов.
- Неоадъювантная терапия включает цисплатин (80 мг/м² в дни 1, 29, 57, 85), карбоплатин (500 мг/м² в дни 15, 43, 71) и доксорубицин (30 мг/м²/сут в дни 15-16, 43-44, 71-72).
- Адъювантная терапия проводится по схожей схеме с введением карбоплатина (дни 1, 29), доксорубицина (дни 1-2, 29-30) и цисплатина (день 15). При опухолях PRETEXT III-IV рекомендуется консультация в трансплантационном центре.
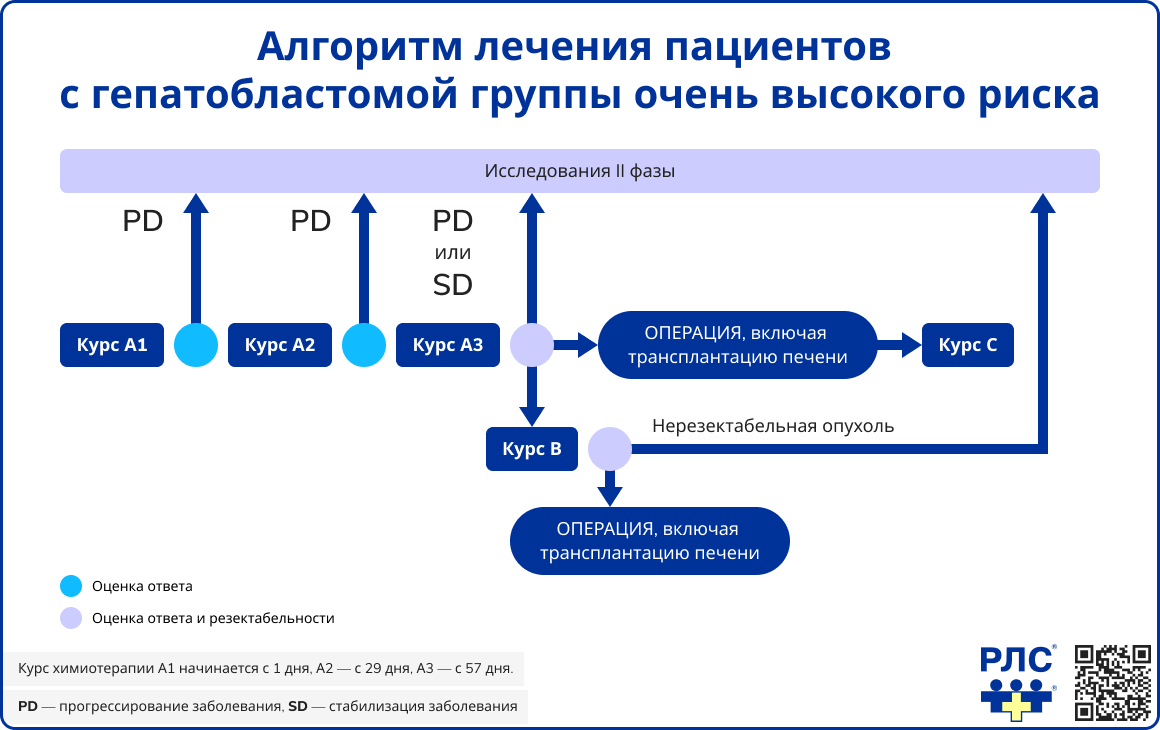
Для пациентов группы очень высокого риска используется интенсивная схема SIOPEL-4, включающая последовательное проведение блоков А1-А3, оценку резектабельности и, при необходимости, переход к блокам В и С.
- Блоки A1-A3 включают цисплатин (80 мг/м² на 1-й день; 70 мг/м² на 9-й, 15-й, 29-й, 37-й, 43-й, 58-й и 64-й дни) и доксорубицин (30 мг/м² в соответствующие дни каждого блока).
- При отсутствии возможности резекции после трех блоков проводится блок B с карбоплатином (500 мг/м² на 2-й и 23-й дни) и доксорубицином (25 мг/м²/сут в дни 1-3 и 22-24).
- После полной резекции осуществляется блок С, включающий карбоплатин (дни 2, 23, 44) и доксорубицин (20 мг/м²/сут в дни 1-2, 22-23, 43-44).
Хирургическое лечение
Выбор объема оперативного вмешательства при гепатобластоме определяется локализацией и распространенностью опухолевого процесса, а также анатомо-функциональными резервами печени.
- Частичная (анатомическая) резекция печени выполняется при локализованных формах заболевания, если возможно полное удаление опухоли при сохранении достаточного объема функционирующей паренхимы.
- Ортотопическая трансплантация печени показана в случаях, когда резекция невозможна из-за выраженного распространения опухоли (PRETEXT III-IV), вовлечения магистральных сосудов (печеночных вен – V3, воротной вены – P2), поражения хвостатой доли (I сегмент) либо в ситуациях, когда не удается обеспечить адекватный объем остаточной печени. Необходимым условием проведения трансплантации является полная санация экстрапеченочных очагов.
Список литературы
- Musick S.R. et al. Hepatoblastoma // StatPearls. StatPearls Publishing, 2023.
- Guo C. et al. Global, regional, and national epidemiology of hepatoblastoma in children from 1990 to 2021: a trend analysis //Hepatology International. – 2025. – Т. 19. – №. 1. – С. 156-165.
- Celotti A. et al. Hepatoblastoma of the adult: A systematic review of the literature //Surgical Oncology. – 2016. – Т. 25. – №. 3. – С. 339-347.
- Kalish J. M. et al. Update on surveillance for Wilms tumor and hepatoblastoma in Beckwith–Wiedemann syndrome and other predisposition syndromes //Clinical Cancer Research. – 2024. – Т. 30. – №. 23. – С. 5260-5269.
- Secretan B. et al. A review of human carcinogens—Part E: tobacco, areca nut, alcohol, coal smoke, and salted fish //The lancet oncology. – 2009. – Т. 10. – №. 11. – С. 1033-1034.
- M Turcotte L., G Spector L. What do we know about the etiology of hepatoblastoma? //Hepatic Oncology. – 2014. – Т. 1. – №. 1. – С. 7-10
- Jiao J., Saxena R., Morotti R. Hepatoblastoma: Comprehensive Review With Recent Updates //Advances in Anatomic Pathology. – 2025. – С. 10.1097.
- Canberk S. et al. Mixed hepatocellular carcinoma and hepatoblastoma: cytohistopathologic findings and differential diagnosis //Acta cytologica. – 2013. – Т. 57. – №. 1. – С. 91-95.
- Malogolowkin M. Overview of hepatoblastoma. – 2024.
- Fan L. et al. Hepatoblastoma: From Molecular Mechanisms to Therapeutic Strategies //Current Oncology. – 2025. – Т. 32. – №. 3. – С. 149.
- Nagae G. et al. Genetic and epigenetic basis of hepatoblastoma diversity //Nature communications. – 2021. – Т. 12. – №. 1. – С. 5423.
- López-Terrada D. et al. Towards an international pediatric liver tumor consensus classification: proceedings of the Los Angeles COG liver tumors symposium //Modern pathology. – 2014. – Т. 27. – №. 3. – С. 472-491.
- Young E. P., O’Neill A. F., Rangaswami A. A. Pediatric Hepatocellular Carcinoma: A Review of Predisposing Conditions, Molecular Mechanisms, and Clinical Considerations //International Journal of Molecular Sciences. – 2025. – Т. 26. – №. 3. – С. 1252.
- Ranganathan S., Lopez-Terrada D., Alaggio R. Hepatoblastoma and pediatric hepatocellular carcinoma: an update //Pediatric and Developmental Pathology. – 2020. – Т. 23. – №. 2. – С. 79-95.
- Towbin A. J. et al. 2017 PRETEXT: radiologic staging system for primary hepatic malignancies of childhood revised for the Paediatric Hepatic International Tumour Trial (PHITT) //Pediatric radiology. – 2018. – Т. 48. – №. 4. – С. 536-554.
- Клинические рекомендации Российского общества детских онкологов и гематологов «Гепатобластома», М.: 2024.
- Meyers R. L. et al. Risk-stratified staging in paediatric hepatoblastoma: a unified analysis from the Children's Hepatic tumors International Collaboration //The Lancet Oncology. – 2017. – Т. 18. – №. 1. – С. 122-131.
Автор статьи
Статьи по теме Онкология
Болезни в статье:
- C22.0 Печеночноклеточный рак
- Q87.3 Синдромы врожденных аномалий, проявляющихся избыточным ростом [гигантизмом] на ранних этапах развития
- Q91.3 Синдром Эдвардса неуточненный
- Q90 Синдром Дауна
- G31.8 Другие уточненные дегенеративные болезни нервной системы
- D48.9 Новообразование неопределенного или неизвестного характера неуточненное
- Q87.0 Синдромы врожденных аномалий, влияющих преимущественно на внешний вид лица
- E74 Другие нарушения обмена углеводов
- D12.6 Ободочной кишки неуточненной части
Оцените статью:
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).



