- Злокачественные опухоли вспомогательного аппарата глаза
-
Опухоли век
- Карцинома in situ (Эпителиома Боуэна)
- Базально-клеточный рак (базалиома)
- Плоскоклеточный рак (чешуйчато-клеточный рак, сквамозно-клеточный рак)
- Железистый рак (аденокарцинома мейбомиевой железы или сальной железы Цейса)
- Меланома кожи век
- Общепринятая методика
- Злокачественные лимфомы век
- Саркома Капоши
- Опухоль Меркеля (синонимы: нейроэндокринная карцинома из клеток Меркеля, кожная APUDома)
- Метастатические опухоли век
- Злокачественные опухоли конъюнктивы и роговицы
- Злокачественные опухоли слезоотводящих путей
- Злокачественные опухоли сосудистой оболочки
- Злокачественные внутриглазные лимфомы
- Злокачественные опухоли орбиты
- Злокачественные лимфомы орбиты
- Злокачественные опухоли слезной железы
- Первичный рак орбиты
- Саркома орбиты
- Метастаз в орбиту
C49.0 Соединительной и мягких тканей головы, лица и шеи, МКБ-10
Отредактировано: 23.08.2023
Периферический отдел зрительного анализатора (орган зрения) представлен двумя глазными яблоками, находящимися в полости правой и левой орбит. Глазное яблоко на 2/3 расположено в полости орбиты. Выступающая передняя треть глаза защищена мобильными веками. Правильное положение глаза в полости орбиты и многообразие его движений обеспечивают 4 прямые и 2 косые экстраокулярные мышцы. Ретробульбарный отдел орбиты заполнен жировой клетчаткой. Через ее пространство проходят глазодвигательные мышцы, мышца леватор верхнего века, кровеносные сосуды, ветви двигательных и чувствительных нервов (в т.ч. и орбитальная часть зрительного нерва). Глазное яблоко имеет 3 основные оболочки (наружную — фиброзную, среднюю — сосудистую, внутреннюю — сетчатую с фоторецепторами, палочками и колбочками) и оптическую светопреломляющую систему, состоящую из роговицы, влаги передней камеры, хрусталика и стекловидного тела. Сосудистая оболочка глаза состоит из радужки, цилиарного тела и хориоидеи. Светопреломляющая система позволяет получить на сетчатке обратное, уменьшенное, действительное изображение внешних объектов. В фоторецепторах сетчатки энергия адекватных световых раздражителей преобразуется в нервные импульсы (рис. 1).
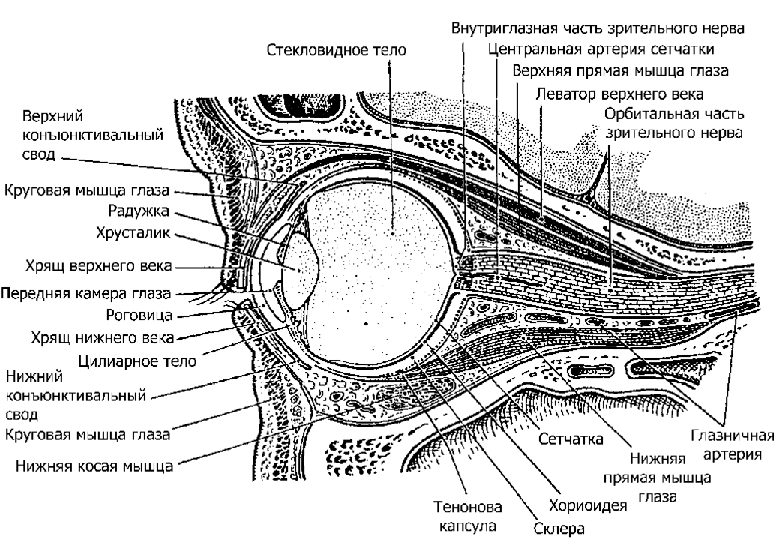
Рисунок 1. Анатомия глаза. Сагитальный разрез через глазницу (Сомов Е.Е., 1997)
Среди злокачественных новообразований органа зрения преобладают опухоли вспомогательного аппарата глаза. Они составляют около 75%. Второе место по частоте занимают злокачественные внутриглазные опухоли — около 20%. И, наконец, на долю опухолей орбиты приходится около 5% от всех злокачественных опухолей органа зрения.
Злокачественные опухоли вспомогательного аппарата глаза
К вспомогательному аппарату глаза относятся веки, бульбарная конъюнктива, слезные железы (основные и добавочные), слезные канальцы, слезный мешок, слезно-носовой канал, экстраокулярные мышцы.
Веки имеют хорошо развитую лимфатическую сеть, которая расположена на двух уровнях — на передней и задней поверхности хрящей век. Лимфатические сосуды верхнего века впадают в предушные лимфоузлы, а нижнего века — в подчелюстные. Богатую лимфатическую сеть имеет также и конъюнктива. Отток лимфы от конъюнктивы осуществляется в предушные и подчелюстные лимфоузлы. Лимфатические сосуды слезной железы впадают в предушные и шейные лимфоузлы.
Опухоли слезной железы и экстраокулярных мышц встречаются относительно редко и располагаются в полости орбиты, поэтому их целесообразно рассматривать в разделе, посвященном опухолям орбиты. Роговица не относится к вспомогательному аппарату глаза. Однако опухоли роговицы берут свое начало в зоне лимба. Часто такие опухоли распространяются как на бульбарную конъюнктиву, так и на роговицу, поэтому опухоли роговицы следует рассматривать вместе с опухолями бульбарной конъюнктивы. Таким образом, новообразования вспомогательного аппарата глаза по локализации можно разделить на:
— опухоли век (кроме опухолей пальпебральной конъюнктивы);
— опухоли конъюнктивы и роговицы;
— опухоли слезоотводящих путей.
Опухоли век, конъюнктивы и роговицы встречаются преимущественно у лиц пожилого возраста на фоне дегенеративных изменений кожи или конъюнктивы. По-видимому, в развитии многих опухолей определенная роль принадлежит солнечной радиации, травматизации частичками песка, пыли.
По происхождению опухоли вспомогательного аппарата глаза делятся на 3 типа: эпителиальные, пигментные или меланогенные, мезенхимальные; преобладают эпителиальные опухоли (около 95%).
Опухоли век
Среди злокачественных опухолей кожи век преобладают узловые формы, что связано с хорошей васкуляризацией век. Они характеризуются инфильтративным ростом, за счет чего поверхность их рано изъязвляется. При распространении опухоли на область межреберного пространства нарушается рост ресниц. Соответственно классификации по системе ТNM:
Т1 — нет признаков вовлечения в процесс хряща века и/или опухоль захватывает маргинальный край не более 5 мм в наибольшем диаметре;
Т2 — опухоль прорастает хрящ и/или захватывает маргинальный край на 5–10 мм;
Т3 — опухоль распространяется на всю толщу века и/или поражает маргинальный край более 10 мм;
Т4 — опухоль распространяется на ближайшие анатомические структуры;
N — метастазы в регионарные лимфоузлы (предушные или подчелюстные);
М — отдаленные метастазы: легкие и органы средостения.
Карцинома in situ (Эпителиома Боуэна)
На коже век встречается крайне редко. Клинически имеет вид бляшки небольших размеров (несколько мм в диаметре) темно-красного цвета с чешуйками на поверхности. После снятия чешуек обнажается мокнущая бугристая поверхность опухоли. При локализации новообразования у ресничного края нарушается рост ресниц. Морфологически опухоль имеет все признаки рака. Атипичные кератоциты объединяются в сосочкоподобные структуры. Возникают очаги паракератоза. Появляются клеточный полиморфизм, атипичные митозы, многоядерные клетки. Но процесс не распространяется глубже базальной мембраны эпидермиса. При отсутствии своевременного лечения опухоль трансформируется в плоскоклеточный рак. Лечение: бета—аппликационная терапия. При своевременном лечении прогноз для жизни и зрения благоприятный.
Базально-клеточный рак (базалиома)
Наиболее часто встречающаяся злокачественная опухоль вспомогательного аппарата глаза. Составляет до 80% от всех злокачественных новообразований кожи век. Пик заболеваемости приходится на возраст 60—79 лет. Опухоль растет из базально-клеточного слоя эпидермиса. Базалиома располагается преимущественно во внутренней половине нижнего века и в области внутреннего угла глазной щели.
Клинических классификаций базалиом много. На практике, как правило, выделяют узловую, язвенную, разрушающую (деструктивную), поверхностную и склеродермоподобную формы. На веках преобладает узловая форма опухоли. Для базалиомы характерен медленный темп роста. Метастазирование происходит редко, преимущественно в регионарные лимфатические узлы: предушные или подчелюстные.
Для узловой базалиомы характерно развитие опухоли бледно-розового цвета на широком основании с бугристой поверхностью. Наблюдается смещаемость опухолевого узла. При биомикроскопии (исследование в свете щелевой лампы) определяются “феномен стеаринового блеска” и бедная васкуляризация опухоли (см. рис. 2 на цветной вклейке).
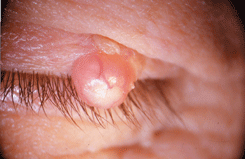
Рисунок 2. Узловая форма базально-клеточного рака
В ряде случаев происходит размягчение опухолевого узла с образованием кист — кистовидная форма базалиомы. Такую базалиому необходимо дифференцировать с ретенционной кистой. Возможно развитие пигментированного варианта узловой формы базально-клеточного рака. Как правило, наблюдаются точечная, сетевидная или гроздевидная пигментация опухоли (см. рис. 3 на цветной вклейке). Пигментация появляется в результате скопления меланоцитов в строме опухоли, либо за счет образования гемосидерина при кровоизлияниях в опухоль. Пигментированную форму базально-клеточного рака необходимо дифференцировать с меланомой. В пользу базально-клеточного рака говорят: медленный темп роста, бедность васкуляризации, четко отграниченные края новообразования, эластичная плотность и хорошая смещаемость опухолевого узла.
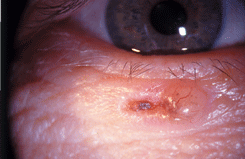
Рисунок 3. Базально-клеточный рак. Видна сетевидная пигментация опухоли
Язвенная базалиома чаще развивается на нижнем веке у ресничного края и сопровождается выпадением ресниц. На поверхности язвы появляется геморрагическая корка. После удаления корки обнажается язва с приподнятыми краями и бугристым дном матово-белого цвета со слабо выраженной васкуляризацией.
Деструктивная базалиома (см. рис. 4 на цветной вклейке) характеризуется более быстрыми темпами агрессивно инфильтрирующего роста опухоли. Веко разрушается на всю его толщу, что приводит к образованию больших дефектов. Опухоль рано прорастает в полость орбиты.
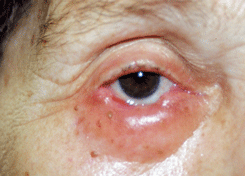
Рисунок 4. Деструктивная форма базально-клеточного рака
Поверхностная базалиома имеет (см. рис. 5 на цветной вклейке) стелющийся рост. Белесовато-розовые участки кожи чередуются с участками поверхностного изъязвления, покрытого мелкими сухими чешуйками.
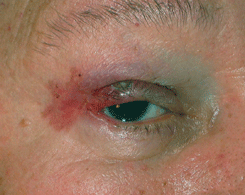
Рисунок 5. Поверхностная форма базально-клеточного рака
Склеродермоподобная базалиома (см. рис. 6 на цветной вклейке) в начале роста протекает как экзематозный дерматит, не поддающийся обычному лечению. По мере прогрессирования опухоли центральная ее часть может рубцеваться, а периферическая — распространяется на прилежащие участки кожи. Опухоль приобретает характерный вид: ее центральные отделы представлены плотными атрофическими рубцами, а периферические участки — экзематозно измененной кожей с мелкими очагами изъязвления. Склеродермоподобный вариант опухоли характеризуется выраженным фиброзом склеры с островками сóлидных и сóлидно-аденоидных структур.
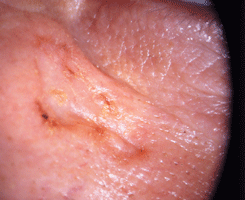
Рисунок 6. Склеродермоподобная форма базально-клеточного рака
При гистологическом исследовании различают мультицентрическую, узелковую, язвенную, инфильтративную и смешанную форму опухолей. В свою очередь эти типы базально-клеточного рака могут быть подразделены на опухоли сóлидной, аденоидной и метатипической форм (Atlas of tumor pathology. Tumors of the eye and ocular adnexa, 1994). Корреляции между гистологическими типами и клиническими формами базалиомы не выявлено (Панова И.Е., Усова Р.А., 2002).
Лечение базально-клеточного рака зависит от размеров опухоли, формы и локализации. Небольшие опухоли удаляют оперативным путем с использованием микрохирургической техники: хороший эффект дают лазерная эксцизия опухоли и радиоволновая хирургия. Радиохирургический прибор “Сургитрон” (Ellman International) обладает всеми преимуществами CO2-лазера, но выгодно отличается от последнего меньшей стоимостью, портативностью и минимальным риском при работе. Образовавшийся дефект тканей закрывают путем перемещения окружающих тканей, свободным лоскутом или лоскутом на ножке. При отсутствии распространения опухоли на интрамаргинальное пространство можно использовать криодеструкцию и фотодинамическую лазерную терапию, а при небольшой толщине опухоли (до 4 мм) — бета-аппликационную терапию. Бета-аппликационную терапию осуществляют амбулаторно в положении больного лежа или полулежа. На голову пациента одевают налобный фиксатор. Взор больного фиксируют на фиксационную точку. Стержень аппликатора закрепляют в налобном фиксаторе. Под местной инстилляционной анестезией 1% раствором оксибупрокаина или 2% раствором лидокаина аппликатор ставят на опухоль. Облучение проводят ежедневно 5 раз в неделю. Длительность сеанса (10–30 мин) зависит от разовой дозы и мощности аппликатора. Разовая доза 20–30 Гр. СОД составляет 120–150 Гр. В лечении опухолей бóльшей толщины с успехом применяется короткодистанционная рентгенотерапия. При проведении рентгенотерапии глаз защищают специальным пластмассово-свинцовым протезом. Альтернативой экзентерации орбиты при больших опухолях, распространяющихся на конъюнктиву и орбиту, может быть облучение узким медицинским протонным пучком (Бровкина А.Ф., Зарубей Г.Д., 1987).
Плоскоклеточный рак (чешуйчато-клеточный рак, сквамозно-клеточный рак)
Эта форма рака встречается значительно реже, чем базально-клеточный рак и составляет около 10% от всех злокачественных опухолей кожи век. Нередко развивается на фоне предраковых заболеваний. В области кожи век преобладает дифференцированный ороговевающий рак, в то время как для конъюнктивы типична неороговевающая форма опухоли. Плоскоклеточный рак отличается от базально-клеточного рака быстрыми темпами роста. Узел опухоли выглядит более сочным, не имеет четких границ, уходит в глубь подлежащих тканей. Центральная часть опухоли рано изъязвляется. Края язвы плотные и бугристые. Изъязвление опухоли почти всегда сопровождается присоединением вторичной инфекции с образованием гнойных корок на поверхности (см. рис. 7 на цветной вклейке). Вокруг опухоли возникают перифокальный дерматит или конъюнктивит. Наиболее частым местом локализации является нижнее веко, особенно его наружная половина. При локализации у края века опухоль быстро распространяется на конъюнктиву века и прорастает в полость орбиты. При гистологическом исследовании определяются полигональные клетки с эозинофильной цитоплазмой. Нередко наблюдается дискератоз, паракератоз и межклеточные мостики. Ядра клетки — гиперхромные с признаками атипизма. Данные гистологического исследования зависят от степени дифференцировки опухоли. Веретеноклеточный вариант чешуйчато-клеточного рака морфологически напоминает недифференцированную саркому или фиброзную гистиоцитому. Правильному диагнозу помогает выявление в различных срезах атипичных кератиноцитов и небольших участков кератинизации в прилежащем эпителии.
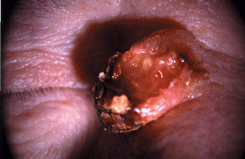
Рисунок 7. Плоскоклеточный рак кожи
Диагноз устанавливается на основании данных наружного осмотра, биомикроскопии, морфологического исследования биоптата.
Выбор метода лечения зависит от размеров опухоли. Небольшие опухоли могут быть удалены оперативным путем с использованием микрохирургической техники. Опухоли бóльших размеров подвергаются облучению: брахитерапии или дистанционной лучевой терапии с защитой глазного яблока (см. выше).
Прогноз при адекватном лечении относительно благоприятный.
Железистый рак (аденокарцинома мейбомиевой железы или сальной железы Цейса)
Составляет около 5% от злокачественных опухолей кожи век.
Веки содержат большое количество разнообразных желез: сальных, потовых, добавочных слезных. В толще хряща параллельными рядами расположены продолговатые, альвеолярные мейбомиевы железы. Их выводные протоки открываются у заднего реберного края века. Мейбомиевы железы продуцируют липидный секрет, который смазывает края век. В волосяные мешочки ресниц открываются сальные железы Цейса и видоизмененные потовые железы Моля.
Аденокарцинома сальной железы встречается преимущественно на коже век и чрезвычайно редко развивается на коже других областей. В основном страдают лица пожилого возраста, чаще женщины. Преобладают опухоли из мейбомиевых желез, реже развиваются опухоли из эпителия сальных желез Цейса и еще реже из сальных желез слезного мясца и брови. Чаще поражается верхнее веко, возможно потому, что количество мейбомиевых желез на верхнем веке больше, чем на нижнем. Высокая степень злокачественности аденомы мейбомиевой железы определяется быстрым метастазированием в регионарные лимфоузлы и отдаленные органы. На ранних стадиях опухоль напоминает халязион. Это обстоятельство диктует необходимость обязательного гистологического исследования тканей при оперативном лечении любого халязиона, но особенно это важно в случаях его рецидивирующего течения. По мере роста аденокарциномы мейбомиевой железы, в отличие от халязиона, возникает не только уплотнение, но и деформация хряща. Возникают втянутость в межреберном пространстве века и трихиаз (см. рис. 8 на цветной вклейке). В межреберном пространстве появляются плотные массы желтоватого цвета. Иногда опухоль прорастает хрящ век с формированием на конъюнктиве серовато-красноватых кровоточащих разрастаний. В большинстве случаев аденокарцинома мейбомиевой железы сопровождается односторонним конъюнктивитом, блефаритом и мейбомиитом. Такая клиническая картина, описанная в литературе как “маскарадный синдром”, связана с инвазией клеток опухоли в конъюнктивальный эпителий. Возможны случаи мультицентрического роста опухоли. Аденокарцинома сальных желез слезного мясца характеризуется желтовато-сероватыми массами, расположенными под неизмененным эпителием. При морфологическом исследовании определяют атипичные дольки сальной железы. Клетки — с гиперхромными ядрами и вакуолизированной цитоплазмой с различной выраженностью клеточного и ядерного полиморфизма.
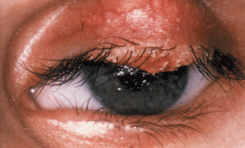
Рисунок 8. Аденокарцинома мейбомиевой железы
В лечении железистого рака кожи предпочтение отдают различным методам лучевой терапии и их комбинациям. При распространении опухоли на конъюнктивальные своды и бульбарную конъюнктиву показана экзентерация орбиты (Офтальмоонкология. Руководство для врачей, 2002).
Прогноз для зрения и жизни неблагоприятный. Опухоль склонна к рецидивированию. По данным Бровкиной А.Ф. (2002), в первые 5 лет умирают около 60% больных.
Меланома кожи век
Встречается редко (1–2% злокачественных опухолей век). Меланома в коже век наблюдается значительно реже, чем в конъюнктиве. З.Л. Стенько (1971), при обследовании 3612 больных злокачественными опухолями органа зрения выявила меланому конъюнктивы у 74 пациентов (1,7%), а меланому кожи век у 35 пациентов (0,94%). Заболевание чаще встречается у женщин в менопаузе.
Возможны 3 источника развития меланомы кожи век: из предсуществующих невусов, на фоне меланоза и de novo. По данным З.Л. Стенько (1971) на коже век чаще развиваются меланомы из предсуществующих невусов.
Предсуществующий невус. Важными симптомами активизации роста невуса кожи век являются: увеличение размеров опухоли как по площади, так и по толщине, изменение характера пигментации — ее усиление или, напротив, ослабление, при этом пигментация опухоли становится неравномерной. На поверхности опухоли появляются дочерние узелки, а вокруг нее наблюдаются застойно полнокровные сосуды и распыление пигмента.
Предраковый меланоз (меланоз Дюбрея, интраэпителиальный меланоз, приобретенный меланоз, меланотические веснушки Гутчинсона) является вторым источником кожных меланом. Преимущественно встречается у пожилых людей. Процесс односторонний. Характеризуется появлением на коже век пигментированных пятен с разной степенью окраски — от желтоватой до черной. Пятна неправильной формы с фестончатыми краями нередко достигают в диаметре нескольких сантиметров. Пигментированные пятна имеют тенденцию к увеличению в размерах. Пигментация усиливается в летнее время, а в зимнее — ослабевает. Рисунок кожи на поверхности приобретенного меланоза сохранен. Пигментация может распространяться на слезное мясцо и конъюнктиву (см. предраковый меланоз конъюнктивы). Предраковый меланоз Дюбрейля требует динамического наблюдения. Отдельные участки могут подвергаться малигнизации, развивается меланома in situ.
Первичный приобретенный меланоз необходимо дифференцировать со вторичным приобретенным меланозом.
Вторичный приобретенный меланоз почти всегда бывает двусторонним и развивается под воздействием метаболических и токсических факторов. Такая форма меланоза не озлокачествляется.
Фактор риска развития меланомы кожи век — повышенная чувствительность к солнечной радиации.
Клинические проявления меланомы кожи век многообразны. Так, меланома выглядит в виде неравномерно пигментированного пятна с нечеткими неровными границами или проявляется как неравномерно пигментированный узел опухоли, легко кровоточащий при прикосновении. В свете щелевой лампы видны его бугристая поверхность, богатая васкуляризация, полнокровие сосудов и мелкоточечное распыление пигмента вокруг него. При локализации меланомы у края века нарушается рост ресниц. Наиболее сложны для диагностики беспигментные формы меланомы кожи. По данным Стенько З.Л. (1971), беспигментные меланомы кожи век встречаются редко и составляют не более 10% случаев. При гистологическом исследовании меланомы кожи век отмечено преобладание эпителиодноклеточных и смешанноклеточных типов опухоли. Веретеноклеточный тип встречается реже.
Диагноз устанавливается на основании данных наружного осмотра, биомикроскопии, данных радиоизотопного исследования — 3|2|Р тест.
Общепринятая методика
Перорально вводят раствор двузамещенного фосфата натрия из расчета 0,25 мБк на 1 кг массы тела больного. Подсчет накопления радионуклида в исследуемом очаге производят через 24, 48, 72, 96 ч. Стойкое накопление радионуклида в исследуемой опухоли говорит о ее злокачественном характере.
При наличии мацерированной, кровоточащей поверхности опухоли возможно цитологическое исследование отпечатков с нее.
Лечение меланомы кожи век является сложной задачей. А.Ф. Бровкина (2002) предлагает следующую схему терапии: локальное иссечение маленьких кожных меланом (менее 10 мм в диаметре) с использованием микрохирургической техники в пределах здоровых тканей, отступя от видимых границ опухоли не менее 3 мм. Узловые формы меланомы с диаметром более 15 мм не подлежат локальному иссечению. Методом выбора лечения таких опухолей является лучевая терапия: облучение узким медицинским протонным пучком. Лучевая терапия является альтернативой экзентерации орбиты. Облучать следует и регионарные предушные или подчелюстные лимфатические узлы. Криодеструкция меланом кожи век противопоказана (Офтальмоонкология. Руководство для врачей, 2002).
Прогноз для жизни очень серьезный и зависит от стадии заболевания, локализации и формы роста опухоли. Более благоприятный прогноз при лечении маленьких меланом с плоскостным ростом. Узловые формы опухоли имеют худший прогноз в связи с ранней инвазией опухолевых клеток в подлежащие ткани. По мнению G. Vaughn et al. (1999), при толщине опухоли 1,5 мм более 50% больных умирают от метастазов в первые 5 лет от начала лечения (Vaughn G., Dortzbach R., 1999). К факторам, ухудшающим прогноз, относят также:
— локализацию опухоли у реберного края;
— распространение на межреберное пространство и конъюнктиву (Tahery D., Goldberg R., Moy R., 1992).
Совокупность всех остальных злокачественных опухолей век составляет менее 1%.
Злокачественные лимфомы век
Лимфомы редко развиваются из тканей век и составляют, по нашим данным, около 7% от всех НХЛ органа зрения. Первичные НХЛ век встречаются редко. Специфическое поражение век чаще является симптомом диссеминированной лимфомы. Лимфомы век наблюдаются в виде уплотнений в толще века тестоватой консистенции. Кожа над опухолью остается неизмененной. В редких случаях опухоль распространяется на пальпебральную конъюнктиву в виде разрастаний беловато-сероватого цвета (см. рис. 9 на цветной вклейке). Лимфомы век могут прорастать в полость орбиты. Среди различных морфологических вариантов НХЛ век преобладают В-клеточные фолликулярные лимфомы и лимфомы из клеток зоны мантии. Диагноз устанавливается на основании морфологического и гистоиммунохимического исследования биоптата опухоли. В лечении диссеминированных лимфом с вовлечением век главная роль принадлежит химиотерапии по стандартным для данной патологии схемам (см. подробнее соотв. раздел). При отсутствии полной регрессии опухоли век в результате химиотерапии дополнительно проводят локальную дистанционную лучевую терапию. Прогноз для жизни определяется поражением других органов.
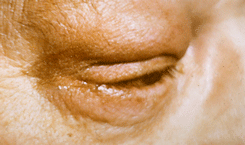
Рисунок 9. Неходжкинская лимфома верхнего века
Саркома Капоши
Развивается на веках приблизительно в 20% случаев системного поражения. На коже появляются узелки красноватого или розоватого цвета. Часто возникает на фоне иммунодефицита. Связь между иммунодефицитом и саркомой Капоши известна давно, патогенез опухоли до конца не изучен (см. “Саркома Капоши конъюнктивы”). При морфологическом исследовании определяют капиллярные полости, заполненные измененными эритроцитами. Диагноз устанавливается на основании морфологического исследования биоптата. Местное лечение заключается в криодеструкции, иссечении опухоли лазерным лучом или радиоволновым ножом.
Опухоль Меркеля (синонимы: нейроэндокринная карцинома из клеток Меркеля, кожная APUDома)
Редкая злокачественная опухоль кожи, которая развивается из клеток Меркеля, расположенных в глубоких слоях эпидермиса, где формируют комплексы с нервными окончаниями. Развивается у лиц пожилого возраста, чаще у женщин. Для опухоли Меркеля характерен быстрый диффузный инфильтративный рост. Наиболее частая локализация — кожа лица. Приблизительно в 10% случаев опухоль располагается на веках и в области бровей. Верхнее веко поражается чаще, чем нижнее. Опухоль представлена безболезненным обширным кожным узлом темно-фиолетового или красновато-голубоватого цвета (см. рис. 10 на цветной вклейке). Внешне имеет сходство с ангиоматозными изменениями кожи. На поверхности опухоли часто можно увидеть резко расширенные сосуды. При микроскопическом исследовании выявляются широкие поля опухолевых клеток с овальными или круглыми ядрами и небольшим ободком цитоплазмы. Почти всю клетку занимает ядро. Видно большое количество митозов. На отдельных участках клетки опухоли образуют трабекулярные структуры. При исследовании с электронным микроскопом в клетках определяются специфические гранулы, позволяющие отнести опухоль Меркеля к APUDомам.
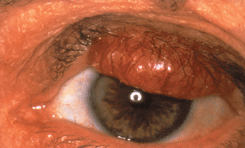
Рисунок 10. Опухоль Маркеля (Shields J., Shields K., 1999)
Диагноз на основании данных клинического исследования представляет большие трудности. Подтверждается морфологическим и гистоиммунохимическим исследованиями биоптата.
Лечение предполагает широкое иссечение опухоли с морфологическим контролем краев опухоли на замороженных срезах. Роль лекарственной и лучевой терапии недостаточно изучена. Прогноз для жизни и зрения неблагоприятный (Marshmann W., NcNab A., 1996).
Метастатические опухоли век
Метастаз в веки встречается крайне редко. Как правило, к моменту выявления метастатического поражения век имеются сведения о первичной опухоли. Чаще всего в веки метастазируют рак молочной железы, рак легкого, опухоли ЖКТ, меланомы. Метастатическое поражение придаточного аппарата глаз часто сочетается с другими метастазами в глаз или орбиту и всегда возникает на фоне поражения других органов, что определяет плохой прогноз для жизни.
Клинические проявления метастатических опухолей придаточного аппарата глаза изучены плохо. На ранних этапах метастатическое поражение век может выглядеть, как обычный халязион. Опухоль быстро увеличивается в размерах, прорастает пальпебральную конъюнктиву с образованием сероватых, легко кровоточащих при прикосновении, псевдогрануляций. Диагноз устанавливается на основании данных анамнеза и морфологического исследования биоптата опухоли. Лечение, которое проводят с паллиативной целью, заключается в дистанционной лучевой терапии.
Злокачественные опухоли конъюнктивы и роговицы
Нередко возникают на фоне предшествующих хронических воспалительных или дистрофических процессов.
Карцинома in situ (Эпителиома Боуэна)
Морфологически имеет все признаки рака, кроме инфильтративного роста — опухоль не растет глубже эпителиального слоя. Чаще возникает в области лимба, распространяясь на роговицу и конъюнктиву. В начальной стадии имеет вид неподвижной серовато-беловатой бляшки (см. рис. 11 на цветной вклейке). С увеличением массы опухоли она приобретает перламутрово-белый цвет за счет процессов ороговения. При морфологическом исследовании выявляются крупные опухолевые клетки, ориентированные перпендикулярно к базальной мембране, выраженные явления клеточной атипии, акантоза. Лечение: частичная послойная конъюнктивокератосклеропластика или бета-аппликационная терапия. При своевременном лечении прогноз для жизни и зрения благоприятный.
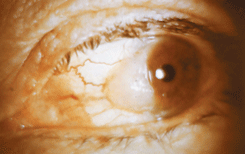
Рисунок 11. Эпителиома Боуэна конъюнктивы и роговицы
Рак
Классификация по системе ТNM:
Т1 — опухоль не более 5 мм в наибольшем диаметре;
Т2 — опухоль более 5 мм в диаметре без распространения на соседние ткани;
Т3 — опухоль более 5 мм с распространением на соседние ткани (склеру, полулунную складку и слезное мясцо, хрящ века), за исключением орбиты;
Т4 — опухоль распространяется в орбиту;
N — метастазы в регионарные лимфоузлы: предушные и подчелюстные;
M — отдаленные метастазы: легкие и органы средостения.
Плоскоклеточный рак (чешуйчато-клеточный рак) конъюнктивы встречается редко, в зависимости от географического положения местности от 0,02 до 3,5 на 100 тыс. населения: в южных странах частота заболеваемости выше, чем в северных. Обычно развивается у лиц пожилого возраста на фоне дистрофических изменений конъюнктивы. Определенную роль в развитии плоскоклеточного рака конъюнктивы отводят папилломатозному вирусу человека, УФ облучению и ВИЧ-инфекции. Имеются сведения о частом развитии плоскоклеточного рака конъюнктивы у больных пигментной ксеродермой.
Опухоль чаще локализуется в области лимба. Растет медленно. Как правило, стелится по поверхности глазного яблока. Представлена папилломатозной и птеригоидной формами (см. рис. 12 на цветной вклейке). Значительно реже быстро растет в виде четко отграниченного узла (см. рис. 13 на цветной вклейке). Вокруг опухоли имеется ободок перифокальной инъекции сосудов. Резко расширены и эпибульбарные сосуды в зоне локализации новообразования. Возможно развитие пигментированной плоскоклеточной карциномы, которую следует дифференцировать с меланомой конъюнктивы. Пигментация опухоли обусловлена скоплением нормальных меланоцитов в ее строме. Пигментированный вариант плоскоклеточного рака чаще развивается у смуглых людей с темным цветом волос и не отличается бóльшей агрессивностью, чем беспигментная опухоль. Значительно реже развивается т.н. диффузная форма рака конъюнктивы с плоскостным ростом, которая может симулировать хронический конъюнктивит. Возможно прорастание опухолью склеры или роговицы и распространение вглубь глаза в область корнеосклеральных трабекул, радужки цилиарного тела, хориоидеи. В этих случаях рост опухоли приводит к развитию вторичной глаукомы, увеита, отслойки сетчатки. Рак пальпебральной конъюнктивы (т.е. конъюнктивы век) может сопровождаться искривлением хряща, укорочением сводов, птозом верхнего века. Эта форма опухоли имеет тенденцию через тарзо-орбитальную фасцию проникать в полость орбиты. Морфологическая картина характеризуется обширными полями акантоза, гиперкератоза, клеточным полиморфизмом, наличием элементов воспаления, обилием патологических митозов. Опухолевые клетки — мелкие, в виде веретен, с эозинофильной цитоплазмой и гиперхромным ядром.
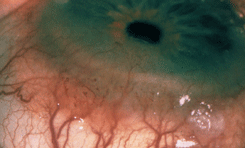
Рисунок 12. Плоскоклеточный рак конъюнктивы и роговицы
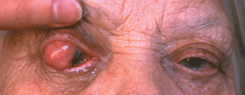
Рисунок 13. Узловая форма плоскоклеточного рака конъюнктивы и роговицы
Диагноз устанавливается на основании данных биомикроскопии, 32 Р теста (см. выше), цитологического исследования отпечатка с поверхности опухоли в случае пигментированного варианта и морфологического исследования биоптата опухоли. При вовлечении в процесс конъюнктивальных сводов показана компьютерная томография орбиты для исключения начальных признаков прорастания опухоли в полость орбиты.
Выбор метода лечения зависит от локализации опухоли и ее размеров.
Имеются сведения об успешном лечении маленьких опухолей с плоскостным ростом инстилляциями 0,04% раствора митомицина 3 раза в сутки в течение 2 нед (Frucht-Perry J., Rozenman Y., 1994). Осложнения применения митомицина: кератопатия и связанные с ней блефароспазм, светобоязнь, слезотечение. При локализации опухоли вне роговицы, а также в случае диффузного плоскостного роста возможно применение бета-аппликационной терапии в сочетании с лазерной или радиоволновой эксцизией.
Узловые формы опухоли: при вовлечении в процесс роговицы проводят локальное иссечение опухоли с частичной послойной конъюнктивокератосклеропластикой. Контроль радикализма удаления опухоли осуществляется при исследовании удаленных тканей на замороженных срезах. Неплохие результаты дает криодеструкция опухоли — и как самостоятельный метод, и в сочетании с локальной эксцизией.
В случаях распространения опухоли в полость глаза показана энуклеация, а при прорастании орбиты — экзентерация. Прогноз для жизни и зрения неблагоприятный. Опухоль склонна к рецидивированию и метастазированию в регионарные лимфоузлы, легкие и кости.
Мукоэпидермальный рак конъюнктивы относят к особой форме плоскоклеточного рака (Офтальмоонкология. Руководство для врачей, 2002; International ophthalmology clinics. Recent advances in ocular oncology, 1997) или выделяют как самостоятельную нозологическую единицу (Atlas of tumor pathology. Tumors of the eye and ocular adnexa, 1994). Клинические проявления аналогичны плоскоклеточному раку, но в отличие от последнего мукоэпидермальный рак обладает более агрессивным ростом, рано прорастает структуры глазного яблока. Опухоль располагается в перилимбальной зоне. При морфологическом исследовании определяются характерные крупные полигональные клетки с эозинофильной цитоплазмой и цитоплазматическими включениями муцина.
Лечение такое же, как при плоскоклеточном раке. Больше, чем последний, склонен к рецидивам. Прогноз для жизни и зрения неблагоприятный.
Меланома конъюнктивы
Составляет около 2% от всех злокачественных опухолей органа зрения. В большинстве случаев развивается в возрасте 60–70 лет. Мужчины страдают чаще. Считается, что около 75% меланом конъюнктивы развиваются из первичного приобретенного меланоза, 20% — из предсуществующих невусов и только 5% — de novo. Генез меланомы не влияет на прогноз. Однако считается, что меланомы, развившиеся из меланоза, в большей степени склонны к рецидивам (Atlas of tumor pathology. Tumors of the eye and ocular adnexa, 1994). В связи с вышесказанным важно знать признаки злокачественной трансформации первичного приобретенного меланоза и невусов конъюнктивы.
Первичный приобретенный меланоз (предраковый меланоз) — односторонняя плоская или диффузная пигментация конъюнктивы. Иногда переходит на слезное мясцо или кожу век. По мере роста может спонтанно регрессировать или озлокачествляться, последнее сопровождается усилением пигментации и утолщением опухоли на отдельных ее участках. Лечение приобретенного меланоза заключается в лазерной или радиоволновой эксцизии опухоли. Хороший эффект дают инстилляции 0,04% раствора митомицина — как самостоятельный метод лечения или в сочетании с брахитерапией. Последняя обязательна при вовлечении в процесс конъюнктивальных сводов.
Подобно невусам кожи, невусы конъюнктивы подразделяются на интраэпителиальные, субэпителиальные, смешанные, голубые. Голубой и интраэпителиальный невусы не имеют тенденции к прогрессированию и озлокачествлению. Субэпителиальный и смешанный невусы выстоят над поверхностью конъюнктивы. Нередко в невусе появляются кисты. Пигментация варьирует в широких пределах. Приблизительно в 1/3 случаев невусы бывают беспигментными. Чаще всего невус располагается в области слезного мясца и лимба. Никогда не возникает на слизистой оболочке век. Невус может распространяться на роговицу. Признаками роста субэпителиального или смешанного невуса являются:
— усиление пигментации;
— увеличение размеров;
— нечеткость границ;
— васкуляризация опухоли.
При появлении первых признаков роста невуса конъюнктивы показана его лазерная или радиоволновая эксцизия.
Об озлокачествлении невуса свидетельствуют:
— появление перифокального полнокровия сосудов;
— локальное расширение эпибульбарных сосудов соответственно локализации опухоли;
— ограничение смещаемости опухоли за счет прорастания в склеру.
По данным А.Ф. Бровкиной (2002), малигнизация невуса возможна не только в первые годы после его возникновения, но и спустя десятилетия.
Клиническая классификация по системе TNM. Данная классификация применима только для меланомы конъюнктивы.
Т1 — опухоль бульбарной конъюнктивы, поражающая не более одного квадранта;
Т2 — опухоль бульбарной конъюнктивы, поражающая более одного квадранта;
Т3 — опухоль конъюнктивы свода, конъюнктивы века и/или слезного мясца;
Т4 — опухоль распространяется на ткани века, роговицу и/или орбиту.
Патогистологическая классификация:
рТ1 — опухоль бульбарной конъюнктивы, поражающая не более одного квадранта, толщиной не более 2 мм;
рТ2 — опухоль бульбарной конъюнктивы, поражающая более одного квадранта, толщиной не более 2 мм;
рТ3 — опухоль конъюнктивы свода, конъюнктивы века и/или слезного мясца или опухоль бульбарной конъюнктивы, толщиной более 2 мм;
рТ4 — опухоль распространяется на ткани века, роговицу и/или орбиту;
Т4 = рТ4;
N — метастазы в регионарные лимфоузлы: предушные и подчелюстные;
M — отдаленные метастазы в печень, легкие, органы средостения, кости.
Клиническая картина. Меланома конъюнктивы может развиваться в любом отделе конъюнктивы. Но особенно часто поражается бульбарная конъюнктива. Опухоль быстро увеличивается в размерах.
Различают 2 формы меланомы: узловую и поверхностную.
Узловая меланома характеризуется образованием одиночного четко отграниченного узла с гладкой поверхностью (см. рис. 14 на цветной вклейке). По мере роста опухоли ее поверхность изъязвляется и начинает кровоточить. Степень пигментации опухоли варьирует в широких пределах. Возможно развитие беспигментной меланомы, диагностика которой представляет особые трудности. Вокруг опухоли имеются полнокровные резко расширенные сосуды. Пигментированный узел, как правило, окружен распылением мелкоточечного пигмента. Чаще локализуется в перилимбальной зоне и прорастает роговицу. Если опухоль расположена в области слезного мясца, она рано проникает в полость орбиты.
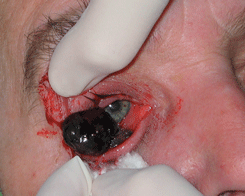
Рисунок 14. Меланома конъюнктивы
Для поверхностной (плоскостной) меланомы характерно появление одного или нескольких плотных слегка возвышающихся над поверхностью глаза образований с нечеткими границами и выраженной перифокальной инъекцией сосудов. Плоскостная меланома конъюнктивы обычно интенсивно пигментирована (см. рис. 15 на цветной вклейке). Между отдельными очагами часто появляются пигментные мостики. Для меланомы конъюнктивы характерно появление очагов отсева опухолевых клеток в зонах контакта опухоли с соседними тканями. А.Ф. Бровкина (2002) рекомендует обязательно тщательно осматривать в свете щелевой лампы конъюнктиву век при выявлении меланомы бульбарной конъюнктивы.
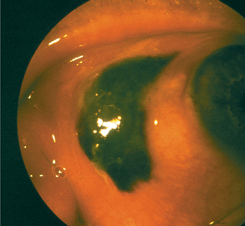
Рисунок 15. Пигментированная меланома бульбарной конъюнктивы
Диагноз устанавливается на основании клинического осмотра, 32Р теста (см. выше), данных цитологического исследования мазков-отпечатков. Для исключения метастазирования необходимо обязательно исследовать регионарные предушные и подчелюстные лимфоузлы и провести обследование по органам как при любой другой форме меланомы (см. соотв. раздел).
Лечение меланомы конъюнктивы — комбинированное. При узловой форме меланомы стадии Т1 — Т2 проводится локальная эксцизия опухоли с последующей бета-аппликационной терапией; при плоскостной меланоме стадии Т1 — Т2 используется локальная химиотерапия митомицином в сочетании с бета-аппликационной терапией. При лечении меланом стадии Т3 методом выбора является облучение узким медицинским протонным пучком. При распространении опухоли в полость орбиты показана экзентерация.
Злокачественные лимфомы конъюнктивы
Конъюнктивальные лимфомы занимают второе место по частоте после орбитальных и составляют около 27% всех злокачественных лимфом органа зрения. Преобладают первичные экстранодальные НХЛ. Значительно реже конъюнктивальная лимфома является симптомом системного поражения. Лимфомы конъюнктивы выглядят как розовые васкуляризированные валикообразные опухоли, преимущественно расположенные в конъюнктивальных сводах (см. рис.16 на цветной вклейке). Пальпебральный и бульбарный отделы конъюнктивы редко вовлекаются в процесс. Многие исследователи сходятся во мнении, что лимфомы органа зрения имеют, как правило, В-клеточную природу (Connor J.M., 1998). Для поражения конъюнктивы характерны MALTомы (опухоли лимфоидной ткани, ассоциированные со слизистыми оболочками), которые обладают низкой степенью злокачественности (Hadman-Lea S., Kerr-Muir M., Wothherspoon A.C. et al, 1994). Клиническая картина злокачественной лимфомы конъюнктивы сходна с клиническими проявлениями реактивной лимфоидной гиперплазии, которая нередко возникает в области конъюнктивальных сводов.
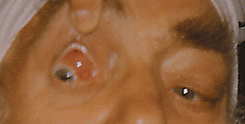
Рисунок 16. Неходжкинская лимфома верхнего конъюнктивального свода
Пестрый клеточный состав MALTом, наличие плазматических клеток и реактивных фолликулов создают трудности в дифференциальной диагностике злокачественных лимфом MALT-типа, реактивной лимфоидной гиперплазии и при морфологическом исследовании биоптата. Правильный диагноз устанавливается на основании данных биомикроскопии, общего клинического обследования пациента, гистологического и гистоиммунохимического исследования биоптата опухоли конъюнктивы.
Лечение первичных злокачественных лимфом конъюнктивы заключается в локальном облучении опухоли. Предпочтение следует отдать бета—аппликационной терапии. При бета-аппликационной терапии лимфом конъюнктивальных сводов рекомендуем применять дугообразные аппликаторы С13, С14, С15 из стандартного комплекта офтальмологических 90 Sr + 90Y аппликаторов отечественного производства. Суммарную дозу определяют из расчета 100 Гр на основание опухоли. Разовая доза — 20 Гр. Облучение проводят ежедневно. Проведение бета-аппликационной брахитерапии позволяет избежать осложнений, характерных для дистанционной терапии: кератопатии, синдрома “сухого глаза”, в отдаленном периоде — развития лучевой катаракты. При распространении опухоли в полость орбиты проводят дистанционную лучевую терапию. Рекомендуемая СОД составляет от 30 до 40 Гр по изоэффекту. Разовая доза — 2–2,5 Гр. Облучение мягких тканей орбиты необходимо проводить с защитой оптических сред глаза. Прогноз при адекватном и своевременном лечении первичных злокачественных лимфом конъюнктивы для жизни и зрения благоприятный.
Саркома Капоши конъюнктивы
Редкое заболевание, которое, как правило, возникает на фоне иммунодефицита. Возраст больных — 30–40 лет. По данным R. Biggar (1996), частота развития опухоли в США составляет 0,29 на 100 тыс. мужчин и 0,07 на 100 тыс. женщин (Biggar R., Rabkin C., 1996). ВИЧ-инфицированные лица заболевают саркомой Капоши в 300 раз чаще, чем основное население. К группе риска развития саркомы Капоши относят также больных, получающих иммуносупрессоры после пересадки органов. Согласно современным представлениям о патогенезе саркомы Капоши, пусковым механизмом развития заболевания является нарушение иммунного статуса и возникающая при этом повышенная продукция клетками многих цитокинов: ИЛ–6, ИЛ–1, ФНО и др. В отличие от нормальных мезенхимальных клеток, опухолевые клетки саркомы Капоши особенно чувствительны к воздействию клеточных ростовых факторов. Высокая продукция цитокинов вызывает экспрессию гена tat, который играет ключевую роль в патогенезе опухоли: обеспечивает миграцию опухолевых клеток. Кроме того, он стимулирует ангиогенез опухоли: эндотелиальные клетки начинают формировать новую капиллярную сеть. Почему нормальные мезенхимальные клетки становятся чувствительными к клеточным ростовым факторам, остается неясным. Возможно, это происходит под воздействием ВИЧ или вируса герпеса.
Клинические проявления саркомы Капоши
Наиболее типичным для заболевания является поражение кожи, которое чаще наблюдается у мужчин. Наиболее частая локализация кожных опухолей — ноги, лицо и гениталии. На коже появляются безболезненные пятна или папулы разнообразных оттенков — от нежно розового до светло-коричневого цвета. Приблизительно у 20% больных саркомой Капоши в процесс вовлекаются веки и конъюнктива. Изменения конъюнктивы обычно локализуются в сводах и имеют вид мелких красноватых узелков. Реже развивается большой безболезненный узел мягкой консистенции (см. рис. 17, 18 на цветной вклейке). Иногда появляется плоская опухоль конъюнктивы ярко-красного цвета, которая симулирует субконъюнктивальное кровоизлияние (см. рис. 19 на цветной вклейке). P.U. Durel et al. (1990) выделили три типа конъюнктивальных опухолей.
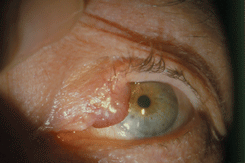
Рисунок 17. Саркома Капоши конъюнктивы
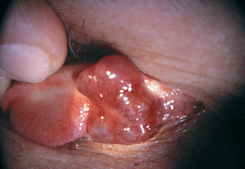
Рисунок 18. Саркома Капоши (та же опухоль), вид со стороны конъюнктивы верхнего века
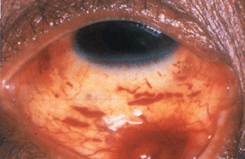
Тип I и тип II характеризуются мелкими папулами или пятнами, которые развились в течение 4 мес.
Тип III. Опухоль конъюнктивы с проминенцией более 3 мм развивается менее чем за 4 мес.
При морфологическом исследовании опухолей типа I выявляют тонкие расширенные сосуды, заполненные эритроцитами и отграниченные плоскими эндотелиальными клетками. Веретенообразных клеток нет. Митозы не определяются.
Для опухолей типа II характерно обилие пустых сосудов, образованных крупными сливными эндотелиальными клетками. Видны отдельные поля веретенообразных клеток. Митозов мало.
Наконец, при опухолях III типа определяются рыхлые скопления веретенообразных клеток с обилием митозов. Между этими клетками имеются щелевидные пространства, заполненные эритроцитами (Durel P.U., Gill P.S., Frangieh G.T., Rao N.A., 1990).
Лечение глазных проявлений саркомы Капоши зависит от распространенности процесса, от характера изменений конъюнктивы. Если пациент получал общую терапию по поводу системных поражений, лечение конъюнктивы начинают не ранее 4 нед после ее окончания, чтобы оценить степень регрессии конъюнктивальной опухоли на фоне стандартной химиотерапии, применяемой при данной патологии (см. соответствующий раздел). С успехом применяется локальная эксцизия или криотерапия конъюнктивальных опухолей типов I и II. При лечении больших опухолей типа III используют дистанционную лучевую терапию (СОД 15–36 Гр), либо проводят комбинированное лечение (Durel P.U., Gill P.S., Frangieh G.T., Rao N.A., 1992).
Метастазы в конъюнктиву
Развиваются крайне редко. О редкости патологии свидетельствует тот факт, что в доступной нам мировой литературе всего описано не более 50 случаев метастазов в веки и бульбарную конъюнктиву. Как правило, к моменту выявления метастатического поражения конъюнктивы у пациента уже имеются множественные метастазы в другие органы (Kiratli H., Shields C., Shields J., DePotter P., 1996). Конъюнктивальные метастазы преимущественно развиваются в ее бульбарной части, бывают одиночными или многофокусными, не спаяны с подлежащей склерой. Цвет опухоли зависит от характера первичной опухоли. Метастаз рака молочной железы имеет бледно-желтоватый цвет, метастаз кожной меланомы — коричневый. Диагноз устанавливается на основании данных анамнеза, биомикроскопии, общего обследования с целью выявления метастазов в других органах и, главное, данных морфологического исследования биоптата опухоли. Дифференциальный диагноз проводят с первичным плоскоклеточным раком и первичной меланомой конъюнктивы. Лечение паллиативное: локальное облучение. Предпочтение отдают бета-аппликационной терапии.
Злокачественные опухоли слезоотводящих путей
Злокачественные опухоли слезных канальцев и слезно-носового канала — вторичные, распространяющиеся на область слезоотводящих путей из соседних тканей: бульбарной конъюнктивы, слизистой полости носа и т.д.
Злокачественные опухоли слезного мешка представлены раком, меланомой и саркомой. Преобладает рак. По данным А.Ф. Бровкиной (2002), рак слезного мешка составляет до 43%, меланома — 3–4%, а опухоли мезенхимального происхождения до 29% от всех опухолей данной локализации.
Рак слезного мешка
Может быть первичным или развивается из предсуществующей инвертирующей папилломы. В область слезного мешка могут прорастать карциномы гайморовой полости, клеток решетчатого лабиринта и полости носа. Клинически опухоль проявляется длительным упорным слезотечением. При надавливании на область слезного мешка нередко видны сукровичные выделения. При промывании слезоотводящих путей в промывных водах определяется примесь крови. Рано появляется картина дакриоцистита. Может развиться флегмона слезного мешка. По мере роста опухоли в области слезного мешка появляются плотные бугристые массы. Карцинома слезного мешка обладает выраженным инвазивным ростом и склонностью к рецидивированию. При морфологическом исследовании различают: плоскоклеточный рак, аденокарциному и мукоэпидермоидный рак.
Меланома слезного мешка
Характерны быстрые темпы и инвазивный характер роста. Рано появляется сукровичное отделяемое в конъюнктивальной полости — “кровавые слезы”, возникают частые носовые кровотечения. Припухлость в области слезного мешка иногда ошибочно принимают за дакриоцистит неопухолевой природы. После проведения дакриоцисториностомии наблюдается особенно быстрый рост опухоли, выход ее за пределы данного региона и метастазирование.
Саркома слезного мешка
Клинические проявления аналогичны таковым при других злокачественных опухолях слезного мешка. Но скрытый период роста саркомы короче, чем при раке. Рано появляется бугристая плотная опухоль, которую удается пальпировать в области слезного мешка (Офтальмоонкология. Руководство для врачей, 2002).
Прочие опухоли слезного мешка
Известны случаи развития в области слезного мешка неходжкинской лимфомы. Возможно поражение слезного мешка при хронических лейкозах. Заболевание проявляется клинической картиной флегмоны слезного мешка.
Метастазы в слезный мешок возникают чрезвычайно редко и никогда не бывают изолированными.
Диагноз устанавливается на основании данных наружного осмотра и рентгенологического исследования слезоотводящих путей с контрастированием липоидолом ультрафлюидом. На рентгенограммах определяется дефект наполнения слезного мешка с неровными контурами. Обязательным является обследование пациента оториноларингологом. При появлении пальпируемой опухоли в области слезного мешка возможна аспирационная биопсия. Окончательный диагноз устанавливается при морфологическом исследовании удаленного слезного мешка.
Лечение изолированного поражения слезного мешка заключается в его экстирпации с последующим локальным дистанционным облучением. При прорастании опухоли в полость орбиты проводят экстирпацию слезного мешка и экзентерацию орбиты. Прогноз при саркоме и меланоме слезного мешка очень серьезный.
Злокачественные опухоли сосудистой оболочки
Среди злокачественных опухолей сосудистой оболочки глаза встречаются меланома, метастатические опухоли и злокачественная лимфома. Увеальная меланома является наиболее частой внутриглазной опухолью. Ее частота приблизительно в 3,5 раза выше, чем частота ретинобластомы. Глазное яблоко не содержит лимфатических сосудов, поэтому увеальная меланома не метастазирует в регионарные лимфоузлы (N0 по системе ТNM). При гематогенном метастазировании первые метастазы выявляются в печени. Второе место по частоте метастазирования занимают легкие и органы средостения, третье место — головной мозг.
Злокачественные опухоли радужки и цилиарного тела встречаются значительно реже, чем злокачественные опухоли заднего отдела сосудистого тракта — хориоидеи.
Меланома радужки
Составляет около 12% от всех меланом сосудистой оболочки. Возраст больных к моменту выявления меланомы радужки — 40–50 лет, что приблизительно на 10 лет меньше, чем у больных меланомой хориоидеи. Опухоль чаще развивается у белых людей со светлой окраской радужки. Большинство меланом радужки имеют веретеноклеточное строение. Многие больные меланомой имели пигментное пятно на радужке с детства. Это подтверждает мысль о том, что большинство меланом радужки развивается из предсуществующих невусов.
Клиническая классификация по системе TNM:
Т1 — опухоль ограничена только радужкой;
Т2 — опухоль поражает не более одного квадранта и распространяется на угол передней камеры;
Т3 — опухоль поражает более одного квадранта и распространяется на угол передней камеры, цилиарное тело и/или хориоидею;
Т4 — опухоль выходит за пределы глаза;
N0 — (см. выше);
M — отдаленные метастазы в печень, легкие и органы средостения, головной мозг.
Различают узловую и диффузную формы опухоли. Чаще встречается узловая форма роста опухоли. Диффузная форма развивается крайне редко. Узловая форма меланомы сопровождается появлением соответственно локализации опухоли резко расширенных эпибульбарных сосудов. Узел опухоли с нечеткими границами и неравномерной окраской проминирует в переднюю камеру. Степень пигментации варьирует в широких пределах (см. рис. 20 на цветной вклейке). Возможно развитие беспигментной меланомы. На поверхности опухоли видны новообразованные сосуды. Возможно появление спонтанных гифем. Вокруг узла опухоли рисунок радужки деформирован. При локализации опухоли в зрачковой зоне зрачок подтянут к опухолевому узлу. Виден выворот заднего пигментного листка радужки. При локализации опухоли в цилиарном поясе появляется симптом уплощения зрачка на стороне поражения. При распространении опухоли на угол передней камеры появляется помутнение эндотелия роговицы. В результате роста опухоли в заднюю камеру глаза и компрессии хрусталика быстро развивается контактная катаракта. Вокруг опухоли появляется распыление пигмента, нередко формируются пигментные дорожки. Вокруг опухоли и на ее поверхности развиваются дочерние узелки, сателлиты.
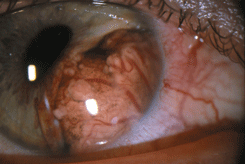
Рисунок 20. Слабопигментированная меланома радужки
Диффузная форма меланомы характеризуется неравномерной пигментацией радужки, которая кажется утолщенной. Радужка становится ригидной, ее рисунок не определяется. Неправильной формы зрачок не реагирует на свет. Рано развивается вторичная глаукома. Анулярным называется рост меланомы вдоль угла передней камеры. Такой рост приводит к повышению внутриглазного давления, прорастанию в цилиарное тело.
Меланома тапиока — особая форма, наиболее сложная для диагностики. Опухоль растет медленно. Чаще расположена в нижней половине радужки. Представлена полупрозрачными пузырьками, которые сливаются между собой. Богато васкуляризирована. При морфологическом исследовании определяется веретеноклеточная меланома типа А. Прогноз для жизни более благоприятный, чем при остальных формах меланомы радужки.
Диагноз устанавливается на основании данных биомикроскопии, гониоскопии, трансиллюминации. Радиоизотопное исследование — 32P тест (см. выше) информативен только при прорастании опухолью угла передней камеры и локализации в области цилиарного тела. Помощь в диагностике может оказать флуоресцентная ангиография (ФАГ) с 10% содовым раствором флуоресцеина натрия. Для меланомы радужки характерными являются интенсивная ранняя флуоресценция, интенсивная фильтрация красителя в экстравазальное пространство и длительная поздняя флуоресценция. Окончательный диагноз устанавливается при морфологическом исследовании локально удаленной опухоли или при исследовании энуклеированного глаза.
Меланому радужки дифференцируют с лейомиомой и метастатической опухолью, кистой пигментного эпителия, мезодермальной дистрофией, воспалительной гранулемой.
Лечение. Небольшие меланомы радужки, занимающие менее 1/3 ее площади, не сопровождающиеся развитием вторичной глаукомы, подвергаются локальной эксцизии. При больших узлах опухоли, диффузных или анулярных меланомах показана энуклеация. Прогноз более благоприятный, чем при меланоме хориоидеи.
Метастаз в радужку
Метастазы в радужку и цилиарное тело возникают приблизительно в 10 раз реже, чем метастазы в хориоидею. Наиболее часто развиваются метастазы рака молочной железы, рака легкого и кожной меланомы. Как правило, наблюдается одностороннее поражение. Опухоль быстро увеличивается в размерах. На стороне поражения радужки видны резко расширенные эпибульбарные сосуды. Метастазы в радужку РМЖ выглядят как рыхлые белые или желтоватые образования с нечеткими границами, вызывающие в той или иной степени деформацию зрачка (см. рис. 21 на цветной вклейке). Такие опухоли внешне напоминают воспалительную гранулему или беспигментную лейомиому, но в отличие от последних характеризуются локальным расширением сосудов на стороне поражения радужки, быстрыми темпами роста опухоли и отсутствием клеточного выпота в стекловидное тело. Метастаз рака легкого — слабо васкуляризированная опухоль с бугристой поверхностью, напоминает беспигментную меланому. Необходимо обратить внимание на то, что на поверхности метастатической опухоли, в отличие от первичных опухолей радужки, как правило, не видно сосудов. Нередко наблюдается многофокусное поражение радужки. Возможен анулярный рост метастатической опухоли вдоль всего угла передней камеры в виде узкой полоски желтоватой ткани, что приводит к развитию вторичной некомпенсированной глаукомы. Метастазы в радужку кожной меланомы имеют вид одного или нескольких пигментированных узлов с нечеткими границами, реже — диффузной инфильтрации радужки пигментированной тканью с формированием задних синехий. Метастатическое поражение радужки и цилиарного тела в 80% случаев сопровождается развитием вторичной глаукомы или иридоциклитом с “сальными” преципитатами на эндотелии. Вторичная глаукома или иридоциклит сопровождаются покраснением глаза и появлением болей. Последнее обстоятельство заставляет больного обращаться к окулисту.
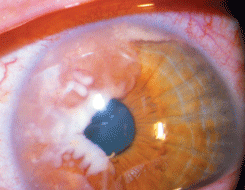
Рисунок 21. Метастаз в радужку РМЖ
Диагноз метастаза в радужку устанавливается на основании типичной клинической картины, наличия онкологического заболевания в анамнезе и информации о поражении других органов.
Локальное иссечение невозможно в связи со склонностью метастатических опухолей к многофокусным поражениям. Выбор метода лечения зависит от общего состояния больного, характера первичной опухоли, ее чувствительности к лекарственной или лучевой терапии. Хороший эффект дает дистанционная лучевая терапия. Облучение (СОД не более 40 Гр) проводят с двух сторон под тупым углом, пытаясь, по возможности, максимально снизить лучевую нагрузку на роговицу (подробно см. “Лучевая терапия метастаза в хориоидею”). В случаях некомпенсированной вторичной глаукомы показана энуклеация.
Меланома цилиарного тела
Редко встречается изолированно и составляет менее 1% от общего числа увеальных меланом. Чаще развиваются иридоцилиарные или цилиохориоидальные опухоли.
Клиническая классификация меланомы цилиарного тела по системе TNM:
Т1 — опухоль ограничена цилиарным телом;
Т2 — опухоль распространяется на переднюю камеру и/или радужку;
Т3 — опухоль распространяется на хориоидею;
Т4 — опухоль распространяется за пределы глаза;
N0 — (см. выше);
M — отдаленные метастазы в печень, легкие и органы средостения, головной мозг.
Опухоль растет медленно. Длительное время единственным симптомом изолированной меланомы цилиарного тела является относительная гипотония пораженного глаза. По мере роста опухоли соответственно локализации меланомы появляются резко расширенные эпибульбарные сосуды. При медикаментозном расширении зрачка в его просвете виден узел опухоли с гладкой поверхностью (см. рис. 22 на цветной вклейке). Передняя камера становится неравномерной: в зоне расположения опухоли радужка выступает кпереди, постепенно закрывает угол передней камеры, вследствие чего развивается вторичная глаукома. При распространении пигментированной меланомы на угол передней камеры появляется симптом “ложного иридодиализа”. Если опухоль прорастает дилятатор радужки, зрачок приобретает неправильную форму (симптом “уплощения зрачка”). Вследствие дислокации хрусталика и развития контактной катаракты снижается острота зрения.
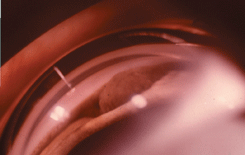
Рисунок 22. Иридоцилиарная меланома. Гониоскопическая картина: в углу передней камеры виден пигментированный узел опухоли
Дифференциальный диагноз проводят с лейомиомой, метастатической опухолью цилиарного тела, кистой пигментного эпителия, стафиломой склеры, катарактой nigra.
Лечение изолированных меланом цилиарного тела: удаление хирургическим путем, проведение склерувеоэктомии. При больших опухолях, сопровождающихся развитием вторичной глаукомы или иридоциклита, показана энуклеация. Прогноз для зрения зависит от размеров опухоли. Прогноз для жизни неблагоприятный.
Метастаз в цилиарное тело
Изолированный метастаз в цилиарное тело развивается крайне редко. Опухоль отличается быстрыми темпами роста, и к моменту ее выявления сопровождается развитием вторичной глаукомы или иридоциклита. Покраснение глаза и боли заставляют пациента обратиться к офтальмологу. Правильному диагнозу помогают данные анамнеза, сведения о наличии метастазов в других органах. Лечение паллиативное. Нередко в связи с выраженным, некупирующимся медикаментозными (антиглаукоматозными) средствами, болевым синдромом приходится удалять пораженный глаз.
Меланома хориоидеи
Болеют преимущественно люди белой расы. Частота заболеваемости зависит от географического расположения местности: в северных странах она выше. В Москве, по нашим данным, частота увеальной меланомы составляет 13,3 на 1 млн взрослого населения. Несколько чаще встречается у женщин. Пик заболеваемости приходится на 60–70 лет. Лица со светлой окраской волос, радужки и глазного дна заболевают меланомой хориоидеи чаще.
Меланома хориоидеи преимущественно возникает de novo. Возможно развитие меланомы из предсуществующего невуса хориоидеи или на фоне окулодермального меланоза.
По данным А.Ф. Бровкиной (2002), меланома хориоидеи преимущественно (57%) локализуется в постэкваториальной зоне, при чем чаще в нижневисочном квадранте. В экваториальной зоне развивается около 26%, а в предэкваториальной, включая цилиохориоидальные опухоли — только 17%. Как правило, поражается один глаз. Двусторонние меланомы хориоидеи встречаются крайне редко (2,2%).
Клиническая классификация меланомы хориоидеи по системе TNM:
Т1 — опухоль до 10 мм в наибольшем диаметре и толщиной до 3 мм;
Т1a — опухоль до 7 мм в наибольшем диаметре и толщиной до 2 мм;
Т1b — опухоль до 10 мм в наибольшем диаметре и толщиной до 3 мм;
Т2 — опухоль от 10 до 15 мм в наибольшем диаметре и толщиной от 3 до 5мм;
Т3 — опухоль свыше 15 мм в наибольшем диаметре и толщиной более 5 мм;
Т4 — опухоль любых размеров распространяется за пределы глаза;
N0 — (см. выше);
M — отдаленные метастазы в печень, легкие и органы средостения, головной мозг.
В начальной стадии меланома хориоидеи представляет собой плоский, или слегка проминирующий в стекловидное тело, очаг с нечеткими границами и неравномерной пигментацией. Рано возникает плоская вторичная отслойка сетчатки, которая усиливает смазанность, стушеванность границ образования.
В этой стадии развития меланому необходимо дифференцировать с невусом хориоидеи. Меланома хориоидеи имеет пеструю окраску. В отличие от невуса хориоидеи при офтальмоскопии с зеленым фильтром изображение меланомы не исчезает. Меланома хориоидеи всегда сопровождается появлением в той или иной степени дефектов поля зрения. Большую помощь в дифференциальной диагностике начальных меланом и невусов хориоидеи оказывает ФАГ.
По мере роста меланомы она приобретает правильную полушаровидную форму, на ее поверхности появляются пятна оранжевого пигмента, которые обусловлены отложением липофусцина в пигментном эпителии сетчатки (см. рис. 23 на цветной вклейке). На поверхности опухоли видны широкие извитые новообразованные сосуды. Ретинальные сосуды над опухолью уплощаются. На поверхности опухоли появляются кровоизлияния. Увеличивается вторичная отслойка сетчатки. Иногда формируется так называемая грибовидная форма опухоли (см. рис. 24, 25 на цветной вклейке). Такая опухоль имеет довольно широкое основание, узкий перешеек и шаровидную головку. Головка опухоли нередко прорастает сетчатку и тогда в стекловидном теле можно видеть взвесь опухолевых клеток. Из новообразованных сосудов опухоли возникают субретинальные кровоизлияния с последующим развитием гемофтальма.
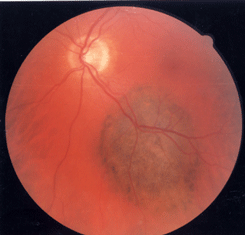
Рисунок 23. Меланома хориоидеи в нижненаружном квадранте глазного дна. На поверхности опухоли видны пятна оранжевого пигмента
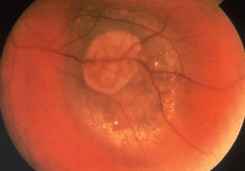
Рисунок 24. Грибовидная форма меланомы хориоидеи

Рисунок 25. Энуклеированный глаз. Видна грибовидная форма меланомы хориоидеи
К особым клиническим формам следует отнести меланому с плоскостным ростом. Плоскостная меланома составляет около 7% от хориоидальных меланом. Опухоль характеризуется увеличением по площади, при этом высота ее остается практически неизменной, не более 2,0–2,5 мм. Клинически проявляется усиленной неравномерной пигментацией глазного дна. Такая опухоль рано прорастает зрительный нерв или склеру (см. рис. 26 на цветной вклейке).
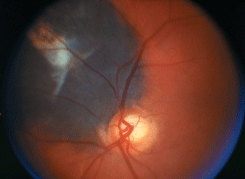
Рисунок 26. Меланома хориоидеи в верхненаружном квадранте глазного дна с плоскостным ростом
Некротическая форма меланомы возникает при ее тотальном некрозе. Токсическое воздействие распадающейся опухоли приводит к дистрофическим и воспалительным явлениям во всех оболочках глаза. Симптомы развиваются остро. Резко снижена острота зрения, нередко до полной слепоты. Появляются отек век, хемоз, смешанная инъекция глаза, небольшой экзофтальм с ограничением подвижности глаза. Роговица отечная, с дистрофическими изменениями, с изъязвлением, передняя камера мелкая, радужка отечная с расширенными сосудами, рефлекс с глазного дна отсутствует. При морфологическом исследовании энуклеированого глаза выявляется распад опухоли.
В ряде случаев меланому хориоидеи можно распознать только по косвенным признакам. К ним относят: увеит, иридоциклит, склерит, эндофтальмит или панофтальмит; гемофтальм, вторичную глаукому, осложненную катаракту, субатрофию глаза, экспульсивное кровотечение.
Вторичная глаукома — один из важнейших и наиболее часто встречаемых косвенных признаков меланомы хориоидеи, как правило, встречается при больших предэкваториальных опухолях, реже опухолях других локализаций. При выявлении односторонней глаукомы в глазу с низкой остротой зрения врач прежде всего должен исключить внутриглазную опухоль. Причины развития вторичной, обусловленной ростом опухоли, гипертензии различны. Внутриглазное давление может повышаться в связи со смещением вперед иридохрусталиковой диафрагмы, в результате затруднения путей оттока камерной влаги при закрытии трабекулярной сети опухолевыми клетками, белками, элементами крови. Возможно развитие рецессии угла передней камеры или сдавление опухолью вортикозной вены.
Меланома хориоидеи реже, чем иридоцилиарные меланомы сопровождается развитием осложненной катаракты. Помутнение хрусталика обычно появляется поздно на фоне вторичной гипертензии, гемофтальма, тотальной отслойки сетчатки.
Гемофтальм может быть одним из первых признаков активно растущей опухоли. После проведения рассасывающей терапии, когда глазное дно становится доступным осмотру, выявляют меланому хориоидеи.
Увеит, иридоциклит, реже эндофтальмит или панофтальмит возникают при некрозе и лизисе больших меланом хориоидеи (Tabssian A., Zuravleff J., 1995). Еще реже развивается склерит. Его локализация совпадает с проекцией опухоли. Развивается при предэкваториальных меланомах. Клинические проявления идентичны картине неспецифического склерита. Наблюдается локальное утолщение склеры, выраженная локальная болезненность, инъекция сосудов склеры и эписклеры в зоне поражения. Местное применение кортикостероидов дает временный эффект. По данным А.Ф. Бровкиной (2002), склерит не связан с инвазией склеры опухолевыми клетками, а имеет неспецифический характер.
При тотальном некрозе большой хориоидальной меланомы на фоне выраженной гипертензии может произойти перфорация язвы роговицы и возникнуть экспульсивное кровотечение. Подобное состояние возникает редко, как правило, у пожилых ослабленных людей.
Субатрофия глаза редко сопровождает развитие меланомы хориоидеи. Опухоль бывает случайной находкой морфолога при исследовании энуклеированного глаза.
При морфологическом исследовании выделяют веретеноклеточную (типы А и тип В) и эпителиоидную меланомы. Промежуточное положение занимает смешанная меланома. Все три морфологических варианта меланомы хориоидеи встречаются приблизительно с одинаковой частотой. Клеточное строение опухоли является одним из важных прогностических признаков. В оценке прогноза уделяют большое внимание цитологической характеристике опухолевых клеток. Оценивают размеры ядер, ядрышек, степень митотического индекса, степень пигментации опухолевых клеток. Обращают внимание на наличие лимфоцитарной инфильтрации опухоли, которую рассматривают как иммунный ответ организма на опухоль.
Диагностика меланомы хориоидеи представляет большие трудности в связи с многообразием клинических форм. При обследовании пациента с подозрением на меланому хориоидеи кроме обычного офтальмологического исследования, включающего визометрию, периметрию, тонометрию, биомикроскопию, офтальмоскопию, большую помощь в установлении диагноза оказывают инструментальные методы исследования. При больших пигментированных опухолях с распространением в область экватора и предэкваториальную зону информативны диафаноскопия и трансиллюминация. При трансиллюминации в зоне проекции опухоли на склере наблюдается дополнительная тень. Однако в случае беспигментных опухолей или при постэкваториальной локализации меланомы тень на склере не выявляется. С другой стороны, массивные ретинальные и субретинальные кровоизлияния при трансиллюминации могут вызывать затемнение склеры. Высокоинформативным является радиоизотопный метод исследования, 32Р-тест (см. выше). Чем толще исследуемая опухоль, тем более точными будут показатели исследования. При исследовании плоских опухолей можно получить ложно отрицательный счет. Ультразвуковое сканирование (В-метод) является важным методом исследования, особенно при недостаточно прозрачных преломляющих средах, когда офтальмоскопировать опухоль на глазном дне не представляется возможным. Меланома хориоидеи на сканограмме имеет вид образования правильной полушаровидной, в редких случаях грибовидной, формы. У большинства больных в области основания опухоли видна экскавация хориоидеи. С помощью одномерной эхографии (А-метод) определяют размеры опухоли: ее наибольший диаметр и проминенцию (толщину). КТ и МРТ орбит позволяют обнаружить меланому средних и больших размеров, уточнить ее локализацию. Эти методы особенно полезны при подозрении прорастания опухолью фиброзной капсулы глаза. ФАГ — незаменимый метод диагностики маленьких меланом, при которых другие методы диагностики малоинформативны. ФАГ используется для дифференциальной диагностики невусов и начальных меланом хориоидеи (Andersen M., Scherfig E., Prause J., 1995). ФАГ при меланоме хориоидеи характеризуется пятнистой гиперфлуоресценцией, длительным остаточным окрашиванием опухоли, наличием новообразованных сосудов опухоли и ярко светящихся друз. Начинаясь к концу артериальной фазы, пятнистая флуоресценция сохраняется на протяжении всей венозной фазы и постепенно переходит в сливную флуоресценцию поздней венозной фазы (через 1 ч и более после введения флуоресцеина натрия). Главным источником появления пятнистой флуоресценции меланомы является пропотевание красящего вещества из новообразованных сосудов опухоли. Пятна гиперфлуоресценции чередуются с участками гипофлуоресценции, которые обусловлены появлением очагов пролиферации пигментного эпителия сетчатки, образованием полей оранжевого пигмента (см. выше), геморрагиями, субретинальным экссудатом. Новообразованные сосуды опухоли выявляются в ранней артериальной фазе и лучше видны при исследовании амеланотических опухолей. Это резко укороченные и деформированные сосуды. А.Ф. Бровкина (2002) указывает на феномен двойного кровоснабжения опухоли. При проминенции опухоли более 7 мм удается выявить образование шунтов между сосудами опухоли и ретинальными сосудами. Бордюр из ярко флуоресцирующих друз, расположенных по периферии опухоли, выявляется обычно при небольшой меланоме и свидетельствует о ее активном росте. Аспирационная биопсия может быть рекомендована только в сложных диагностических случаях, когда другие неинвазивные методы оказались несостоятельными для установления диагноза. Больные увеальной меланомой проходят полный комплекс обследования онкологом для исключения метастазирования к моменту выявления внутриглазной опухоли, включая исследование ферментов печени, УЗИ и радиоизотопное исследование, КТ печени, рентгенографию легких и органов средостения.
Дифференциальный диагноз меланомы хориоидеи приходится проводить со многими заболеваниями как опухолевой, так и неопухолевой природы. Из опухолей сходную с меланомой хориоидеи клиническую картину могут иметь меланоцитома, гемангиома, метастатическая опухоль, злокачественная лимфома. Начальную меланому необходимо отличать от невуса хориоидеи, особенно с друзами в прилежащей сетчатке. Трудность представляет и дифференциальная диагностика метастатической опухоли и меланомы хориоидеи. При выявлении внутриглазной опухоли у больного с онкологическим заболеванием в анамнезе перед врачом встает сложная задача правильной диагностики характера поражения глаза. Своевременное определение природы внутриглазной опухоли имеет решающее значение для планирования адекватного лечения. Наличие в анамнезе больного онкологического заболевания не означает, что внутриглазная опухоль является метастазом. Возможно развитие у одного больного нескольких злокачественных опухолей (первично-множественные злокачественные опухоли). По нашим данным, увеальная меланома чаще всего развивается у больных РМЖ, раком кожи, раком матки, раком кишечника. Первичная меланома хориоидеи может возникать синхронно с другими злокачественными опухолями, предшествовать им или развиваться в различные сроки после их выявления.
Среди заболеваний глаза неопухолевой природы наиболее часто меланому хориоидеи приходится дифференцировать с псевдотуморозной формой центральной хориоретинальной дегенерации, старым субретинальным или субхориоидальным кровоизлиянием, геморрагической отслойкой пигментного эпителия сетчатки, с врожденной или приобретенной гиперплазией пигментного эпителия сетчатки, реактивным глиозом сетчатки и т.д.
Лечение меланомы хориоидеи. При выборе метода лечения меланомы хориоидеи руководствуются стадией заболевания. При отсутствии отдаленных гематогенных метастазов планируют лечение внутриглазной опухоли. При выборе метода лечения меланомы хориоидеи руководствуются возрастом больного и его соматическим состоянием, размерами опухоли, ее локализацией, состоянием зрительных функций пораженного и парного глаза, возможными осложнениями. А.Ф. Бровкина (2002) предлагает следующую схему лечения меланомы хориоидеи: органосохранное лечение возможно при меланомах предэкваториальной локализации, достигающих в наибольшем диаметре 10 мм и высотой не более 5 мм. При постэкваториальной локализации опухоли проводят органосохранное лечение меланом с диаметром, не превышающим 15 мм и высотой не более 6,5 мм. При юкстапапиллярной локализации меланомы ее проминенция не должна превышать 3 мм.
Транспупиллярную лазерную коагуляцию как самостоятельный метод используют только в лечении меланом с небольшой толщиной (не более 1,5 мм). Для лазерной коагуляции опухолей используют аргоновый или диодный лазеры. Лечение проводится в амбулаторных условиях под местной анестезией. Обязательным требованием к проведению лазерной коагуляции опухоли являются прозрачные преломляющие среды и возможность максимального медикаментозного мидриаза (для чего используют подконъюнктивальную инъекцию 1% раствора фенилэфрина). Лечение начинают с нанесения отграничительного барьера на расстоянии 1000–1500 мкм от границ опухоли. Истинным размерам опухоли наиболее соответствуют размеры, определяемые при ангиографическом исследовании. Разрушение опухоли проводят через 3–4 нед, когда вокруг опухоли сформируется хориоретинальный рубец. Наносят лазеркоагуляты черепицеобразно от периферии к центру. Величина светового пятна — 500–1000 мкм; эскпозиция — 0,5–1,0 с; мощность светового потока — 700–850 мВт. Замещение опухоли рубцовой тканью происходит через 2 мес. К осложнениям разрушительной лазеркоагуляции следует отнести появление ретинальных кровоизлияний, не только над опухолью, но и дистантно, и развитие гемофтальма.
Отграничительная лазерная коагуляция проводится в качестве первого этапа лечения перед бета-аппликационной брахитерапией меланом средних размеров.
Криодеструкция меланомы хориоидеи в настоящее время проводится редко. В качестве хладагента используется жидкий азот. Криоаппликация осуществляется через склеру в зоне проекции опухоли. К осложнениям следует отнести развитие тотальной отслойки сетчатки, тромбоза центральной вены сетчатки, гемофтальма. После избыточного перемораживания может возникнуть субатрофия глаза.
Трансклеральная брахитерапия (бета-аппликационная) — основной метод лечения экваториальных и постэкваториальных меланом средних размеров. Максимальная высота опухоли составляет 6,5 мм, максимальный диаметр — 14 мм. В последнее время появились сведения о потенциирующем воздействии РФП 59Fe, расширяющем возможности брахитерапии (сочетанная лучевая терапия) (Бровкина А.Ф., Кешелава В.В., 2001; Бровкина А.Ф., 2003). По мнению авторов, радионуклид 59Fe избирательно накапливается в ткани меланомы и оказывает на нее разрушающее воздействие. Кроме того, длительный прием 59Fe, возможно, превентивно воздействует на гематогенные метастазы.
При проведении бета-аппликационной брахитерапии внутриглазных опухолей применяют стронциевые и рутениевые аппликаторы. Аппликатор подшивают в условиях общей анестезии на склеру в зоне проекции опухоли с применением микрохирургической техники. Дозу рассчитывают на “верхушку” опухоли в зависимости от размера опухоли (ее высоты) и вида аппликатора. При использовании стронциевых аппликаторов доза должна составлять не менее 270 Гр, а при использовании рутениевых аппликаторов — не менее 100 Гр. Аппликатор подшивают на склеру в зоне проекции опухоли так, чтобы его край перекрывал на 2–3 мм границы опухоли. Время контакта аппликатора со склерой зависит от запланированной дозы. Контроль положения аппликатора производят с помощью ультразвукового сканирования. Удаляют аппликатор под местной анестезией. Хориоретинальный рубец на месте опухоли формируется не ранее 9–12 мес. после окончания лечения.
Наличие непрозрачных преломляющих сред не является противопоказанием к проведению брахитерапии, хотя осложняет впоследствии динамическое наблюдение за очагом.
Различают ранние и поздние осложнения бета-аппликационной брахитерапии. Во время проведения брахитерапии при подшивании аппликаторов большого диаметра возможно развитие реактивной внутриглазной гипертензии. После удаления аппликатора внутриглазное давление нормализуется без какого-либо специального лечения. Сразу после операции может возникнуть парез экстраокулярной мышцы, который проходит самостоятельно через 2–3 нед. Лучевой иридоциклит редко возникает при облучении больших экваториально расположенных меланом. Обычно сопровождается гипертензией и требует местного применения кортикостероидов, мидриатиков, местных и общих гипотензивных средств. Реактивная экссудативная отслойка сетчатки возникает при облучении больших меланом и имеет склонность к самопроизвольной регрессии по мере стихания лучевой реакции. Отграничительная лазерная коагуляция, предшествующая брахитерапии, снижает риск развития экссудативной отслойки сетчатки. Лучевой васкулит и гемофтальм возникают при облучении больших опухолей рутениевым аппликатором. К необратимым осложнениям относятся ретинопатия, нейропатия, неоваскулярная глаукома. Эти осложнения возникают при облучении больших опухолей рутениевыми аппликаторами. Наличие у больного сосудистых заболеваний, прежде всего при сахарном диабете, повышает риск развития осложнений. Неоваскулярная глаукома — наиболее серьезное осложнение брахитерапии — развивается приблизительно через год после лечения в ответ на ишемизацию большого участка сетчатки. Неоваскулярная глаукома с выраженным болевым синдромом — основная причина энуклеации глаза в позднем постлучевом периоде.
Эффективность бета-аппликационной брахитерапии составляет 70–73% при пятилетнем сроке наблюдения (Бровкина А.Ф., Зарубей Г.Д., 1993).
Дистанционная лучевая терапия меланомы хориоидеи осуществляется узким медицинским протонным пучком. Применение узкого медицинского протонного пучка основано на его свойствах. Небольшое рассеивание, строго определенный пробег в тканях и пик ионизации (пик Брега) в конце пробега позволяют подвести к внутриглазной опухоли деструктивные дозы излучения при минимальном повреждении окружающих тканей.
Протонотерапия проводится в случаях, когда другие методы органосохранного лечения хориоидальных меланом оказываются неэффективными: при локализации меланомы в юкстапапиллярной и предэкваториальной зонах. Рецидив опухоли в орбите после энуклеации также является показанием к применению протонотерапии. При лечении меланомы хориоидеи используют облучение СОД 70–80 Гр за 7–10 фракций (Бровкина А.Ф., Зарубей Г.Д., 1987). Рецидивы меланомы после протонотерапии возникают у 3–5% больных (Gragoudas E., Egan K., Seddon J. et al., 1992). К осложнениям протонотерапии следует отнести кератопатию, гемофтальм, ретинопатию.
Хирургическое лечение меланомы хориоидеи заключается в локальной резекции опухоли (склероувеоэктомии или ретинохориоидэктомии) и энуклеации. Сложность хирургической техники, возможность гематогенного диссеминирования во время операции, наличие у пациента серьезных соматических заболеваний — ограничивают применение локальной резекции опухоли. Ламелярная склерувеоэктомия (блокэксцизия) применяется при предэкваториальной локализации меланомы с небольшим диаметром и значительной высотой. Ретинохориоидэктомия (эндорезекция) показана при небольших меланомах (с диаметром менее 8 мм и высотой не более 4 мм), расположенных в юкстапапиллярной зоне (Robertson D., Campbell R., Weaver D., 1991; Domato B., Grochewald C., McGalliard J., Wong D., 1998). Имеются данные о резекции маленьких меланом, расположенных в макулярной области без удаления прилежащей сетчатки с целью сохранения высокой остроты зрения в послеоперационном периоде (Peyman G., Nelson N., Paris C., 1992).
Осложнения локальной резекции. Во время операции возникают кровоизлияния в хориоидею, геморрагическая отслойка хориоидеи, гемофтальм и экспульсивное кровотечение. В послеоперационном периоде часто развивается преретинальная мембрана, тракционная отслойка сетчатки, катаракта (Domato B., Grochewald C., McGalliard J., Wong D., 1998).
Энуклеация до середины 70-х гг. ХХ в. была единственным методом лечения внутриглазных опухолей. В настоящее время она отходит на второй план и применяется только при очень больших опухолях и в случаях развития вторичной глаукомы. Энуклеация по поводу внутриглазной опухоли проводится под общей анестезией, без ретробульбарной инъекции. Это связано с резким кратковременным повышением внутриглазного давления в момент ретробульбарной инъекции, что может способствовать гематогенной диссеминации опухолевых клеток. Абластичное удаление глаза требует применения щадящей техники операции, исключения резких манипуляций инструментами. При выходе опухоли за пределы глаза показана расширенная энуклеация (удаление глазного яблока с ретробульбарной клетчаткой и экстраокулярными мышцами) или поднадкостничная экзентерация. Предоперационная дистанционная лучевая терапия неэффективна.
Термотерапия меланомы хориоидеи относится к сравнительно молодым методам лечения. Сущность метода заключается в локальном повышении температуры в опухоли до 45|°C|, при этом происходит разрушение опухоли при сохранении нормальных структур глаза. Для термотерапии используют диодовый лазер, работающий в диапазоне инфракрасного излучения с длиной волны 810 нм. Правильный подбор длины волны, величины светового пятна и времени экспозиции обеспечивают не коагуляцию тканей, а ее нагревание. Если при лазерной коагуляции происходит некроз опухоли на глубине до 1 мм, то при термотерапии разрушение опухоли распространяется на глубину до 4 мм (Journee de Korver H., Oosterhuis I., de Woif-Rouendaal D., Kemme H., 1997). Наиболее распространена транспупиллярная термотерапия (ТТТ). Термотерапия показана при постэкваториальных меланомах, особенно при их макулярной и юкстапапиллярной локализации. Условия для проведения ТТТ такие же, как и для лазерной коагуляции опухоли: прозрачность преломляющих сред, возможность максимального медикаментозного мидриаза и твердой фиксации головы пациента. Термотерапия может применяться как самостоятельный метод лечения, так и в сочетании с брахитерапией. Величина светового пятна при термотерапии — 3–4,5 мм, при лечении опухолей у диска зрительного нерва или в макулярной области уменьшается до 2 мм. Время экспозиции — 1 мин. Лечение начинают с центра опухоли при минимальной мощности. Постепенно мощность увеличивают до появления серого пятна на поверхности опухоли. При слабопигментированных опухолях (Shields J et al., 1998) рекомендуют в/в введение индоцианина зеленого (Shields C., Shields J., Cater J. et al., 1998). Частичную регрессию опухоли можно наблюдать уже через месяц после лечения. К осложнениям термотерапии следует отнести гемофтальм, тракционную отслойку сетчатки, развитие неоваскулярной мембраны сетчатки и тромбоз центральной вены сетчатки.
Метастаз в хориоидею
Внутриглазные метастазы составляют более 80% от метастатического поражения органа зрения. Преимущественно поражаются задние отделы сосудистого (увеального тракта). Метастазы в хориоидею встречаются в 10 раз чаще, чем в радужку и цилиарное тело.
Внутриглазные метастазы развиваются у 7,3% больных злокачественными опухолями (Nelson C., 1983). Существует точка зрения, что процент прижизненной диагностики внутриглазных метастазов в несколько раз ниже, чем при аутопсийных исследованиях. Так В. Eliasi-Rad et al. при вскрытии 741 больного, умершего от рака, у 12,6% обнаружили внутриглазные метастазы (Eliassi-Rad B., Albert D.M., Green W.R., 1996). Возможно и эти данные не отражают частоту метастатического поражения органа зрения, так как производят вскрытие далеко не каждого больного, умершего от злокачественной опухоли, а если вскрытие и производится, то глазное яблоко часто исключается из гистологического исследования. Таким образом, истинная частота внутриглазных метастазов может быть значительно выше. Рост в последние годы частоты метастатических опухолей органа зрения, по всей вероятности, связан с увеличением продолжительности жизни онкологических больных. C.F. Merrill et al. сообщают, что среди метастатического поражения различных органов при РМЖ внутриглазные метастазы составляют 30% (Merrill C.F; Kaufman D.I; Dimitrov N.V., 1991). Существует даже точка зрения, что частота внутриглазных метастазов выше, чем первичных увеальных меланом (International ophthalmology clinics. Recent advances in ocular oncology, 1997). Последнее утверждение сомнительно, хотя очевидно, что офтальмологи выявляют далеко не все случаи метастатического поражения органа зрения, и значительная часть бессимптомно протекающих метастазов так и остается не диагностированной. С разной частотой практически все злокачественные опухоли метастазируют в хориоидею. Но преобладают метастазы РМЖ и рака легкого. Следует особо подчеркнуть, что у 11,2% больных метастатическое поражение органа зрения может быть первым проявлением скрыто протекающей первичной опухоли. Скрытое течение первичной опухоли характерно, в основном, для рака легкого. У 70% больных одновременно с метастатическими опухолями органа зрения выявляются метастазы в других органах. Обращает на себя внимание частое сочетание метастазов в орган зрения и в головной мозг и/или кости черепа. При выявлении метастазов РМЖ и рака легкого в глаз необходимо проводить компьютерную томографию головного мозга для своевременной диагностики синхронных метастатических поражений головного мозга и органа зрения.
Метастатические опухоли хориоидеи, как правило, характеризуются быстрыми темпами роста и нарастанием симптоматики. Основным симптомом хориоидальных метастазов является снижение остроты зрения. Это обусловлено преимущественной локализацией метастатической опухоли в центральных отделах глазного дна. Следует отметить, что приблизительно у 10% больных метастазы в хориоидею не сопровождаются какими-либо субъективными жалобами и выявляются случайно при профилактическом осмотре.
На ранних стадиях метастаз в хориоидею выглядит как желтовато-беловатый рыхлый очаг с нечеткими границами. Для хориоидальных метастазов РМЖ характерно увеличение опухоли по площади при незначительном росте в высоту — “стелющаяся опухоль” (см. рис. 27 на цветной вклейке). По мере роста опухоли появляется высокая вторичная отслойка сетчатки, как правило, с выраженным транссудатом. Отслойка сетчатки возникает не только над опухолью, но и в отдалении от нее. При раке легкого (см. рис. 28 на цветной вклейке), щитовидной железы, кишечника, как правило, формируется умеренно проминирующий узел опухоли неправильной формы, нередко “двугорбый” или “трехгорбый”. Узловую форму роста метастатической опухоли при раке легкого, раке щитовидной железы приходится дифференцировать с беспигментной меланомой хориоидеи. В отличие от последней на поверхности метастатической опухоли не бывает кровоизлияний. Нередко наблюдается многофокусное поражение хориоидеи. У каждого пятого больного с хориоидальными метастазами выявляется поражение обоих глаз. При УЗИ метастазов отмечается небольшая плотность опухоли, ее малая проминенция при относительно большом диаметре. Для метастатической опухоли характерна неправильная полигональная форма опухоли. Нередко при двумерном эхографическом исследовании метастатическая опухоль определяется в виде локального утолщения оболочек. ФАГ метастатической опухоли характеризуется на ранних стадиях исследования очагом гипофлуоресценции и появлением на периферии опухоли мелких флуоресцирующих пятнышек, которые чередуются с мелкоточечными очажками гиперфлуоресценции — симптом “россыпи крупы”. Очажки яркой мелкоточечной гиперфлуоресценции сохраняются на протяжении всего времени исследования. В поздних фазах появляется диффузная слабоконтрастная гиперфлуоресценция зоны опухоли.
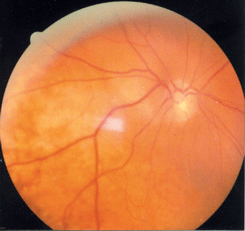
Рисунок 27. Метастаз РМЖ в хориоидею
Рисунок 28. Метастаз рака легкого в хориоидею
Диагноз внутриглазного метастаза устанавливается на основании типичной клинической картины, наличия онкологического заболевания в анамнезе и информации о поражении других органов. В редких случаях нетипичной клинической картины при отсутствии данных о поражении других органов для уточнения диагноза возможно проведение тонкоигольной аспирационной биопсии.
Лечение хориоидальных метастазов проводится с паллиативной целью. Выбор метода лечения зависит от характера первичной опухоли, ее чувствительности к лекарственной и/или лучевой терапии. Хороший эффект дает дистанционная лучевая терапия (Михина З.П., Гришина Е.Е., Стенько З.Л., 2000). При локальном облучении внутриглазных метастазов, особенно при двустороннем поражении, применяют два узких встречных боковых поля.
При одностороннем поражении хориоидеи облучение внутриглазного метастаза осуществляют с двух узких полей под углом 90–120°C, расположенных таким образом, чтобы на передние отрезки глаза доза не превышала 20–30% очаговой.
Для создания узких пучков при гамма-терапии необходимо использовать коллиматоры, которые входят в комплект формирующих устройств, предназначенных для гамма-аппаратов. При лечении на ускорителях конструкция аппарата позволяет применять поля шириной 2–3 см.
Планирование дозы ионизирующего излучения целесообразно проводить с учетом размеров внутриглазных опухолей: для малых опухолей (с проминенцией до 2,5 мм и диаметром до 11,0 мм) СОД в 36–40 Гр и для больших опухолей (с проминенцией более 2,5 мм и диаметром более 11,0 мм и обширной отслойкой сетчатки) в 40–46 Гр по изоэффекту. Разовая доза колеблется от 2 до 2,6 Гр. Применение СОД ионизирующего излучения более 50 Гр не оправдано, т.к. повышает риск развития лучевых осложнений. Повторное облучение, как правило, вызывает развитие лучевых осложнений. Есть сообщения об успешном применении брахитерапии в лечении хориоидальных метастазов (Shields C., Shields J., De Potter P., 1997). Однако возможность многофокусного поражения и инвазивный характер лечения ограничивают применение бета-аппликационной брахитерапии с паллиативной целью.
Анализ эффективности различных методов лечения внутриглазных метастазов показал, что целесообразно для закрепления эффекта химиотерапии проведение дополнительной локальной лучевой терапии на область пораженного глаза. В тех случаях, когда глаз является единственным проявлением генерализации опухолевого процесса, показана лучевая терапия внутриглазного метастаза, а назначение химиотерапии необходимо резервировать.
Лучевую терапию нужно начинать как можно раньше, так как быстрое прогрессирование опухоли может сопровождаться развитием высокой вторичной сетчатки, что отрицательно отразится на результатах лечения.
Одновременное облучение окулоорбитальной области и головного мозга исключает необходимость повторной лучевой терапии глаза и снижает риск лучевых осложнений.
Выбор оптимальной дозы облучения, в зависимости от размеров метастатической опухоли и методики облучения с выведением из зоны облучения оптических сред глаза, обеспечивает высокую эффективность лучевого метода лечения и позволяет избежать лучевых осложнений. В результате лучевой терапии удается сохранить высокую остроту зрения (выше 0,3) у 70% больных.
Ранняя диагностика и своевременное лечение метастатических опухолей органа зрения позволяют предупредить слепоту, развитие болевого синдрома, обусловленного вторичной глаукомой, и улучшить качество жизни наиболее тяжелой категории онкологических больных с метастатическим поражением органа зрения. Прогноз для жизни неблагоприятный.
Злокачественные внутриглазные лимфомы
Внутриглазные злокачественные лимфомы встречаются крайне редко, составляют менее 1% случаев опухолевого поражения органа зрения и, как правило, сочетаются с поражением ЦНС (Cher L., 1998). Основным симптомом внутриглазной лимфомы является снижение остроты зрения. Клинические проявления внутриглазной лимфомы характеризуются полиморфизмом. Внутриглазная лимфома проявляется, как правило, не поддающимся лечению увеитом (Бровкина А.Ф., Гришина Е.Е., 2000; Бровкина А.Ф., Сорокина М.Н., Каплина А.В., 1990), который может сопровождаться экссудативной отслойкой сетчатки, иногда с кровоизлияниями в стекловидное тело (Yoshizawa T., Makiyama Y., Nakazato K. et al., 1994) или склеритом (Бровкина А.Ф., Сорокина М.Н., Каплина А.В., 1990). Нередко наблюдается двусторонний процесс. Внутриглазная лимфома может выглядеть в виде васкулита сетчатки, ретинита, вплоть до ретинального некроза (Brown S.M., Jampol L.M., Cantrill H.L., 1994). Возможно нарушение кровообращения в центральной артерии сетчатки или ее ветвей. Значительно реже развиваются опухолеподобные изменения в радужке и на глазном дне, которые ошибочно принимают за увеальную меланому или метастаз в сосудистую оболочку солидной опухоли. По нашим данным, опухолеподобные образования на глазном дне больше характерны для первичной внутриглазной лимфомы, тогда как при диссеминированных лимфомах поражение глаза выглядит в виде увеита (Бровкина А.Ф., Гришина Е.Е., 2000).
Злокачественные опухоли орбиты
Представлены полиморфной по гистогенезу группой опухолей. Среди первичных злокачественных опухолей в орбите встречаются злокачественная лимфома, рак, саркома и т.д. В ткани орбиты могут метастазировать многие опухоли, прежде всего эпителиального происхождения. Частота первичных злокачественных опухолей орбиты не превышает 0,1% от всех злокачественных опухолей (Болезни орбиты, 1993).
Общими для злокачественных опухолей орбиты является раннее появление диплопии, интермитирующего отека век, экзофтальма. При развитии болевого синдрома боль, как правило, иррадиирует в затылочную область.
Злокачественные лимфомы орбиты
Представлены в основном НХЛ. Относятся к наиболее часто встречающимся злокачественным опухолям орбиты.
НХЛ орбиты, глаза и его вспомогательного аппарата, по данным Canellos G.P. et al. (1997), составляют 4,1% от числа экстранодальных лимфом. Разные структуры вовлекаются в процесс с неодинаковой частотой. Около половины всех злокачественных лимфом органа зрения составляют орбитальные НХЛ.
Несмотря на небольшой удельный вес НХЛ органа зрения в структуре злокачественных опухолей, в практике офтальмолога они встречаются часто. По данным А.Ф. Бровкиной (1993), орбитальные лимфомы составляют 37,3% всех злокачественных опухолей орбиты. В последние годы отмечается рост частоты лимфом органа зрения, что связывают с увеличением числа больных с различными формами иммунодефицита, в том числе ростом количества ВИЧ-инфицированных пациентов и больных с различными аутоиммунными заболеваниями. Орбитальные лимфомы у больных СПИДом характеризуются крайне агрессивным течением и сопровождаются болевым симптомом (Rahhal R.M., Rosberger D.F., Heinemann M.H., 1994).
Заболевание чаще встречается у женщин в возрасте 50–60 лет.
Преобладают первичные экстранодальные злокачественные лимфомы орбиты. При диссеминированных формах лимфом вовлечение в процесс тканей орбиты встречается реже.
Клиника орбитальной лимфомы у большинства больных характеризуется постепенным нарастанием симптоматики и во многом зависит от локализации опухоли: при пристеночной локализации — развивается экзофтальм со смещением глаза в противоположную сторону, по мере роста опухоли увеличивается экзофтальм, затрудняется репозиция. При появлении опухоли в области мышечной воронки развивается осевой экзофтальм (т.е. экзофтальм без смещения глаза). Экзофтальм и птоз — наиболее частые симптомы орбитальной лимфомы. Степень экзофтальма варьирует в широких пределах от 1 до 11 мм, но чаще встречается умеренный экзофтальм до 5 мм, безболезненный, постепенно развивающийся. Прорастание опухолью экстраокулярных мышц сопровождается ограничением подвижности глаза и диплопией (см. рис. 29 на цветной вклейке). Реже процесс развивается быстро, сопровождается быстрым увеличением экзофтальма, вызывает повышение орбитального давления, что приводит к внутриглазной гипертензии, развитию хемоза , сдавлению зрительного нерва и снижению остроты зрения. Повышение внутриглазного давления сопровождается застойной инъекцией сосудов глазного яблока. При экзофтальме большой степени и отсутствии смыкания век развиваются кератопатия и смешанная инъекция глазного яблока.
Рисунок 29. Неходжкинская лимфома орбиты. Ограничение подвижности левого глаза кверху
На компьютерных томограммах орбитальные лимфомы выглядят как одиночные или множественные опухоли негомогенной структуры с нечеткими границами. Изолированное поражение экстраокулярных мышц встречается крайне редко. Вовлечение в процесс мышц сочетается с поражением других мягких тканей орбиты. Деструкции костных стенок орбиты, как правило, не наблюдается. Клиническая картина поражения орбиты во многом сходна как при первичных, так и при диссеминированных лимфомах. Тем не менее поражение орбиты на разных этапах болезни имеет некоторые особенности. Орбитальные опухоли при диссеминированных лимфомах чаще, чем первичные орбитальные лимфомы развиваются быстро, приводят к компрессии зрительного нерва, появлению застойного диска и снижению остроты зрения.
НХЛ орбиты имеют, как правило, В-клеточную природу (Galieni P., Politp E., Leccisotti A. et al., 1997). Среди первичных орбитальных лимфом преобладают опухоли, развивающиеся из лимфоидной ткани, ассоциированной со слизистыми оболочками (MALT-лимфомы или MALT-омы). Диссеминированные лимфомы с поражением тканей орбиты представлены фолликулярными, В-клеточными диффузно крупноклеточными и опухолями из клеток зоны мантии.
Диагноз устанавливается на основании данных клинического осмотра, КТ или МРТ орбит, гистологического и гистоиммунохимического исследований биоптата. В ряде случаев допустимы цитологическое и цитоиммунохимическое исследования пунктата опухоли.
Планирование лечения НХЛ орбиты необходимо проводить с учетом стадии заболевания. В лечении первичных орбитальных лимфом рекомендуется использовать локальную лучевую терапию: дистанционную гамма-терапию или облучение фотонами. Рекомендуемая СОД составляет от 30 до 40 Гр по изоэффекту. Разовая доза — 2–2,5 Гр. Облучение мягких тканей орбиты необходимо проводить с защитой оптических сред глаза. С целью снижения лучевой нагрузки на роговицу и хрусталик используют свинцовые блоки, которые крепятся к головке лучевого аппарата или на подставке, максимально приближенной к лицу больного. Ранние лучевые осложнения дистанционной лучевой терапии НХЛ орбиты развиваются в первые 3 мес после облучения в виде кератопатии. Поздние лучевые осложнения возникают в виде стойкой кератопатии и лучевой катаракты которая, как правило, появляется через 3–5 лет после облучения. Осложнения дистанционной лучевой терапии возникают при облучении без защиты оптических сред глаза, в случае превышения СОД 50 Гр и при повторном облучении. В лечении диссеминированных лимфом главная роль принадлежит химиотерапии. При отсутствии полной регрессии лимфомы органа зрения на фоне химиотерапии дополнительно проводят локальную лучевую терапию орбиты, глаза и его придаточного аппарата.
По нашим данным опухоли орбиты, являющиеся симптомами диссеминированных лимфом высокой степени злокачественности, более чувствительны к лекарственной терапии, чем опухоли орбиты низкой степени злокачественности. Так, адекватная химиотерапия НХЛ низкой степени злокачественности по схеме СОР, как правило, приводила к выраженной регрессии опухолевых проявлений других локализаций, но была недостаточно эффективной в лечении лимфом орбиты, в связи с чем 68,7% больным дополнительно проводили локальную лучевую терапию на область пораженной орбиты. Адекватная химиотерапия диссеминированных лимфом высокой степени злокачественности по схеме СНОР и ее вариантов оказалась у 50% больных эффективной для всех проявлений заболевания, включая специфическое поражение органа зрения; только у 20% пациентов лечение стало более эффективным при осуществлении дополнительной локальной лучевой терапии. Однако треть больных НХЛ высокой степени злокачественности оказалась рефрактерной ко всем видам лечения (см. соответствующий раздел).
Злокачественные опухоли слезной железы
Злокачественные опухоли составляют более половины всех опухолей слезной железы. Среди злокачественных опухолей слезной железы преобладает рак. Неэпителиальные злокачественные опухоли представлены в основном НХЛ. По данным института патологии вооруженных сил США, неэпителиальные опухоли слезной железы составили только 14 (26%) из 53 опухолей, зарегистрированных за пять лет (Atlas of tumor pathology. Tumors of the eye and ocular adnexa, 1994).
Рак слезной железы представлен карциномой из предсуществующей плеоморфной аденомы или аденокарциномой слезной железы, возникшей de novo.
Клиническая классификация (по системе TNM):
Критерий T:
Т1 — опухоль до 25 мм в наибольшем диаметре, ограниченная слезной железой;
Т2 — опухоль до 25 мм в наибольшем диаметре, распространяющаяся на надкостницу ямки слезной железы;
Т3 — опухоль до 50 мм в наибольшем диаметре;
Т3a — опухоль, ограничена слезной железой;
Т3b — опухоль распространяется на надкостницу ямки слезной железы;
Т4 — опухоль более 50 мм в наибольшем измерении;
Т4а — опухоль распространяется на мягкие ткани орбиты, глазное яблоко, глазной нерв, но без распространения на кость;
Т4b — опухоль распространяется на мягкие ткани орбиты, глазное яблоко или глазной нерв с распространением на кость;
Критерий N (метастазы в регионарные лимфоузлы: предушные, подчелюстные и передние шейные);
Критерий M (отдаленные метастазы в легкие и органы средостения, кости и т.д.).
Карцинома из плеоморфной аденомы
Злокачественная смешанная опухоль слезной железы составляет почти 2/3 раков слезной железы. Женщины болеют почти в 2 раза чаще. Возможны 3 варианта развития карциномы:
— озлокачествление рецидивов плеоморфной аденомы при нерадикально проведенных операциях удаления опухоли;
— малигнизация нелеченной плеоморфной аденомы. В этом случае длительно существующее образование под верхненаружным краем орбиты начинает быстро (в течение 6–12 мес) расти;
— наконец, предсуществующая доброкачественная плеоморфная аденома протекает бессимптомно. Ее элементы находят при гистологическом исследовании удаленной плеоморфной карциномы.
Клиническая картина характеризуется чувством дискомфорта, болью в орбите, слезотечением из глаза на стороне поражения. Под верхненаружным краем орбиты пальпируется плотное, бугристое, спаянное с подлежащими тканями, образование. Рано появляется птоз верхнего века, более выраженный в его наружной трети, отек век невоспалительного характера. Экзофтальм — небольшой, со смещением глаза книзу и кнаружи. Наблюдается ограничение подвижности глаза кверху и кнаружи. За счет давления опухоли на глазное яблоко сверху развивается миопический астигматизм с косыми осями.
Гистологическая картина характеризуется аденокарциномой, плоскоклеточной карциномой или недифференцированным раком, но с элементами предсуществующей плеоморфной аденомы эпителиального и мезенхимального происхождения.
Аденокистозная карцинома
Из спонтанно развившегося рака слезной железы чаще встречается аденокистозная карцинома (цилиндрома). Клиническая картина аденокистозной карциномы и аденокарциномы из плеоморфной аденомы сходны. Однако аденокистозная карцинома возникает у более молодых больных и развивается быстрее. Чаще встречается у женщин в возрасте 25–45 лет. Инвазивный рост приводит к деструкции костей черепа и прорастанию в головной мозг. Через верхнюю глазничную щель опухоль может распространяться в среднюю черепную ямку.
При гистологическом исследовании выявляются скопления базалоидных клеток, в которых имеются фокусы клеток различной дифференцировки. Клеточная структура опухоли отличается значительной вариабельностью. В центре клеточных полей имеются овальные или округлые кисты, иногда заполненные муцином. Клеточные поля окружены гиалинизированной стромой, содержащей элементы, напоминающие цилиндры (Atlas of tumor pathology. Tumors of the eye and ocular adnexa, 1994).
Диагноз основан на данных клинического исследования. КТ орбит дает информацию о размерах опухоли, ее отношении к окружающим тканям, о целостности костной стенки орбиты. Окончательный диагноз может быть установлен только на основании морфологического исследования удаленной опухоли.
Выбор метода лечения рака слезной железы зависит от стадии заболевания. Маленькую опухоль (Т1 — Т2) удаляют с блоком прилежащих здоровых тканей. В послеоперационном периоде проводят дистанционную лучевую терапию на область орбиты. При лечении опухоли в стадии Т3 — Т4а производят поднадкостничную экзентерацию орбиты. При выявлении рака слезной железы в стадии Т4b лечение паллиативное. Экзентерация орбиты противопоказана.
Прогноз — неблагоприятный. Опухоль склонна к рецидивированию. Смерть наступает в результате прорастания опухоли в головной мозг. Вторая причина смерти — гематогенные метастазы в легкие, позвоночник, спинной мозг.
Первичный рак орбиты
Первичный рак орбиты развивается из эпителиальных клеток, дистопированных в мягкие ткани орбиты. Опухоль редкая. А.Ф. Бровкина (2002) сообщает об 11 наблюдениях больных первичным гетеротопическим раком орбиты. Чаще страдают мужчины. Опухоль растет медленно. От появления первых симптомов до обращения к врачу проходит несколько лет. Одним из первых симптомов опухоли является диплопия, нарушение подвижности. Клиническая картина зависит от локализации опухоли. При первичном расположении опухоли в переднем отделе орбиты, глаз смещается в противоположную сторону. Медленно увеличивается экзофтальм, который не достигает больших значений. Репозиция становится резко затрудненной. Глаз оказывается “замурованным” в опухоль. Развивается вторичная глаукома. Зрительные функции сохраняются длительное время. При появлении опухоли у вершины орбиты рано появляется боль и диплопия. Небольшой экзофтальм сочетается с полной офтальмоплегией. Развивается первичная атрофия зрительного нерва и резкое снижение остроты зрения. Дифференциальный диагноз проводят с метастатическими опухолями, прежде всего с метастазом в орбиту скиррозного РМЖ, с саркоидозом, амилоидозом орбиты, с псевдотумором орбиты в стадии фиброза. Диагноз устанавливается на основании морфологического исследования биоптата опухоли. Лечение возможно только при отсутствии прорастания опухоли в головной мозг. Проводят поднадкостничную экзентерацию. Облучение неэффективно, так как опухоль радиорезистентна. Прогноз для жизни и зрения неблагоприятный (Офтальмоонкология. Руководство для врачей, 2002).
Саркома орбиты
Составляет около 20% от всех злокачественных опухолей орбиты. Источником развития саркомы орбиты может быть любой вид соединительной ткани. Разные виды сарком орбиты встречаются с неодинаковой частотой. Из 54 сарком орбиты, зарегистрированных институтом патологии вооруженных сил США за пять лет, с наибольшей частотой встречались ангиосаркома (18 больных) и рабдомиосаркома (16 больных). В то же время фибросаркома и лейомиосаркома были представлены единичными случаями: у 3 больных и 1 больной соответственно (Atlas of tumor pathology. Tumors of the eye and ocular adnexa, 1994).
Клиническая TNM-классификация применима только для сарком мягких тканей и костей. Должно быть гистологическое подтверждение диагноза, позволяющее выделить морфологические подвиды опухолей:
Т1 — опухоль до 15 мм в наибольшем диаметре;
Т2 — опухоль более 15 мм в наибольшем диаметре, но без признаков Т3;
Т3 — опухоль любого размера с диффузной инфильтрацией мягких тканей орбиты и/или костной стенки орбиты;
Т4 — опухоль распространяется за пределы орбиты на соседние синусы и/или череп;
N— метастазы в регионарные лимфоузлы: предушные, подчелюстные и передние шейные;
M — отдаленные метастазы в легкие и органы средостения, кости и т.д.
Ангиосаркома орбиты
Ангиосаркома орбиты — собирательное понятие, объединяет злокачественную гемангиэндотелиому и злокачественную гемангиоперицитому. Составляет около 7% от злокачественных опухолей орбиты. Существует мнение, что все гемангиоперицитомы следует относить к злокачественным опухолям с разной степенью злокачественности (Atlas of tumor pathology. Tumors of the eye and ocular adnexa, 1994).
Чаще развивается в возрасте 24–35 лет (Бровкина А.Ф., 1993). Страдают в основном мужчины. Заболевание характеризуется быстрым развитием симптомов. При локализации в переднем отделе орбиты доступная пальпации опухоль плотная, безболезненная, спаянная с подлежащими тканями, поверхность ее бугристая. Подкожные сосуды в зоне расположения опухоли расширены. Возможен выход опухоли интенсивно синего цвета под конъюнктиву. Рано появляются смещение глаза и офтальмоплегия. При локализации опухоли у вершины орбиты появляются упорные боли, экзофтальм, птоз, офтальмоплегия (Офтальмоонкология. Руководство для врачей, 2002). При морфологическом исследовании определяют мелкие опухолевые полигональные или веретенообразные клетки, которые располагаются вокруг сосудов или изнутри сосудов, сдавливая их просвет. В опухолевых клетках выражены анаплазия и митоз. Сосуды опухоли варьируют от тонких капилляров до крупных синусоидальных пространств. Синусоидальные сосуды расположены в основном на периферии опухоли, где они имеют характерный вид оленьих рогов. Все сосуды, включая крупные синусоидальные, не имеют мышечной стенки.
Лечение ангиосаркомы. При сохранности костных стенок орбиты проводят поднадкостничную экзентерацию орбиты.
Прогноз неблагоприятный. Опухоль склонна к рецидивированию. Сроки ремиссии составляют всего несколько месяцев. Рано метастазирует в легкие, кости. По данным Shields J. et al. (1992), у 18% больных опухоль распространяется в полость черепа.
Рабдомиосаркома орбиты (РМС)
РМС составляет около 5% от всех злокачественных опухолей орбиты. Наиболее часто встречающаяся злокачественная опухоль орбиты у детей — 3,4% всех детских опухолей. По данным А.Ф. Бровкиной (2002), не столь уж редко встречается у взрослых. Клиническая картина РМС у детей характеризуется “молниеносным” развитием экзофтальма, птоза, офтальмоплегии. У взрослых опухоль растет несколько медленнее — в течение нескольких месяцев. Быстрое развитие экзофтальма сопровождается расширением эпибульбарных сосудов, появлением хемоза, повышением внутриглазного давления, развитием застойного диска зрительного нерва. Наиболее частая локализация опухоли — верхневнутренний квадрант орбиты. Опухоль рано вызывает деструкцию костных стенок орбиты, может прорастать в клетки решетчатого лабиринта и в полость носа, вызывать носовые кровотечения. Известны случаи прорастания опухоли в подслизистый слой конъюнктивы с формированием эпибульбарного узла (Atlas of tumor pathology. Tumors of the eye and ocular adnexa, 1994). При морфологическом исследовании выделяют три типа опухоли: эмбриональный, альвеолярный и плеоморфный. Эмбриональный тип опухоли встречается в раннем детском возрасте, альвеолярный — у детей более старшего возраста. Альвеолярная РМС чаще растет в нижнем отделе орбиты. Плеоморфный тип опухоли развивается у взрослых. Наличие нескольких типов опухоли, полиморфность клеточного состава опухоли вызывают трудности диагностики. Целесообразно морфологическое исследование дополнять гистоиммунохимическим (Sun X.L., Zheng B.H., Li B. et al., 1990). Для РМС определяющим является положительная реакция на мышечно-специфический актин, виментин, в меньшей степени на десмин и миоглобин.
Лечение. Рекомендуют комбинированное химио-лучевое лечение. В случаях, когда опухоль оказывается рефрактерной к химиотерапии и лучевой терапии, проводят поднадкостничную экзентерацию орбиты. Прогноз для жизни неблагоприятный.
Лейомиосаркома орбиты
Лейомиосаркома орбиты встречается в 2 раза реже РМС. Преимущественно болеют женщины старше 30 лет. Может возникать de novo или после дистанционной лучевой терапии орбиты в детском возрасте. Возможно развитие лейомиосаркомы через 25–30 лет после лучевой терапии ретинобластомы.
Лейомиосаркома развивается из элементов гладких мышц сосудов, особенно верхней глазничной вены, мышцы Мюллера (средней порции леватора верхнего века), из тонких волокон орбитальной мышцы, закрывающей вместе с соединительнотканной перегородкой нижнюю глазничную щель, из небольших пучков гладкомышечных волокон пронизывающих соединительнотканные перегородки жирового тела орбиты.
Лейомиосаркома растет медленнее, чем РМС. В зависимости от локализации опухоли в полости орбиты появляется осевой экзофтальм или экзофтальм со смещением глаза. Нарушение подвижности глаза выражено умеренно, а может и вовсе отсутствовать. Репозиция затруднена.
Диагноз устанавливают на основании клинического исследования, данных КТ, на основании морфологического и гистоиммунохимического исследования удаленной опухоли. При иммунологическом исследовании определяют мышечно-специфический актин и десмин.
Дифференциальный диагноз проводят с доброкачественными опухолями орбиты.
Лечение. Опухоль в стадии Т1 — Т2 удаляют локально с последующей дистанционной лучевой терапией пораженной орбиты. При наличии инфильтрации окружающих тканей (стадия Т3) показана поднадкостничная экзентерация орбиты. Прогноз более благоприятный, чем при РМС.
Липосаркома орбиты
Составляет менее 1% от злокачественных опухолей орбиты. Считается, что в орбиту метастазирует липосаркома ретроперитонеального пространства. На возможность развития первичной липосаркомы орбиты указывают многие авторы (Болезни орбиты, 1993; NcNab A.A., Moseley I., 1990). Опухоль развивается у взрослых. Характеризуется быстрым развитием экзофтальма со смещением глаза, как правило книзу, офтальмоплегией, застойными явлениями в орбите. Выделяют 4 гистологических варианта липосаркомы: хорошо дифференцированная, миксоидная, круглоклеточная и плеоморфная (см. соответствующий раздел). В орбите преобладают хорошо дифференцированная и миксоидная липосаркомы. Хорошо дифференцированную липосаркому бывает трудно отличить от липомы. Липобластов в опухоли немного, степень анаплазии в них выражена умеренно.
Дифференциальный диагноз проводят с другими злокачественными опухолями орбиты, болезнью Вегенера.
Лечение. Поднадкостничная экзентерация орбиты. Лучевая терапия малоэффективна. Прогноз для жизни более благоприятный, чем при других саркомах орбиты.
Фибросаркома орбиты
Составляет около 2% от злокачественных опухолей орбиты. Встречается в любом возрасте. У взрослых может развиваться через десятки лет после лучевой терапии в детском возрасте по поводу ретинобластомы. Такой вариант опухоли отличается более агрессивным течением, чем фибросаркома, возникшая de novo (Liaw C.C., Ho Y.S., Ng K.K., 1990). Опухоль развивается из элементов надкостницы.
Опухоль чаще локализуется под верхней стенкой орбиты. Растет медленно. Клиническая картина характеризуется медленно нарастающим экзофтальмом со смещением глаза книзу. Длительное время сохраняется подвижность глаза. Нелеченная опухоль может прорастать окружающие ткани и распространяться в полость черепа (Болезни орбиты, 1993).
Опухоль радиорезистентна. При отсутствии распространения за пределы орбиты проводят локальную эксцизию или поднадкостничную экзентерацию орбиты. Опухоль редко метастазирует. Прогноз зависит от распространенности процесса к моменту выявления опухоли (Офтальмоонкология. Руководство для врачей, 2002).
Метастаз в орбиту
По данным А.Ф. Бровкиной (2002), около 6% всех злокачественных опухолей орбиты имеет метастатический характер. По мнению других авторов этот процент достигает 32–35% (Char D.H., Miller T., Kroll S., 1997). Метастаз в орбиту чаще бывает односторонним, в виде одиночного опухолевого очага. Реже выявляется мультицентрический рост метастатической опухоли. Клиническая картина зависит от характера первичной опухоли и локализации метастатической опухоли в полости орбиты. Для метастазов в орбиту РМЖ характерно, как правило, медленное течение. Пристеночное расположение опухоли приводит к смещению глаза в противоположную сторону. Постепенно развивается экзофтальм. Субъективно больных беспокоит диплопия из-за ограничения подвижности глаза. Наряду с экзофтальмом и птозом диплопия является одним из наиболее часто встречающихся симптомов метастатической опухоли орбиты. Нельзя не согласиться с мнением Char D.H. et al. (1997), что у пожилых лиц с жалобами на диплопию и без признаков патологии щитовидной железы надо, прежде всего, исключать метастатическую опухоль орбиты. Нередко появляется образование, которое больные сами прощупывают под одной из стенок орбиты (см. рис. 30 на цветной вклейке). Опухоль, доступная пальпации, имеет, как правило, бугристую поверхность, плотную консистенцию, спаяна с подлежащими тканями. Описанная клиническая картина характерна для аденокарциномы или инфильтративного протокового РМЖ. Иную клиническую картину имеет метастаз скирра молочной железы. Опухоль — более плотная, быстро прорастает прилежащие ткани. Очень рано развивается энофтальм в сочетании с офтальмоплегией — синдром вколоченного глаза. Метастатические опухоли рака желудка, легкого, щитовидной железы, кожной меланомы характеризуются, как правило, быстрым (в течение 1–2 мес) развитием симптомов, присущих злокачественной опухоли орбиты: появлением экзофтальма, чаще осевого, ограничения подвижности глаза, диплопии, невоспалительного отека век, хемоза. Нередко развивается застойный диск зрительного нерва с последующим снижением остроты зрения. Метастатические опухоли приходится дифференцировать с другими злокачественными опухолями и псевдотумором орбиты. Диагноз метастатической опухоли орбиты устанавливается на основании данных анамнеза, офтальмологического исследования, КТ и морфологического исследования пунктата или биоптата опухоли. Лечение метастаза в орбиту проводится с паллиативной целью. Выбор метода лечения проводят с учетом характера первичной опухоли и наличия метастазов в других органах. В случае одиночного орбитального метастаза эффективна дистанционная лучевая терапия: гамма-терапия или облучение фотонами. СОД составляет 40–50 Гр. Разовая доза 2 Гр. Применение СОД ионизирующего излучения более 50 Гр не оправдано, так как повышает риск развития лучевых осложнений. При локальной лучевой терапии орбитальных опухолей защиту переднего отрезка глаза производят с использованием свинцового блока высотой 0,8–1,0 см. Блок устанавливается на подставке, крепящейся к головке лучевого аппарата или на специальной подставке, приближенной максимально к лицу больного. Это позволяет снизить лучевую нагрузку на оптические среды глаза до 10–30% от общей дозы. Ранняя диагностика метастаза в орбиту и своевременное его лечение позволяют избежать развития вторичной глаукомы с выраженным болевым синдромом.
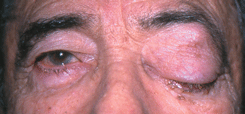
Рисунок 30. Метастаз рака легкого в орбиту. Под верхней стенкой орбиты виден узел опухоли. Экзофтальм. Полный птоз верхнего века
Литература
Болезни орбиты/ Под ред. А.Ф. Бровкиной.— М.: Медицина, 1993.— 238 с.
Бровкина А.Ф. и др. ...Клин. офтальмология.— 2000.— Т. 1.— № 3.— С. 82–83.
Бровкина А.Ф. и др. ...Мед. радиология.— 1987.— № 8.— С. 61–66.
Бровкина А.Ф. и др. ...Офтальмол. журнал.— 1993.— № 1.— С. 1–4.
Бровкина А.Ф. и др. ...Вестн. офтальмологии.— 1990— т. 106.— № 6.— С. 48–53.
Бровкина А.Ф. и др. ...Вестн. офтальмологии.— 2001.— № 3.— С. 3–5.
Бровкина А.Ф. ...Клин. офтальмология.— 2003.— № 1.— С. 15–19.
Михина З.П. и др. ...Мед. радиология.— 2000.— № 1.— С. 12–14.
Офтальмоонкология. Руководство для врачей/ Под ред. А.Ф. Бровкиной.— М.: Медицина, 2002.— 424 с.
Панова И.Е. и др. Базально-клеточный рак вспомогательного аппарата глаза (клиника, морфология). Учебное пособие.— Челябинск, 2002.— 24 с.
Andersen M. et al. ...Acta Ophthalmol. Scand.— 1995.— V. 73 (5).— P. 453–456.
Atlas of tumor pathology. Tumors of the eye and ocular adnexa/ Ed. by McLean I. W. et al. Washington-Armed Forces Institute of Pathology, 1994.— 322 p.
Biggar R. et al. ...Hematol. Oncol. Clin. North. Am.— 1996.— V. 10.— P. 997–999.
Brown S.M. et al. ...Surv-Ophtalmol.— 1994.— V. 39 (2) .— P. 133–140.
Canellos G.P. et al. ...The Lymphomas. WB Saunders Company, 1997.— P. 450–478.
Char D.H. et al. ...Br. J. Ophthalmol.— 1997.— V. 81 (5).— P. 386–390.
Cher L. ...Cancer Forum.— 1998.— V. 22 (2).— P. 138–140.
Connor J.M. ...Oncology.— 1998.— V. 12 (2).— P. 185–195.
Domato B. et al. ...Br. J. Ophthalmol.— 1998.— V. 83. (3).— P. 213–218.
Durel P.U. et al. ...Am. J. Ophthalmol.— 1990.— V. 100 (6).— P. 500–503.
Durel P.U. et al. ...Ophthalmology.— 1992.— V. 99 (5).— P. 1127–1132.
Eliassi-Rad B. et al. ...Br. J. Ophthalmol.— 1996.— V. 80 (2).— P. 125–128.
Frucht-Perry J. ...Amer. J. Ophthalmol.— 1994.— V. 117 (1).— P. 164–183.
Galieni P. et al. ...Haematologica.— 1997.— V. 82.— P. 436–439.
Gragoudas E. et al. ...Ophthalmology.— 1992.— V. 99 (6).— P. 760–766.
Hadman-Lea S. et al. ...Arch.Ophthalmol.— 1994.— V. 112.— P. 1207–1212.
International ophthalmology clinics. Recent advances in ocular oncology/Ed. by Jakobiec F.A. et al. 15-th ed. — Philadelphia-Lippincott-Raven, 1997.— V. 37 (4). — 303 p.
Journee de Korver H. et al. ...Br. J. Ophthalmol.— 1997. — V. 81 (4).— P. 234–239.
Kiratli H. et al. ...Br. J. Ophthalmol.— 1996.— V. 8 (1).— P. 5–8.
Liaw C.C. et al. ...Otolaryngol. Head Neck Surg.— 1990.— V. 103.— P. 825–828.
Marshmann W. et al. ...Aust. NZ J. Ohphalmol.— 1996.— V. 24 (4).— P. 377–380.
Merrill C.F. et al. ...Cancer.— 1991.— V. 68.— P. 623–627.
Newton R. ...Br. J. Ophthalmol.— 1996.— V. 74 (10).— P. 1511–1513.
NcNab A.A. et al. ...Br. J. Ophthalmol.— 1990.— V. 74 (3).— P. 437–449.
Peyman G. et al. ...Int. Ophthalmol.— 1992.— V. 16 (5).— P. 439–444.
Rahhal R.M. et al. ...Br. J. Ophthalmol.— 1994.— V. 78.— P. 319–321.
Robertson D. et al. ...Amer. J. Ophthalmol.— 1991.— V. 112 (6).— P. 590–593.
Shields C. et al. ...Arch. Opthtalmol.— 1997.— V. 115 (3).— P. 203–209.
Shields C. et al. ...Ophthalmology.— 1998.— V. 105 (6).— P. 581–590.
Shields J. et al. ...Ophthalmol. Plast. Reconstr. Surg.— 1992.— V. 1.— P. 62–68.
Sivalingam V. et al. ...Ann. Ophthalmol.— 1990.— V. 22 (3).— P. 106–109.
Sun X.L. et al. ...Clin. Med. J. (Engl).— 1990.— V. 103.— P. 485–488.
Tabssian A. ...Arch. Ophthalmol.— 1995.— V. 113 (12).— P. 1576–1577.
Tahery D. et al. ...J. Amer. Acad. Derm.— 1992.— V. 27.— P. 17–21.
Vaughn G. et al. ...Ophthalmology. Eds. M. Yanoff et al.— London, Philadelphia, Sydney, Tokyo: Mosby, 1999.— Sect. 7, 12.1–12.10.
Yoshizawa T. et al. ...Intern.-Med.— 1994.— V. 33 (2).— P. 92–96.
Описание проверено экспертом
Оцените статью:
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).



