C54 Злокачественное новообразование тела матки, МКБ-10
- C54.0 Перешейка матки
- C54.1 Эндометрия
- C54.2 Миометрия
- C54.3 Дна матки
- C54.8 Поражение тела матки, выходящее за пределы одной и более вышеуказанных локализаций
- C54.9 Тела матки неуточненной локализации
Отредактировано: 02.04.2024
д.м.н. Баринов В.В.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Рак тела матки
Эпидемиология и факторы риска. Патологическая анатомия. Метастазирование. Клиническая картина. Диагностика. Лечение. Наблюдение, развитие рецидивов и метастазов
В последние двадцать лет во всем мире увеличивается частота развития гормонозависимых опухолей, в т.ч. опухолей тела матки и молочной железы.
Эпидемиология и факторы риска
Несмотря на то что рак тела матки (РТМ) чаще встречается в возрасте старше 50 лет (у 75% женщин), тенденцией последних лет является омоложение контингента больных. Так, за 1989–1998 гг. заболеваемость в возрастной группе до 29 лет увеличилась на 47%. По данным МНИОИ им. П.А. Герцена, у женщин моложе 40 лет в 10% наблюдений выявляется аденокарцинома эндометрия. Кроме того, значительные темпы прироста заболеваемости РТМ отмечаются в возрастных группах 40–49 лет (на 12,3%) и 50–56 лет (на 15,6%).
К факторам риска возникновения РТМ относятся следующие клинические признаки:
1. Бесплодие и нарушения менструального цикла, связанное с ановуляцией, приводящей к гиперэстрогении на фоне снижения секреции прогестерона.
2. Отсутствие родов, при этом риск развития рака эндометрия в 2–3 раза выше, чем у рожавших женщин.
3. Поздняя менопауза. При наступлении менопаузы после 52 лет риск возникновения РТМ в 2,4 раза выше, чем при наступлении менопаузы до 49 лет, что объясняется увеличением с возрастом числа ановуляторных менструальных циклов.
4. Ожирение. Риск развития РТМ увеличивается в 3 раза, если масса тела превышает нормальную на 9,5–22,5 кг; при превышении массы тела более чем на 22,5 кг — в 10 раз. Это происходит в результате более активного превращения андростендиона в эстрон в подкожной клетчатке и, следовательно, гиперэстрогении.
5. Синдром Штейна — Левенталя, гормонопродуцирующие опухоли яичников и наличие гормонозависимых опухолей в анамнезе (при РМЖ в анамнезе рак эндометрия встречается в 14 раз чаще).
6. Неадекватная заместительная гормонотерапия в постменопаузе без прогестагенов, при этом риск возникновения РТМ увеличивается в 4–8 раз. Этот риск тем выше, чем длительнее прием эстрогенов и выше их дозы. При одновременном назначении прогестагенов вероятность развития РТМ практически не отличается от такового в популяции.
7. Применение тамоксифена при лечении РМЖ повышается риск возникновения РТМ в 2–3 раза.
8. У больных сахарным диабетом РТМ встречается в 1,3–2,8 раза чаще, чем у здоровых.
9. Наличие в анамнезе гиперпластических процессов эндометрия.
Существуют два патогенетических варианта РТМ. Первый вариант, распространенный, развивается у более молодых больных, на фоне гиперэстрогении, сахарного диабета, гипертонической болезни, ожирения. РТМ в этом случае обычно развивается на фоне гиперплазии эндометрия, чаще высокодифференцированный, и имеет более благоприятный прогноз.
Рак эндометрия второго патогенетического варианта возникает обычно на фоне атрофии эндометрия при отсутствии гиперэстрогении. Опухоль в этом случае чаще оказывается низкодифференцированной и характеризуется менее благоприятным прогнозом. РТМ второго патогенетического варианта развивается в более старшем возрасте, в глубокой постменопаузе, обменные нарушения выражены слабо или отсутствуют вообще.
Патологическая анатомия
При РТМ опухоль имеет в основном экзофитную форму анатомического роста, реже эндофитную и смешанную. Преимущественно опухолевый процесс локализуется в области дна матки (47,5%), но может поражать как нижний сегмент (27,6%), так и всю полость матки (24,9%).
Аденокарцинома
Отмечается в 80% случаев РТМ.
Выделяют 3 степени дифференцировки аденокарциномы тела матки:
1. Высокодифференцированный рак (G1) — сóлидное строение имеет не более 5% опухоли.
2. Умереннодифференцированный рак (G2) — сóлидное строение имеет 5–50% опухоли.
3. Низкодифференцированный рак (G3) — сóлидное строение имеет более 50% опухоли.
Железисто-плоскоклеточный рак и акантома эндометрия
В 15–25% аденокарцинома эндометрия имеет участки плоскоклеточной метаплазии. Ранее считалось, что если участки плоскоклеточной метаплазии носят доброкачественный характер, то опухоль называлась аденоакантомой, а если злокачественный — то железисто-плоскоклеточным раком. В настоящее время используется 1 термин — аденокарцинома с плоскоклеточной метаплазией.
Светлоклеточный рак (мезонефроидный)
Светлоклеточный РТМ также относится к редко встречаемым гистологическим формам и составляет менее 5% из всех случаев РТМ, чаще наблюдается у пожилых больных, при этом отличается чрезвычайно агрессивным течением и плохим прогнозом.
При этой форме опухоли 5-летняя выживаемость колеблется от 33 до 64% и зависит в основном от глубины инвазии в миометрий и наличия раковых эмболов в лимфатических щелях.
Плоскоклеточный рак
Плоскоклеточный рак эндометрия встречается так же редко и имеет много общего со светлоклеточным РТМ. Прогноз неблагоприятный, 5-летняя выживаемость при I стадии составляет всего 36%.
Муцинозный рак
Среди редких гистологических форм РТМ муцинозный рак встречается примерно у 5% больных с данной онкогинекологической патологией. В большинстве случаев это высокодифференцированные опухоли, которые не отличаются по течению от обычной аденокарциномы и имеют благоприятный клинический прогноз.
Серозно-папиллярный рак
Серозно-папиллярный рак составляет около 3–4% наблюдений рака эндометрия. Морфологически по строению опухоль имеет сходство с серозным раком яичников и маточных труб.
Эта гистологическая форма рака характеризуется ранним лимфогенным метастазированием, глубокой инвазией в миометрий и диссеминацией по брюшине, аналогичной таковой при раке яичников. Прогноз неблагоприятный.
Недифференцированный рак
Недифференцированный РТМ встречается редко (6%), чаще у пациенток пожилого возраста. Прогноз неблагоприятный.
Синхронный рак эндометрия и яичников
Большие проблемы возникают у клиницистов и морфологов в решении вопросов дифференциальной диагностики первичного РТМ с метастазами в яичники и синхронного рака эндометрия и яичников. По данным литературы, синхронный рак эндометрия и яичников наблюдается в 1,4–3,8% наблюдений злокачественных опухолей женских половых органов.
Чаще прогноз при синхронном РТМ и яичников благоприятный. В установлении диагноза “метастазы РТМ в яичники” или “рака яичников в эндометрий”, а также диагноза “синхронный рак”, большое значение придается иммуногистохимическим исследованиям, проточной цитометрии и анализу ДНК. При этом не менее важное значение имеют данные операционных находок и морфологического исследования операционного материала.
Метастазирование
Риск возникновения метастазов в лимфатические узлы в первую очередь определяется степенью дифференцировки опухоли и глубиной ее инвазии в миометрий.
При I клинической стадии РТМ метастазы в лимфатические узлы диагностируются у 3% больных с высокодифференцированным, у 9% больных с умереннодифференцированным и у 18% больных с низкодифференцированным РТМ.
При инвазии в миометрий менее чем на 1/2 его толщины метастазы в лимфатические узлы обнаруживаются менее чем у 5% больных, при более глубокой инвазии — у 20% больных. При высоко— и умереннодифференцированном раке эндометрия с инвазией в миометрий менее чем на 1/2 его толщины метастазы в тазовые лимфатические узлы обнаруживаются менее чем у 5% больных.
При высоко— и умереннодифференцированной аденокарциноме с инвазией в миометрий более чем на 1/2 его толщины и при низкодифференцированной аденокарциноме с инвазией в миометрий менее чем на 1/2 его толщины они наблюдаются приблизительно у 15% больных. При низкодифференцированном РТМ с инвазией в миометрий более чем на 1/2 его толщины, этот показатель достигает 46%.
При переходе опухоли на шейку матки метастазы в лимфатические узлы наблюдаются у 15% больных.
Лимфогенная диссеминация зависит также от размеров опухоли. При размерах опухоли до 2 см частота выявления метастазов в тазовые лимфатические узлы составляет 4%, при опухолях более 2 см — 15%, а при опухолях, занимающих всю полость матки — 35%.
Таблица 1
Международная классификация рака тела матки
| TNM (1997) | FIGO (1988) | ||
| T1A | Стадия IA | G1, G2, G3 | Опухоль в пределах эндометрия |
| T1B | Стадия IB | G1, G2, G3 | Инвазия в миометрий менее чем на 1/2 его толщины |
| T1C | Стадия IC | G1, G2, G3 | Инвазия в миометрий более чем на 1/2 его толщины |
| T2A | Стадия IIA | G1, G2, G3 | Опухоль распространяется на цервикальный канал в пределах эндоцервикальных желез |
| T2B | Стадия IIB | G1, G2, G3 | Опухоль распространяется на строму шейки матки |
| T3A | Стадия IIIA | G1, G2, G3 | Прорастание серозной оболочки матки, метастазы в маточные трубы или яичники или наличие опухолевых клеток в асците или смывах из брюшной полости |
| T3B | Стадия IIIB | G1, G2, G3 | Опухоль распространяется на влагалище (прямо или метастазы) |
| T3CN1 | Стадия IIIC | G1, G2, G3 | Метастазы в тазовые и/или поясничные лимфатические узлы |
| T4 | Стадия IVA | G1, G2, G3 | Прорастание слизистой мочевого пузыря или прямой кишки |
| M1 | Стадия IVB | G1, G2, G3 | Отдаленные метастазы, в т.ч. метастазы в пределах брюшной полости, а также метастазы в паховые лимфатические узлы |
G1 — высокодифференцированный рак; G2 — умереннодифференцированный рак; G3 — низкодифференцированный рак
Клиническая картина
У больных в пременопаузе РТМ обычно проявляется гиперполименореей или ациклическими маточными кровотечениями. При появлении этих симптомов, особенно при ожирении и длительной ановуляции, необходимо исключить РТМ. Практически у 90% больных, находящихся в постменопаузе, единственным проявлением заболевания являются маточные кровотечения или кровянистые выделения из половых путей, по поводу которых они и обращаются к врачу.
При стенозе цервикального канала (чаще у пожилых больных) кровотечения отсутствуют, и развивается гематометра. Возможно развитие пиометры с гнойными выделениями из половых путей. Имеются данные литературы о том, что гематометра и пиометра являются клиническими признаками, ухудшающими прогноз заболевания.
Менее чем у 5% больных жалобы отсутствуют. У таких больных диагноз устанавливается после экстирпации матки, произведенной по поводу другой патологии или при выявлении опухоли в теле матки при УЗИ или КТ, а также при выявлении опухолевых клеток в мазках из влагалища, что свидетельствует о наличии запущенного опухолевого процесса рака эндометрия.
Жалобы различного характера на боли в животе и внизу живота являются менее частым признаком проявления рака эндометрия, и их появление манифестирует распространенность опухолевого процесса с вовлечением и сдавлением нервных стволов и сплетений прорастающей опухолью или метастатическим поражением лимфатических узлов.
Следует отметить, что из общего числа обратившихся пациенток, помимо жалоб со стороны гениталий, практически все больные считают себя здоровыми.
Диагностика
Главное значение в диагностике РТМ придается детальному анализу анамнеза, в т.ч. — наличию сопутствующих заболеваний (гипертоническая болезнь, сахарный диабет, нарушение функции печени, ожирение, РМЖ, злокачественные опухоли ЖКТ, отягощенная онкологическая наследственность) и, безусловно, сбору информации об основных клинических проявлениях заболевания со стороны гениталий (состояние репродуктивной системы, наличие ациклических маточных кровотечений, течение пременопаузального периода, сроки наступления менопаузы, наличие в анамнезе гиперпластических процессов эндометрия, гормональное лечение, в т.ч. с использованием антиэстрогенов).
При двуручном гинекологическом исследовании, включая ректовагинальный осмотр, следует обращать внимание на размеры матки, ее консистенцию, форму, наличие инфильтратов в параметриях, инфильтрацию крестцово-маточных связок, наличие опухолевых образований в придатках матки. На основании полученных данных можно предполагать, какова степень местного распространения опухолевого процесса.
Традиционные диагностические методы обследования хорошо известны и, как правило, общедоступны. Помимо анализа клинического течения заболевания и гинекологического осмотра, они включают в себя:
— цитологическое исследование аспирата из полости матки;
— УЗТ органов малого таза;
— рентгенологическое исследование (гистеросальпингография, КТ и МРТ);
— гистероскопию и гистологическое исследование материала, полученного при раздельном диагностическом выскабливании матки;
— биохимическое исследование сыворотки крови.
При маточном кровотечении или подозрении на патологию эндометрия на первом этапе обследования амбулаторно производится аспирационная биопсия эндометрия, которая позволяет поставить диагноз в 90–98%.
Цитологическое исследование мазков из влагалища малоинформативно, т.к. опухолевые клетки обнаруживаются только у 15–30% больных РТМ. Основные методы диагностики рака эндометрия — гистероскопия и раздельное диагностическое выскабливание матки.
При гистероскопии:
— уточняется локализация опухоли;
— уточняется площадь поражения;
— производится прицельная биопсия, что позволяет определить рецепторы стероидных гормонов в ткани опухоли.
За последние годы широкое распространение в диагностике рака эндометрия получила УЗКТ с использованием трансабдоминального, трансвагинального датчиков и допплерометрией, что позволяет значительно улучшить оценку состояния эндометрия и миометрия (его структуру и толщину). Помимо этого, на основании эхографических признаков возможно определить глубину инвазии мышечной оболочки матки, размеры, локализацию опухоли и наличие метастазов в лимфатические узлы.
Безусловно, УЗКТ имеет пределы своих диагностических возможностей и определенные трудности в трактовке патологического очага в матке, что часто объясняется небольшими его размерами, наличием миомы матки и содержанием в полости матки крови, ее сгустков, фибрина и пр. Но, несмотря на это, удалось выделить основные диагностические и семиотические критерии данной онкопатологии.
Клинико-морфологические и ультразвуковые параллели позволяют клиницисту на дооперационном периоде составить представление о степени распространения опухолевого процесса, наличия метастазов не только в зонах регионарного метастазирования, но и в органах брюшной полости (рис. 1–4).
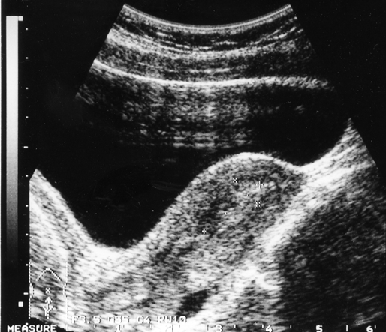
Рисунок 1. Ультразвуковые признаки инвазии опухоли в миометрий
Рисунок 2. Прорастание рака эндометрия всех оболочек матки
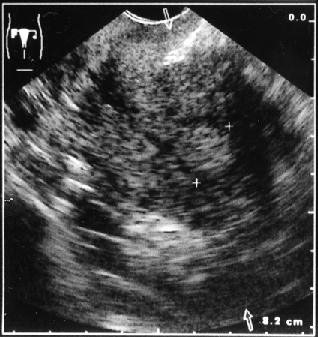
Рисунок 3. Локализация опухоли в дне матки в виде полипа
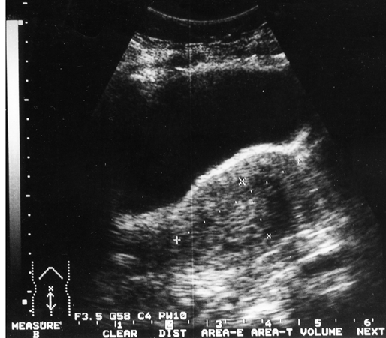
Рисунок 4. Тотальное поражение полости матки с переходом на цервикальный канал
Полученная информация дает возможность хирургу планировать тактику ведения больных РТМ, включая главный этап — объем хирургического вмешательства. Это касается выполнения экстирпации матки с придатками и удаления лимфатических узлов у больных с опухолевым поражением всей полости матки и метастазами в лимфатические узлы, расширенной пангистерэктомии при распространении опухоли на цервикальный канал и экстирпации матки с придатками, резекции большого сальника — при метастатическом поражении придатков матки или серозно-папиллярном раке эндометрия.
Сравнительное изучение результатов морфологического исследования удаленной матки с ультразвуковыми находками показало число совпадений при микроскопической инвазии опухолью миометрия в 66,6% случаев. Следует отметить, что точность совпадений приближается к 100% при глубине инвазии опухолью мышечной оболочки матки более 1 см.
Совпадение морфологических и сонографических данных о размерах первичной опухоли в матке и ее локализации отмечено соответственно в 86 и 45,7% наблюдений. Значительна частота совпадений и при большом поражении полости матки. Так, у 52,4% пациенток с тотальным поражением полости матки и у 88,2% пациенток с локализацией опухоли в полости матки с переходом на цервикальный канал данные УЗТ и гистологического заключения совпали. Этот показатель снижается до 15,8% при локализации аденокарциномы в области дна матки и ее трубных углов.
Практически у половины больных с метастазами рака эндометрия в лимфатические узлы показатели УЗИ совпали с данными морфологии.
По показаниям, для уточнения степени распространения опухолевого процесса, с целью определения состояния смежных органов производится цистоскопия, ректороманоскопия, для исключения метастазов в легкие — рентгенография органов грудной клетки, в кости — сканирование и рентгенография костей скелета.
За последние годы уточняющими методами диагностики РТМ являются КТ и МРТ.
В диагностике злокачественных опухолей гениталий перспективными стали исследования опухолевых маркеров, в т.ч. при РТМ.
У большинства больных РТМ с запущенным опухолевым процессом уровень маркера СА 125 в сыворотке крови повышен. Повышение уровня опухолевого маркера СА 125 — признак возможного использования его в качестве теста, определяющего дальнейшее течение заболевания и динамического контроля за больными.
Лечение
На первом этапе лечения РТМ практически 90% больных показано оперативное вмешательство.
Во время лапаротомии нужно произвести смывы из брюшной полости для цитологического исследования, детальную ревизию органов брюшной полости и малого таза, биопсию или удаление всех подозрительных объемных образований с последующей экстирпацией матки с придатками.
Удаленную матку необходимо вскрыть для определения локализации и размеров опухоли, наличия распространения опухоли на шейку матки, оценить макроскопически глубину инвазии в миометрий, произвести биопсию увеличенных тазовых и поясничных лимфатических узлов.
При наличии одного или нескольких неблагоприятных факторов прогноза (светлоклеточный, серозно-папиллярный или плоскоклеточный рак, а также низкодифференцированная аденокарцинома, инвазия в миометрий более чем на 1/2 его толщины, переход опухоли на перешеек или шейку матки, размеры опухоли более 2 см, выход опухоли за пределы матки, увеличенные лимфатические узлы) показана забрюшинная лимфаденэктомия.
В настоящее время при РТМ I-II стадий чаще всего применяется комбинированное лечение — операция с последующей лучевой терапией. В результате анализа отдаленных результатов лечения больных РТМ было установлено, что удаление регионарных лимфатических узлов повышает 5-летнюю выживаемость с 69,9 до 81,9%.
Вероятность лимфогенного метастазирования невелика у больных с высокодифференцированной аденокарциномой эндометрия с локализацией опухоли в верхней трети матки, и результаты простой и расширенной экстирпации матки с придатками одинаково высоки. В подобных случаях адекватным лечением является простая пангистерэктомия.
Экстирпация матки с придатками и удаление лимфатических узлов таза показаны при умеренно— и низкодифференцированной аденокарциномах, не переходящих на шеечный канал, а также при наличии метастазов в лимфатические узлы. У больных с переходом аденокарциномы на шеечный канал при отсутствии высокого риска оперативного вмешательства выполняется расширенная экстирпация матки с придатками.
Доказано преимущество расширенной пангистерэктомии при глубокой инвазии опухоли в миометрий. Так, при глубине инвазии более 1 см 5-летняя выживаемость после простой экстирпации составила 51,2%, а после расширенной — 62,9%. Это связано с высокой частотой наличия метастазов в лимфатических узлах (34,4%) при инвазии миометрия, превышающей 1 см.
У больных РТМ с одновременным злокачественным опухолевым поражением яичников, иногда имеющим иное гистологическое строение, а также при серозно-папиллярном РТМ, помимо удаления матки с придатками необходимо резецировать большой сальник, и в послеоперационном периоде в комплекс лечебных мероприятий следует включать лекарственное противоопухолевое лечение.
Частота послеоперационных осложнений после пангистерэктомии с забрюшинной лимфаденэктомией составляет примерно 20%, при этом около 6% являются тяжелыми.
Следует отметить, что пред— и послеоперационный гистологический диагнозы не совпадают у 27% больных, в т.ч. — по степени дифференцировки опухоли — у 34%, и по стадии — у 51% больных указанной группы.
После операции стадия увеличивается у 12,4% больных с I стадией и у 27,3% — со II клинической стадией РТМ, что оказывает значительное влияние на выживаемость.
Из этого следует очень важный практический вывод: для больных раком эндометрия результаты лечения зависят не только от клинической стадии, но и от полученных данных морфологического исследования удаленного препарата.
Лучевое лечение после операции может включать в себя внутриполостную и дистанционную лучевую терапию, причем последняя может проводиться на зону тазовых и/или поясничных лимфатических узлов, а также захватывать всю брюшную полость.
Больным с IA стадией высоко— и умереннодифференцированной аденокарциномы, а также при отсутствии раковых эмболов в лимфатических щелях производится только пангистерэктомия.
При IA стадии низкодифференцированной аденокарциномы лечение дополняется внутриполостной лучевой терапией, которая также проводится и при IB стадии высоко— и умереннодифференцированного РТМ.
При IB стадии низкодифференцированного рака эндометрия после операции показана дистанционная лучевая терапия на область малого таза или внутриполостная лучевая терапия. Целесообразно применение лучевой терапии также больным со IIA стадией высоко— и умереннодиференцированной аденокарциномы эндометрия.
При IC, IIB, IIIA стадиях независимо от степени дифференцировки опухоли показано проведение дистанционной лучевой терапии на область малого таза и внутриполостная лучевая терапия, которая также проводится при I-II стадиях, если раковые эмболы выявлены в лимфатических щелях.
При III A, B, C стадиях высоко-, умеренно— и низкодифференцированном раке эндометрия (при IIIA стадии объем операции дополняется удалением большого сальника) на послеоперационном этапе используется химиогормонолучевое лечение. Гормонотерапия включается в комплекс лечебных мероприятий в связи с наличием у больных рецептороположительных по прогестерону и по эстрадиолу опухолей. Лучевая терапия включает в себя сочетанные методы воздействия. При поражении парааортальных лимфатических узлов необходимо наружное облучение этой области.
При IV стадии рака эндометрия с учетом общего состояния больной, данных обследования, особенностей распространения опухолевого процесса возможно применение лучевой и химиогормонотерапии.
Больным РТМ при гистологическом подтверждении метастазов в поясничные лимфатические узлы проводится дистанционная лучевая терапия и на эту область, СОД которой не должна превышать 45–50 Гр. Дистанционная лучевая терапия на область поясничных лимфатических узлов повышает выживаемость больных РТМ.
Данные исследований указывают, что лучевая терапия в сочетании с применением мегестрола значительно повышает 5-летнюю выживаемость больных с метастазами в поясничные лимфатические узлы по сравнению с лечением таких больных только мегестролом (53 и 12,5% соответственно). Важную роль играют размеры метастазов в поясничные лимфатические узлы. Так, 5-летняя выживаемость достигает 67% при микрометастазах и составляет только 17% при увеличении лимфатических узлов.
Гормонотерапия
Эра использования гормонотерапии при РТМ началась в 1961 г., когда Kelley и Baker с успехом применили гидроксипрогестерон капронат у больных с метастазами в легкие. Положительный эффект был отмечен в 29% наблюдений. В нашей стране первое сообщение о благоприятных результатах применения гидроксипрогестерона капроната было сделано в 1968 г. Л.А. Новиковой и Г.Н. Вершининой. Согласно их данным, применение гидроксипрогестерона капроната в непрерывном режиме у 1/3 больных РТМ привело к регрессии метастатических и рецидивных опухолей.
Перед клиницистом при назначении адъювантной гормонотерапии (АГТ) по поводу рака эндометрия возникает вопрос ее эффективности у данной пациентки. На эффективность гормонотерапии при лечении РТМ влияют: гистологическая дифференцировка опухоли, стадия опухолевого процесса, период времени от установления диагноза до начала лечения, продолжительность безрецидивного периода, а главное — содержание рецепторов прогестерона и эстрадиола в опухолевых клетках.
Включение АГТ в комплексное лечение РТМ улучшает отдаленные результаты и не сопровождается серьезными побочными эффектами. Так, при проведении комплексного лечения больных РТМ, включающего гидроксипрогестерона капронат, 5-летняя выживаемость достигает 89,9–93,3% по сравнению с 56,3–77,3% без использования АГТ.
Проведение АГТ сопровождается увеличением продолжительности безрецидивного периода жизни пациенток. Так, у больных, получавших АГТ гидроксипрогестерона капронатом, безрецидивный период в 2 раза больше, чем в контрольной группе. При наличии лечебного эффекта средняя продолжительность жизни составляет 23–29 мес, тогда как при его отсутствии — лишь 6 мес.
Однако имеются и противоположные результаты исследований ряда отечественных и зарубежных авторов, свидетельствующие о том, что применение синтетических прогестинов в качестве АГТ не улучшает показатели выживаемости больных РТМ. Так, анализ результатов 6 крупномасштабных исследований (4351 пациентка) показал, что применение АГТ (гестагенотерапии) не улучшает выживаемость и практически не влияет на показатель летальности и частоту рецидивов РТМ. Большое рандомизированное исследование с применением плацебо, включающее 1148 пациенток с начальными стадиями РТМ, продемонстрировало отсутствие какого-либо положительного влияния АГТ на продолжительность жизни и безрецидивного периода. Кроме того, Gadliordi L. выявил, что гестагенотерапия в сочетании с хирургическим и лучевым методами воздействия не увеличивает выживаемость больных РТМ.
По данным клинических исследований отделения гинекологии ГУ РОНЦ им. Н. Н. Блохина РАМН применение АГТ не оказывает существенного влияния на отдаленные результаты лечения и возникновение рецидивов и метастазов при РТМ.
Результаты исследования методов лечения РТМ в Великобритании показали, что гестагены следует применять при распространенных формах заболевания, рецидивах и метастазах, а при ранних стадиях их использование нецелесообразно.
В комбинированном и комплексном лечении больных раком эндометрия при использовании АГТ назначаются следующие гормональные препараты:
медроксипрогестерон капронат — внутрь, по 200–600 мг, ежедневно;
медроксипрогестерон ацетат — внутрь или в/м, по 500–1000 мг, 1 раз в неделю;
гестонорона капроат — 200 мг, в/м, 1 раз в неделю;
мегестрол — 160–320 мг в день;
тамоксифен в сочетании с гестагенами — 10–20 мг, внутрь, ежедневно.
Таким образом, единого мнения о роли гормонотерапии в качестве адъювантного компонента в комбинированном и комплексном лечении больных РТМ не существует.
Химиотерапия
Химиотерапия в комплексе с лучевой терапией применяется у больных диссеминированным раком эндометрия, включая IIIА стадию у больных с неблагоприятными факторами прогноза, а также при возникновении рецидива и метастазов заболевания. Следует отметить, что в большинстве наблюдений ремиссия бывает кратковременной, при этом медиана продолжительности жизни больных составляет 4–8 мес.
Наиболее эффективными являются схемы полихимиотерапии, состоящие из комбинации доксорубицина и цисплатина, а также циклофосфамида. Их применение позволяет получить ремиссию у 38–76% больных. В последнее время появились работы, дающие основание рассчитывать на возможное использование с получением клинического эффекта паклитаксела в режиме как моно-, так и полихимиотерапии, увеличивая эффективность лечения до 64%.
Схемы химиотерапии представлены в таблице 2.
Таблица 2
Схемы химиотерапии при РТМ
| Комбинация | Доза и режим лечения |
| Доксорубицин Цисплатин |
60 мг/м2, в/в, в 1 день, 60 мг/м2, в/в, в 1 день. Циклы повторяют каждые 3 нед |
| Цисплатин Циклофосфамид |
100 мг/м2, в/в, в 1, 8, 15 дни, 1000 мг/м2, в/в, в 1 день. Циклы повторяют каждые 3 нед |
| Доксорубицин Циклофосфамид |
30 мг/м2, в/в, в 1, 8 дни, 100 мг/м2, внутрь, в 1-14 дни. Циклы повторяют каждые 3-4 нед |
| Ифосфамид Винкристин Доксорубицин |
1,5 мг/м2, в/в, в 3-6 дни, 2 мг, в/в, в 1 день, 40-60 мг/м2, во 2 день. Циклы повторяют каждые 3-4 нед |
| Доксорубицин Винкристин Циклофосфамид Фторурацил |
30 мг/м2, в/в, в 1 день, 1 мг, в/в, в 2 день, 300 мг/м2, в/в, в 3-6 дни, 400 мг/м2, в/в, в 3-6 дни. Циклы повторяют каждые 4 нед |
Результаты лечения и факторы прогноза
Результаты лечения больных РТМ во многом зависят от основных клинико-морфологических признаков данной онкогинекологической патологии.
Общая выживаемость больных раком эндометрия колеблется от 73 до 82%. На 5-летнюю выживаемость оказывают влияние:
1. Стадия заболевания
По сводным данным Petterrson F., при I стадии 5 лет живут 82% больных, при II стадии — 65% больных, при III стадии — 44% больных и при IV стадии — 15% больных.
Конкретизируя 5-летнюю выживаемость больных РТМ согласно классификации FIGO, этот показатель составляет при IA стадии 94,1%, при IB стадии — 89,5%, при IС стадии — 79,2%, при II стадии — 64%, причем при IIA стадии рака эндометрия живы 5 лет — 95% больных, при III стадии — 25,2%.
2. Возраст пациентки
Имеется четкая зависимость 5-летней выживаемости и возраста. Так, у больных моложе 50 лет этот показатель составляет 91,2%, в то время как у больных старше 70 лет она составляет всего 60,9%. Снижение выживаемости пожилых больных объясняется наличием у них неблагоприятных факторов прогноза.
3. Степень дифференцировки
Для рака эндометрия это важный прогностический фактор. При высокодифференцированном РТМ 5-летняя безрецидивная выживаемость составляет 92%, при умереннодифференцированном — 86%, при низкодифференцированном — 64%, а при редких гистологических типах рака эндометрия — всего 33%.
4. Глубина инвазии
Также является одним из существенных факторов прогноза. При отсутствии или поверхностной инвазии опухолью миометрия 5-летняя выживаемость составляет 80–90%, а при глубокой — только 60%. Это подтверждается данными литературы. Так, при наличии опухоли в пределах эндометрия выживаемость составила 95,4%, при глубине инвазии до 0,5 см — 88,5%, от 0,5 до 1 см — 82% и более 1 см — 65,7%.
5. Раковые эмболы в лимфатических щелях
Их наличие является независимым прогностическим фактором развития прогрессирования и неблагоприятного исхода при РТМ.
По данным группы Hanson M.B., частота обнаружения раковых эмболов составляет 2% при высокодифференцированном по сравнению с 42% при низкодифференцированном РТМ и 5% при поверхностной по сравнению с 70% при глубокой инвазии в миометрий. При I стадии РТМ и отсутствии раковых эмболов в лимфатических щелях 5-летняя выживаемость составляет 90,9%, а при их наличии — снижается до 73,3%.
6. Распространение опухоли на перешеек или шейку матки
Риск развития диссеминации увеличивается, в первую очередь, за счет метастазов в лимфатические узлы. Известно, что при поражении дна матки прогрессирование наблюдается примерно у 13% больных, а при переходе на перешеек или шейку матки — у 44%.
7. Метастазы в яичники
Чаще возникают у больных при наличии нескольких неблагоприятных факторов прогноза РТМ. Следует отметить, что у 20% пациенток метастазы в яичники являются единственным плохим прогностическим признаком, при этом у подобных больных 5-летняя выживаемость достаточно высока — 85%.
8. Обнаружение опухолевых клеток в смывах из брюшной полости
По данным J. Lurain, прогностическая ценность спорна. Одни авторы указывают на увеличение риска возникновения диссеминации при наличии опухолевых клеток в смывах, другие — на высокий показатель 5-летней выживаемости (до 90%) при условии отсутствия других признаков распространения опухолевого процесса.
9. Метастазы в лимфатические узлы
Являются высокозначимым прогностическим фактором. При наличии метастазов в лимфатические узлы 5-летняя безрецидивная выживаемость составляет 54% и при их отсутствии — 90%. По данным GOC, одним из важнейших прогностических факторов при РТМ является наличие или отсутствие метастазов в поясничные лимфатические узлы.
10. Размеры опухоли
Оказывают влияние на прогноз и выживаемость больных РТМ.
При опухолях менее 2 см 5-летняя выживаемость составляет 93–98%, при опухолях более 2 см — 80–84%, а при опухолях, занимающих всю полость матки — до 64%.
11. Содержание рецепторов стероидных гормонов в опухоли
В настоящее время не вызывает сомнения тот факт, что содержание в аденокарциноме эндометрия РП и РЭ является важным признаком, определяющим не только чувствительность к гормонотерапии, но и независимым прогностическим фактором. Установлено, что уровень РП свыше 100 фмоль/мг белка предполагает высокий показатель безрецидивной выживаемости независимо от основных клинико-морфологических признаков РТМ. Также выявлено, что в РП-отрицательных опухолях вероятность развития метастазов РМТ увеличивается в 2 раза, а в РЭ-положительных опухолях (РЭ свыше 50 фмоль/мг белка) — снижается практически в 4 раза.
12. Плоидность опухолевых клеток и индекс пролиферации
По данным проточной цитометрии, 60–70% аденокарцином тела матки диплоидны. При увеличении стадии и глубины инвазии в миометрий, а также при снижении степени дифференцировки, возрастает частота выявления анеуплоидных опухолей, что подтверждается снижением выживаемости. Прогноз также определяется индексом пролиферации.
13. Простагландины (ПГ) серии Е
Высокое содержание ПГ серии Е в аденокарциноме эндометрия является существенным прогностическим фактором у больных, находящихся в постменопаузе более 6 лет, при IC, II-IV стадиях, при низкодифференцированной аденокарциноме и аденокарциноме с плоскоклеточной метаплазией, при глубине инвазии опухоли в миометрий более 1 см и ее размерах свыше 2 см, в рецептороотрицательных опухолях по РП и РЭ, а также при наличии метастазов.
Наблюдение, развитие рецидивов и метастазов
В течение первых 2–3 лет больные подлежат тщательному наблюдению, т.к. в эти сроки велика вероятность развития рецидивов и метастазов РТМ. Каждые 3–4 мес помимо гинекологического исследования обязательным является УЗТ малого таза и брюшной полости, а при показаниях, для уточнения диагноза — КТ. В последующие годы контрольные исследования проводятся каждые 6–8 мес.
Рентгенография органов грудной полости производится раз в 12 мес, при показаниях (наличие неблагоприятных факторов прогноза) — раз в 6 мес, с целью исключения метастатического поражения легких, которое практически у половины больных с метастазами в легкие не имеет клинических проявлений.
Наблюдение за больными РТМ предполагает определение концентрации СА 125 в крови, повышение которого должно указывать на прогрессирование заболевания. Однако при малых размерах рецидива или метастазов концентрация СА125 может оставаться в норме, что снижает ценность этого метода.
Развитие рецидивов и метастазов
Несмотря на совершенствование методов профилактики, ранней диагностики, по-прежнему в большом числе случаев заболевание выявляется, к сожалению, не в начальной стадии, и радикальное лечение трудно осуществимо. Отдаленные результаты лечения рака эндометрия остаются не вполне удовлетворительными. До 30–40% больных, страдающих РТМ, умирают от прогрессирования заболевания, обусловленного неизлеченностью первичной опухоли, развитием рецидивов заболевания и отдаленных метастазов.
Данные последних лет свидетельствуют о высокой частоте рецидивов опухоли эндометрия — не менее 14,5%.
Возникновение рецидива обусловлено целым рядом факторов:
— степенью дифференцировки первичного опухолевого процесса,
— глубиной инвазии в подлежащие ткани,
— вовлечением в неопластический процесс кровеносных сосудов и элементов лимфатической системы,
— возрастом больных (старше 40 лет).
Время появления рецидивов заболевания различно и колеблется от 6 мес до многих лет (на нашем опыте — до 36). Большинство рецидивов рака эндометрия возникает в течение первых 2 лет после проведения хирургического, комбинированного или комплексного лечения.
У 33% пациенток наблюдаются рецидивы во влагалище, у 24% — во влагалище с распространением на малый таз, у 14% — только в малом тазу. У 20% больных одновременно имеются рецидив и отдаленные метастазы. У 18% больных рецидивы возникают через 3,5 года после первичного лечения.
Рецидивы первого года составляют 31,3% всех случаев возврата болезни, первых 2 лет — 60,2%.
Важнейшими факторами, влияющими на возникновение метастазов рака эндометрия в лимфатические узлы, являются:
— степень дифференцировки первичной опухоли,
— ее инвазия в миометрий,
— размеры опухоли,
— наличие опухолевых эмболов,
— вовлечение в опухолевый процесс шейки матки,
— наличие опухолевых клеток в перитонеальной жидкости,
— метастазы в придатки матки.
Внутренние подвздошные лимфатические узлы являются местом наиболее частого расположения единичных метастазов, в то время как наружные лимфатические узлы — наиболее частым местом множественного метастатического поражения лимфатических узлов.
Частота метастазов в лимфатические узлы и частота рецидива заболевания составили 8,4 и 12,5% соответственно.
Частота рецидива в случаях поражения одного из лимфатических узлов составляет 40%, в то время как при поражении 3 и более лимфатических узлов частота рецидивов возрастает до 70%.
Во всех случаях наличия рецидива заболевания обнаружены отдаленные метастазы.
По данным группы Takeshima N., среди 360 больных, у которых не были поражены лимфатические узлы, частота рецидивов составила лишь 8,6%. На основании этих данных, ученый сделал заключение о целесообразности выполнения тазовой лимфаденэктомии в группе больных высокого риска, снижая тем самым вероятность возникновения рецидивов заболевания.
Придатки матки при раке эндометрия вовлекаются в опухолевый процесс непосредственно или метастатическим путем. Частота метастатического поражения придатков матки, по данным различных авторов, колеблется от 0,8 до 15%. Результаты аутопсий больных, умерших от РТМ, указывают на более частое поражение яичников, при этом метастазы в яичники выявляются в трети наблюдений. Таким образом наличие метастазов в яичники зависит от гистотипа опухоли, клинической стадии, глубины инвазии, наличия метастазов в лимфатические узлы и менструальной функции больных.
Частота метастазов в периферические отделы скелета составляет около 1%, общее поражение костей — 5–6%.
Метастазы в легкие встречаются у больных в 2,3–5,8% случаев. Обращает на себя внимание, что на секции частота обнаружения метастазов выше — до 44%. Для метастазов рака эндометрия в легкие характерно их множественное поражение (65%). Солитарные метастазы встречаются редко (10%). Размеры метастазов рака эндометрия в легкие в 70% наблюдений колеблются от 1 до 3 см. Метастазы рака эндометрия в легкие диагностируются в сроки от 4 до 92 мес от начала первичного лечения. Средний срок появления вторичных изменений в легких составляет 2 года.
Метастазы рака эндометрия в кости весьма редки и встречаются большей частью в запущенных случаях рака или на секции.
В литературе зарегистрированы метастазы рака эндометрия в головной мозг, молочные железы и др.
Лечение рецидивов и метастазов
Основным методом лечения рецидивов РТМ является лучевая терапия.
У больных раком эндометрия Ш стадии применяется лучевая терапия на область брюшной полости. Выживаемость 5-летняя составляет 36%. Средняя продолжительность жизни больных, получавших лучевую терапию, составляет 9 мес.
Проведенный анализ использования различных методов при лечении метастазов рака эндометрия в легкие выявил преимущества комбинированного и комплексного лечения. Использование химиотерапии в составе того или иного методов лечения с применением препаратов производных платины эффективнее, чем лечение стандартными схемами (см. раздел “Химиотерапия”).
У больных с солитарным метастазом РТМ в легкое, при условии, что он является единственным проявлением заболевания, возможно его оперативное удаление с последующим применением дополнительных методов терапии, что улучшает отдаленные результаты лечения.
Гормонотерапия рецидивов и метастазов
Метастазирующие карциномы эндометрия достаточно успешно лечатся гестагенами. Полную или почти полную регрессию опухоли некоторые авторы получали практически у 50% больных. В некоторых случаях ремиссия продолжалась до 5 лет.
Наиболее благоприятны результаты лечения у больных с гистологическим диагнозом высокодифференцированной аденокарциномы или аденоакантомы и у больных с длительным разрывом между первичным лечением и возникновением метастазов. Лучше всего поддаются лечению метастазы в легкие. Введение гидроксипрогестерона капроната (до 7 г в неделю) безопасно и хорошо переносимо. Нежелательные эффекты редки.
В целом положительная реакция больных раком эндометрия на лечение прогестинами в 70-е гг. ХХ в. составляла в среднем 30–34%. Более поздние сообщения свидетельствуют о низкой эффективности такого лечения, достигающей лишь 15–16% после перорального и парентерального введения прогестинов, средняя продолжительность ремиссии не превышала 3–4 мес, при средней продолжительности выживания 9–10 мес.
Обсуждая возможности гормональной терапии больных раком эндометрия, следует подчеркнуть значение в прогнозе лечения 2 факторов: гистотипа опухоли и статуса гормональных рецепторов. Большинство авторов утверждает, что лучшая реакция больных отмечена в случае хорошо дифференцированных опухолей и тесно коррелирует с рецепторным статусом.
На чувствительность метастазов рака эндометрия к гидроксипрогестерона капронату и медроксипрогестерону (пролонгированная форма) наибольшее влияние оказывает степень дифференцировки первичной опухоли: она превышает 50% при G1–2 и составляет менее 15% при G3. Для достижения клинического эффекта в первые 2–3 мес важно применять высокие дозы гидроксипрогестерона капроната — до 3,5 г в неделю. При достижении ремиссии дозы препарата снижаются. Опасно прекращение прогестинотерапии после достижения ремиссии, т.к. это приводит к быстрому возобновлению роста опухолевых узлов.
Высокая чувствительность рецидивов и метастазов рака эндометрия к прогестинотерапии отмечена при прогестинопозитивных опухолях, а при негативных — к полихимиотерапии. Таким образом, синтетические прогестагены можно считать стероидами выбора при лечении рецидивов и метастазов рака эндометрия. Эффективность лечения этих тяжелых больных повышается, если прогестинотерапия сочетается с антиэстрогенами и полихимиотерапией.
Химиотерапия рецидивов и метастазов
Результаты хирургического, химиогормонального и лучевого лечения рецидивов и метастазов РТМ, представленные в литературе, весьма противоречивы. На химиотерапию возлагаются большие надежды как на эффективный метод лечения метастазов и рецидивов рака эндометрия. Важнейшим независимым прогностическим фактором является распространение опухоли к моменту установления диагноза. Химиотерапия остается единственным методом лечения тех больных, у которых обнаруживаются далеко зашедшие или рецидивирующие формы болезни, и которым не показаны ни хирургическое вмешательство, ни лучевая терапия, .
Необходимы дальнейшие исследования химиотерапевтов для создания более перспективных комбинаций с другими, более совершенными химиопрепаратами и гормональными агентами, потенциальный резерв которых далеко не исчерпан. Имеются некоторые пути для улучшения лечения этих исключительно тяжелых категорий больных: новые пути введения в организм больных ключевых химиопрепаратов, детальная разработка индивидуальных дозировок и биохимическая модуляция.
В целом, прогноз больных с рецидивами в культе влагалища лучше, чем с метастазами в тазовые лимфатические узлы, которые в свою очередь имеют более благоприятный прогноз, чем больные с отдаленными метастазами. Выживаемость также выше у больных с первичными высокодифференцированными опухолями и поздним (спустя более чем 3 г. после лечения) прогрессированием.
Из вышеизложенного следует, что проблема лечения больных раком эндометрия и его результатов окончательно не решена. До конца не изучено значение и последовательность каждого метода терапии как в отдельности, так и в различных комбинациях. Лишь крупномасштабные кооперированные исследования в специализированных медицинских учреждениях позволят усовершенствовать методы терапии и тем самым повысить выживаемость больных РТМ.
На наш взгляд, перспектива развития современной онкогинекологии должна основываться на усовершенствовании методов диагностики (включая неинвазивные, такие как УЗТ), разработке новых технологий лучевых методов воздействия, поиске высокоэффективных схем химиотерапии и четком определении показаний использования гормонотерапии в лечении больных РТМ.
Литература
Авдеев В.И. Клиническое значение изучения гормонального статуса и рецепторов стероидных гормонов в опухоли у больных раком эндометрия: Автореф. ...дис. канд. мед. наук.— М., 1987.— 27 с.
Адъювантная гормонотерапия рака эндометрия: Методические рекомендации/Под ред. Е.Г. Новиковой и др.— М., 1991.
Алейникова Т.П. Клиника, диагностика и лечение РТМ.— М., 1968.
Бакулева Л.П. и др. ...Тезисы Всесоюзного симпозиума “Профилактика, ранняя диагностика и комплексное лечение рака тела матки”, октябрь, 1981.— Псков, Ленинград, 1981.— 44 c.
Баринов В. В. Рак тела матки (диагностика, лечение, факторы прогноза): Автореф. ...дис. докт. мед. наук.— М., 1999.— 48 с.
Бокина Л.И. Рецидивы и метастазы рака тела матки (отдаленные результаты лечения и факторы прогноза): Автореф. ...дис. канд. мед. наук.— М., 1998. — 24 с.
Бохман Я.В. Метастазы рака матки. — Л.: Медицина, 1976.
Бохман Я.В. Рак тела матки.— Кишинев: Шниица, 1972.
Бохман Я.В. Руководство по онкогинекологии.— Л.: Медицина, 1989.
Бохман Я.В. и др. Гормонотерапия рака эндометрия.— СПб: Гиппократ, 1992.— 163 с.
Бохман Я.В. и др. Новые подходы к лечению гинекологического рака.— СПб.: 1993.— С. 127–180.
Вехова Л.И. и др. ...Cб. Злокачественные новообразования у женщин молодого возраста.— М., 1991.— С. 128–133.
Вишневская Е.Е. и др. Ошибки в онкогинекологической практике.— Минск, 1994.— С. 24–46.
Глебова М.И. Рак матки.— М., 1977.
Двойрин В.В. и др. Заболеваемость и смертность от онкологических заболеваний в странах СНГ.— М.: PОНЦ им. Н. Н. Блохина РАМН, 1995.— 227 с.
Ермакова Н.А. Количественная оценка уровня эстрогенного фона у больных раком эндометрия как показателя чувствительности опухоли к гормонотерапии: Автореф. ... дис. канд. мед. наук.— М., 1996.— 31 с.
Избранные лекции по клинической онкологии/Под ред. В.И. Чиссова и др.— М., 2000.— 708 с.
Козаченко В.П. Рак матки.— М., 1983.— 157 с.
Козаченко В.П. ...Практическая гинекология.— 1999.— Т. 1.— № 1.— С. 8–11.
Колосов А.Е. и др. Рак тела матки: диагностика, лечение, прогноз.— СПб-Киров, 2000.— 128 с.
Максимов С.Я. Минимальный рак эндометрия.— СПб.: Гиппократ, 1992.
Серебров А.И. Рак матки.— М., 1957.
Трапезников Н.Н. и др. Злокачественные новообразования в России в 1997 г. (Статистический сборник).— М., 1999.
Харитонова Т.В. Рак тела матки.— М., 1988.
Цырлина Е.В. и др. ...Вопр. онкологии.— 1989.— Т. 35.— № 6.— С. 675–680.
Чекалова М.А. Ультразвуковая диагностика злокачественных опухолей тела матки: Автореф. ...дис. докт. мед. наук.— М., 1998.— 34 с.
Чулкова О.В. и др. Казан. мед. журн.— 2000.— Т. 81.— № 4.— С. 297–300.
Aalders J. et al. ...Obstet. Gynecol.— 1980.— V. 56.— P. 419–446.
Abeler V M. et al. ...Gynecol. Oncol.— 1990.— V. 36.— P. 321–326.
Abeler V. M. et al. ...Gynecol. Oncol.— 1991.— V. 40.— P. 207–217.
Abeler V. M. et al. ...Int. J. Gynecol. Cancer.— 1992.— V. 2.— P. 9–22.
Aida H. et al. ...Nippon-Sanka-Fujinka-Gakkai-Zasshi.–1992.— V. 44 (3).— P. 315–322.
Ambros R. A. et al. ...Gynecol. Oncol.— 1992.— V. 45.— P. 235–239.
Assikis V.J. et al. ...Int. J. Gynecol. Obstet.— 1995.— V. 49.— P. 241–257.
Balanescu I. et al. ...Oncologia (Rom.).— 1992.— V. 1.— P. 30–34.
Ballon S.C. et al. ...Gynec. Oncology.— 1979.-V. 7 (1).— P. 56–65.
Ballon S.C. et al. ...Endometrial Carcinoma.— Boston.— 1978.— P. 182–185.
Barakat R. et al. Cancer Management: A Multidisciplinary Approach. NY: PRR, Huntington, 1998.
Berman M.L. et al. ...Amer. J. Obstet. and Gynecol.— 1980.— V. 161.— P. 1247–1252.
Blake P. ...International Brachytherapy.— 1995.— P. 1–5.
Boidi A. et al. ...Minerva Ginecol.— 1978.— V. 30.— P. 527–530.
Bokhman J.V. ...Gynecol. Oncol.— 1983.— V. 157.— P. 59–69.
Bonte J. ...Pressented at the Ujohn conference onmedroxyprogesteroneacetate — Brussels.— 1969.— P. 59–69.
Bonte J. et al. ...Gynecol. Oncol.— 1976.— V. 6.— P. 60–75.
Boronow R. С. et al. ...Obstet. Gynecol.— 1984.— V. 63.— P. 825–832.
Bourne Т. H. et al. ...Gynecol. Oncol.— 1991.— V. 40.— P. 253–259.
Brinton L. A. et al. ...Am. J. Obstet. Gynecol.— 1992.— V. 167.— P. 1317–1325.
Bruckner H. et al. ...Obstet. Gynecol.— 1977.— V. 50.— P. 10–12.
Brufman G. et al. ...Radiol. Clin. (Basel).— 1978.— V. 47 (6).— P. 456–463.
Brun G. et al. ...Rev. Fr. Gynecol. et Obstet.— 1987.— V. 82 (10).— Р. 545–553.
Cao Z. et al. ...Chung-Hua-Fu-Ko-Tsa-Chih.— 1995.— V. 30 (3).— P. 148–152.
Chambers J. Т. et al. ...Clin. Obstet. Gynecol.— 1992.— V. 35.— P. 28–39.
Christophenson W M. et al. ...Cancer.— 1982.— V. 49.— P. 1511–1523.
Clain A. ...Brit. J. Cancer.— 1965.— V. 19.— P. 15–19.
Cohen C. et al. ...Obstet. Gynecol.— 1984.— V. 63.— P. 719–726.
Corr B.W. et al. ...Int. J. Radial. Oncol. Biol. Phys.— 1992.— V. 24.— P. 223–227.
Cowles T.A. et al ...Obstet. Gynecol.— 1985.— V. 66.— P. 413–416.
Cox L.W. et al. ...Sydney Australia.— 1964.— P. 42–46.
Creasman W.Т. et al. ...Cancer.— 1987.— V. 60.— P. 2035–2041.
Creasman W.Т. et al. ...Am. J. Obstet. Gynecol.— 1981.— V. 141.— P. 921–929.
Creasman W.T. et al. ...Am. J. Obstet. Gynecol.— 1985.— V. 151 (7).— Р. 922–932.
Descamps P. et al. ...Gynecol. Oncol.— 1997.— V. 64 (1).— P. 54–58.
DiSaia P.J. et al ...Am. J. Obstet. Gynecol.— 1985.— V. 151.— P. 1009–1015.
Doering D.L. et al. ...Obstet. Gynecol.— 1989.— V. 74.— P. 930–933.
DuBeshter В. et al. ...Obstet. Gynecol.— 1991.— V. 77.— P. 458–462.
Eifel P. et al. ...Cancer.— 1982.— V. 50.— P. 163–170.
Eisner R.F. et al. ...Gynecol. Oncol.— 1989.— V. 33.— P. 335–339.
Feuer G.A. et al. ...Gynecol. Oncol.— 1987.— V. 27.— P. 164–169.
Fuller A.F. et al. ...Gynecol. Oncol.— 1985.— V. 22.— P. 174–180.
Gadliordi L.J. ...Minerva Ginec.— 1974.— V. 26.— Р. 243–255.
Geisinger К. R. et al. ...Cancer.— 1986.— V. 58.— P. 1518–1525.
Goff ВA. et al. ...Gynecol. Oncol.— 1990.— V. 38.— P. 46–48.
Goff В.A. et al. ...Gynecol. Oncol.— 1994.— V. 54.— P. 264–268.
Grady D. et al. ...Obstet. Gynecol.— 1995.— V. 85.— P. 304–313.
Granberg S. et al. ...Am. J. Obstet. Gynecol.— 1991.— V. 164.— P. 47–52.
Greven K.M. et al. ...Int. J. Radiat. Oncol. Biol. Phys.— 1989.— V. 17 (1).— P. 35–39.
Greven K.M. et al. ...Cancer.— 1987.— V. 60.— P. 419–421.
Grigsby P. et al. ...Int. J. Radial. Oncol. Biol. Phys.— 1987.— V. 13.— P. 483–488.
Grimes D.A. ...Am. J. Obstet. Gynecol.— 1982.— V. 142.— P. 1–6.
Hanson M.В. et at ...Cancer.— V. 55.— P. 1753–1757.
Hayakawa S. et al. ...Gan-To-Kagaku-Ryoho.— 1995.— V. 22 (9).— P. 1169–1175.
Hendrickson M. et al. ...Am. J. Surg. Pathol.— 1982.— V. 6.— P. 93–108.
Homesley H.D. et al. ...Am. J. Obstet. Gynecol.— 1992.— V. 167.— P. 1225–1230.
Hoskins P. et al. ...Gynecol. Cancer. (Proceeding of ASCO no. 820).— 2001.— V. 20.— P. 206a.
Jones D. et al. ...Clin. Radiol.— 1986.— V. 37.— P. 169–171.
Kanovitsh B. et al. ...Rev. Rheum.— 1964.— V. 31.— P. 469.
Kaunitz A.M. et al. ...J. Reprod. Med.— 1988.— V. 33.— P. 427–431.
Kelley R. et al. ...Nat. Cancer. Inst. Monogr.— 1960.— V. 9.— P. 235.
Kelley R.M. et al. Progestational agents in the treatment of carcinoma of the genitourinary tract. Progress in Gynecology/ Ed. S.H. Sturgis. et al. Grune and Stratton.— NY, 1970.— P. 362–369.
Kennedy B.J. ...J.A.M.A.— 1963.— V. 184.— P. 758–765.
Kistner R.W. ...Endocrine therapy of malignant diseases.— London.— 1972.— P. 350–362.
Kistner R.W. et al. ...Clin. Obst. Gyn.— 1968.— V. 11.— P. 439–445.
Kistner R.W. et al. ...Cancer.–1965.— V. 18.— P. 1563–1569.
Ktine R. C. et al. ...Gynecol. Oncol.— 1990.— V. 39.— P. 337–346.
Kudelka A.P. et al. ...Medical oncology. A comprehensive review.— 1993.— P. 273–278.
Kuten A. et al. ...Int. J. Radiat. Oncol. Biol. Phys.— 1989.— V. 17 (1).— P. 29–34.
Larson D M. et al. ...Obstet. Gynecol.— 1992.— V. 79. P. 998–1001.
Larson D.M. et al. ...Obstet. Gynecol.— 1996.— V. 88 (3).— P. 394–398.
Lawton F. ...Br. J. Obstet. Gynecol.— 1997.— V. 104 (2).— Р. 127–134.
Lissoni A. et al. ...Ann. Oncol.— 1997.— V. 8.— P. 969–972.
Lindahl B. et al. ...Anticancerres.— 1987.— V. 6.— P. 1317–1320.
Lotocki R.J. et al. ...Amer. J. Obstet. Gyn.— 1983.— V. 146 (1).— P. 141–145.
Lurain J.R et al. ...Obstet. Gynecol.— 1991.— V. 78.— P. 63–69.
Lurain J.R. ...Gynecol. Oncol.— 1992.— V. 46.— P. 143–144.
Lverson 0.E. ...Am. J. Obstet. Gynecol.— 1986.— V. 155.— P. 770–776.
MacDonald R.R. et al. ...Br. J. Obstet.Gynecol.— 1988.— V. 95 (3).— Р. 166–174.
MacMahon В. ...Gynecol. Oncol.— 1974.— V. 2.— P. 122–129.
Malkasian G.D. et al. ...Am. J. Obstet. Gynecol.— 1980.— V. 136.— P. 872–881.
Martin P.L. et al. Progestagens for endometrial cancer//Cochrane-Database-Syst-Rev.— 2000.— 2.— CD001040.
Melhern M. F. et al. ...Int. J. Gynecol. Pathol.— 1987.— V. 6.— P. 347–355.
Meyer P. et al. ...Louisiana Med. Soc.— 1965.— V. 117.— P. 166.
Moore Т.D. et al. ...J. Clin. Oncol.— 1991.— V. 9.— P. 1071–1088.
Morrow C.P. et al. ...Gynecol. Oncol.— 1990.— V. 36 (2).— P. 166–171.
Morrow C.P. et al. Gynecologic cancer surgery.— NY, 1996.— P. 569–597.
Morrow С.Р. et al. ...Gynecol. Oncol.— 1991.— V. 40.— P. 55–65.
Muss H.В. ...Semin. Oncol.— 1994.— V. 21.— P. 107–113.
Niloff J.M. et al. ...Am. J. Obstet. Gynecol.— 1984.— V. 148.— P. 1057–1058.
Nilson P.A. et al. ...Am. J. Obstet. Gynecol.— 1969.— V. 105.— P. 1099–1109.
Patsner В. et al. ...Am. J. Obstet. Gynecol.— 1988.— V. 158.— P. 399–402.
Pettersson F. Annual report on the results of treatment in gynecological cancer. Stockholm, Sweden.
Potish R A. et al. ...Obstet. Gynecol.— 1985.— V. 65.— P. 251–256.
Poulsen M.D. et al. ...Int. J. Radiat. Oncol. Biol. Rhys.— 1988.— V. 15.— P. 808–813.
Prat J. et al. ...Cancer.— 1991.— V. 68.— P. 2455–2459.
Rogerson L. et al. ...Eur. J. Gynecol. Oncol.— 1998.— V. CIC.— N 4.— Р. 331–332.
Rose Р.G. et al. ...Int. J. Radial. Oncol. Biol. Phys.— 1992.— V. 24.— P. 229–233.
Ross J.C. et al. ...Am. J. Surg. Pathol.— 1983.— V. 7.— P. 715–729.
Schink J.С. et al. ...Cancer.— 1991.— V. 67.— P. 2791–2794.
Schink J.С. et al. ...Obstet. Gynecol.— 1987.— V. 70.— P. 216–219.
Seltzer V.L. et al. ...Gynecol. Oncol.— 1976.— V. 4.— P. 232–237.
Seski J. et al. ...Obstet Gynecol.— 1982.-V. 59.— P. 225–228.
Sherman M E. et al. ...Am. J. Surg. Pathol.— 1992.— V. 16.— P. 600–610.
Silva E. G. et al. ...Mod. Pathol.— 1990.— V. 3.— P. 120–128.
Smith M. et al. ...Gynecol. Oncol.— 1985.— V. 22.— P. 154–161.
Stendahl U. et al. ...Int. J. Gynaecol. Pathol.— 1991.— V. 10.— P. 271–284.
Takeshima N. et al. ...Obstet. Gynecol.— 1996.— V. 88 (2).— P. 280–282.
Takeshima N. et al. ...Nippon. Saska. Fujinka. Gakkai. Zasshi.— 1994.— V. 46 (9).— P. 1200–1209.
Thigpen T. Approaches to the evalution and management of endometrial carcinoma/Forastiere A. (ed.) Gynecologic Cancer.— NY: Churchill Livingstone, 1984.
Thigpen T. et al. ...Gynecologic Oncology Group Study. Cancer Treat. Rep.— 1979.— V. 63.— P. 21–27.
Thigpen T. et al. ...Cancer.— 1987.— V. 60.— P. 2104–2116.
Trope C. et al. ...Eur. J. Cancer.— 1980.— V. 16.— P. 1025–1026.
Tsunoda H. et al. ...Nippon. Sanka. Fujinka — Gakkai — Zasshi.— 1996.— V. 48 (1).— P. 45–51.
Varner R.E. et al. ...Obstet. Gynecol.— 1991.— V. 78.— P. 195–199.
Vergote I. et al. ...Cancer.— 1989.— V. 64 (6).— Р. 1011–1016.
Wilson Т.О. et al. ...Am. J. Obstet Gynecol.— 1990.— V. 162.— P. 418–426.
Wolfson A.H. et al. ...Gynecol. Oncol.— V. 45.— P. 142–146.
Zaino R.J. et al. ...Gynecol. Oncol.— 1984.— V. 19.— P. 329–335.
Zucker P.К. et al. ...Cancer.— 1985.— V. 56.— P. 2256–2263.
Описание проверено экспертом
Оцените статью:
- Рак матки
- Рак тела матки
- Саркома матки
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
злокачественное новообразование матки
новообразование матки
рак матки, карцинома матки, рак матки у женщин, наличие гормонозависимых злокачественных заболеваний матки, опухоли матки, Фиброзная опухоль матки, несовместимая с беременностью,


