-
Доброкачественные новообразования мозговых оболочек
- Менингиомы
- “Биологическое поведение” менингиом
- Диагностика
- Особенности предоперационной подготовки
- Общие принципы хирургического лечения менингиом
- Прогноз
- Конвекситальные менингиомы
- Парасагиттальные менингиомы (ПСМ)
- Менингиомы передней трети ВСС и БСО
- Менингиомы средней трети ВСС и БСО
- Менингиомы задней трети ВСС и БСО
- Менингиомы передней черепной ямки
- Менингиомы площадки основной кости (рис. 4)
- Менингиомы бугорка турецкого седла
- Менингиомы средней черепной ямки
- Менингиомы крыльев основной кости
- Менингиомы кавернозного синуса
- Менингиомы задней черепной ямки
- Менингиомы редких локализаций
- Опухоли мозговых оболочек неменинготелиального происхождения (фиброма, остеома, хондрома, липома, фиброзная гистиоцитома, сóлидная гемангиобластома, меланоцитома, диффузный меланоз)
D32 Доброкачественное новообразование мозговых оболочек, МКБ-10
Отредактировано: 23.08.2023
Доброкачественные новообразования мозговых оболочек
Составляют около 22% опухолей ЦНС и представлены преимущественно (в 98% случаев) менингиомами.
Менингиомы
Развиваются из клеток арахноэндотелия, находящихся в толще твердой мозговой оболочки и реже — в сосудистых сплетениях (отсюда устаревшее название — арахноэндотелиома).
Заболеваемость внутричерепными доброкачественными менингиомами (D32.0) составляет в среднем 2,8 случая на 100 тыс. населения в год, увеличивается с возрастом и достигает для людей 70–79 лет 8 на 100 тыс. в год. Спинальные менингиомы (D32.1) встречаются примерно в 10 раз реже. Среди больных менингиомами отмечается незначительное преобладание женщин.
Увеличивают вероятность возникновения менингиом рентгеновское и радиоактивное облучение, травма головы и пищевые нитриты. Возможное влияние повышенного магнитного поля (промышленные установки, МР-томографы) изучается.
Большинство (83–85%) менингиом составляют опухоли 1 степени злокачественности (раздел 3.1.1 классификации ВОЗ). Из них около 60% внутричерепных менингиом относятся к менинготелиальным (менинготелиоматозным), 25% — к переходными (“смешанного строения”) и 12% — к фиброзным (фибробластическим); остальные гистологические варианты встречаются редко. Среди спинальных менингиом по неясным причинам преобладают псаммоматозные. Поскольку различия в биологическом поведении указанных вариантов менингиом относительно невелики, в последние годы некоторыми авторами гистологический тип менингиомы игнорируется.
Атипические менингиомы (3.1.2) относятся ко 2 степени злокачественности, составляют около 10% менингиом. Гистологическими критериями атипии являются плотное расположение клеток в опухоли, ядерный полиморфизм, выпячивание ядрышка, повышенная митотическая активность, диффузный или пластинчатый рост, микронекрозы, а также наличие фокальных папиллярных структур.
Менингиомы представляют собой спорадические, т.е. ненаследуемые опухоли. Генетический дефект в большинстве менингиом находится в 22 хромосоме, в локусе 22q12.3-qter, неподалеку от гена нейрофиброматоза 2. Такие менингиомы характеризуются “классическим” биологическим поведением, встречаются чаще у женщин и содержат рецепторы стероидных гормонов. Одновременно с повреждением данного “гена менингиомы” возможны и дополнительные генетические дефекты, влияющие на биологическое поведение опухоли и ее патоморфологическую картину.
Возникновение меньшинства менингиом связано с другими генетическими аномалиями, при этом менингиомы с неповрежденной 22 хромосомой характеризуются значительной вариабельностью биологического поведения.
В менингиомах имеются и функционально активные рецепторы прогестерона и глюкокортикостероидов (первые ускоряют, вторые угнетают рост опухолевых клеток), а также рецепторы соматотропина и соматостатина (ускоряют рост менингиомы). Рецепторы эстрогенов достоверно выявлены в большинстве менингиом, роль их неясна.
“Биологическое поведение” менингиом
Термин предложен в связи с отсутствием четких корреляций между выраженностью гистологических признаков атипии менингиомы и прогнозом. Характеризуется скоростью роста менингиомы, ее способностью инфильтрировать окружающие ткани (в особенности мозг), разрушать кость, вызывать перитуморозный отек и формировать узлы большого и гигантского размера, а также (крайне редко) метастазировать во внутренние органы. Подразумевается, что “биологически агрессивные” или “биологически злокачественные” менингиомы чаще и быстрее рецидивируют, хотя все указанные факторы имеют существенно меньшее значение для прогноза по сравнению с радикальностью операции.
“Биологическое поведение” менингиом основания черепа — более доброкачественное. Примечательно, что среди них преобладают опухоли с нормальным кариотипом, тогда как конвекситальные и парасагиттальные менингиомы отличаются большей частотой хромосомных аномалий.
В подавляющем большинстве случаев менингиома прикрепляется к твердой мозговой оболочке (ТМО), прорастая оба ее листка. Даже если наружный листок ТМО в области места исходного роста менингиомы представляется непораженным, в его толще всегда есть опухолевые клетки (однако в таких случаях прилежащие костные структуры обычно остаются интактными).
В большинстве наблюдений менингиома прорастает ТМО и распространяется по гаверсовым каналам в прилежащие отделы кости. При этом чаще происходит стимуляция остеобластов с формированием гиперостоза, реже — при биологически агрессивных менингиомах — в области гиперостоза возникают очаги деструкции, еще реже встречается деструкция кости без сопутствующего гиперостоза.
Внешне непораженная надкостница над гиперостозом или участком деструкции кости обычно содержит клетки менингиомы и должна удаляться.
Примерно в 4% случаев менингиома прорастает мягкие ткани кнаружи от надкостницы, такой инфильтративный характер роста свидетельствует о биологической (а часто и гистологической) злокачественности опухоли.
Внутричерепной узел менингиомы обычно представляет собой образование более или менее округлой формы, в 60% случаев — более плотное, чем мозговое вещество. Плоскостные менингиомы встречаются менее, чем в 10% наблюдений, обычно имеют мягкую консистенцию.
Менингиома не имеет собственной капсулы. Капсула может формироваться только из окружающих опухоль нормальных тканей, подвергающихся изменениям (от лизиса до фиброза) в зависимости от биохимических особенностей опухоли и реакции прилежащих тканей.
Примерно в 20% случаев, особенно при локализации в области цистерн основания черепа, опухоль бывает покрыта двойной арахноидальной капсулой, представляющей собой смещенную и деформированную ликворную цистерну. Иногда в ней имеется некоторое количество ликвора с повышенным содержанием белка, что хорошо визуализируется на МРТ. Все проходящие через данную цистерну структуры находятся между листками капсулы менингиомы.
В большинстве (60%) наблюдений менингиома бывает отграничена от мозга однослойной арахноидальной капсулой, более или менее плотно сращенной с поверхностью опухоли. Такая капсула со стороны мозга может быть тонкой и гладкой, может — утолщенной, мутной, спаянной с мягкой мозговой оболочкой и сосудисто-нервными структурами, в этих случаях и на некотором отдалении от опухоли могут наблюдаться признаки реактивного арахноидита.
Примерно 10% менингиом не имеют арахноидальной капсулы, но опухоль не врастает в мягкую мозговую оболочку или кору и может быть легко отделена от мозга.
В 5% наблюдений граница между опухолью и мозгом бывает нечеткой, опухоль инфильтрирует (обычно местами) мягкую мозговую оболочку, распространяется в борозды, но не прорастает кору.
Наконец, явная инвазия коры мозга встречается в остающихся примерно 5% случаев и обычно расценивается как проявление биологической злокачественности менингиомы. Удаление таких опухолей осуществляется по принципам хирургии глиом (перитуморозная зона удаляется в функционально незначимых областях).
Все связанные с ТМО менингиомы кровоснабжаются из менингеальных сосудов, в той или иной степени гипертрофированных. Помимо этого, в кровоснабжении большинства менингиом принимают участие сосуды мозга из системы внутренних сонных или позвоночных артерий (в противоположность ранее существовавшему мнению, это не указывает на злокачественность опухоли). Отток крови происходит как в венозные образования ТМО, так и в ветви мозговых вен. В ткани менингиомы может наблюдаться артериовенозное шунтирование различной выраженности, в 1% случаев в прилежащем мозговом веществе встречаются артериовенозные мальформации.
Множественные менингиомы встречаются в 2% клинических наблюдений, но среди случайно выявленных менингиом доля множественных составляет 10%. Возникают, возможно, за счет местного метастазирования опухолевых клеток по ликворным пространствам, в патогенезе этого процесса играет роль повреждение (инактивация) Х-хромосомы.
Радиоиндуцированные менингиомы возникают через многие годы после рентгеновского или радиоактивного облучения головы (в частности после рентгеноэпиляции по поводу стригущего лишая), часто бывают множественными, инфильтрируют окружающие ткани, но характеризуются более доброкачественным биологическим поведением и лучшим прогнозом.
Случайно выявленные менингиомы в подавляющем большинстве не прогрессируют и не дают клинических симптомов в течение многих лет. Обычная тактика, особенно при отсутствии перитуморозного отека, — динамическое наблюдение.
Отек мозга при менингиомах связан преимущественно (возможно, и единственно) с экспрессией опухолью фактора роста эндотелия сосудов (ФРЭС, VEGF). Противоотечный эффект глюкокортикостероидов обусловлен тем, что их применение резко снижает выработку ФРЭС клетками менингиомы.
Поскольку в ткани менингиомы происходит синтез как тканевого тромбопластина (который может поступать в кровь и из прилежащего к опухоли отечного мозгового вещества), так и активатора плазминогена, при менингиомах могут наблюдаться нарушения системного гемостаза разной направленности. В большинстве случаев эти, вызванные опухолью, нарушения не достигают уровня клинической значимости, но иногда приводят как к внутричерепным (субарахноидальным, паренхиматозным, интравентрикулярным) кровоизлияниям, так и к профузным интраоперационным кровотечениям. В генезе последних имеют значение и локальные нарушения гемостаза в менингиоме, механизм которых и способы терапии пока неясны.
Диагностика
Очаговая симптоматика определяется локализацией опухоли. При конвекситальных менингиомах первым проявлением часто бывают эпилептические припадки. Степень внутричерепной гипертензии зависит от размеров, локализации опухоли и выраженности перитуморозного отека. Однако единственным практически патогномоничным клиническим симптомом является пальпируемый гиперостоз, встречающийся примерно у 50% больных с конвекситальными и парасагиттальными менингиомами. Обычно для менингиом характерно медленное (в течение месяцев и лет) развитие заболевания. Какие-либо другие особенности клинической картины не позволяют дифференцировать менингиому от опухоли другой гистологической природы.
Краниография, производимая часто на поликлиническом этапе обследования, может быть полезной в плане выявления локальных костных изменений (гиперостоза, деструкции кости, сосудистых борозд), признаков внутричерепной гипертензии и изредка встречающихся петрификатов в ткани опухоли. В современной нейрохирургической клинике роль краниографии минимальна.
Обязательный метод в диагностике менингиом — МРТ, позволяющая помимо установления локализации, размеров и распространенности опухоли выявить степень и направления дислокации мозговых структур, а также оценить наличие и выраженность отека мозга. При МРТ в режиме Т1 сигнал от менингиомы часто сходен с таковым от мозга, в режиме Т2 большинство менингиом характеризуется в той или иной степени гиперинтенсивным сигналом, при этом лучше выявляется перитуморозный отек мозга (рис. 1). При необходимости уточнения отношения менингиомы к магистральным сосудам и степени васкуляризации опухоли выполняется магнитно-резонансная АГ.
КТ обеспечивает лучшую визуализацию костных структур и тем самым дополняет МРТ. На КТ менингиомы выглядят обычно как округлой формы образование, связанное с ТМО (рис. 3). Изменение рентгеновской плотности менингиомы после внутривенного введения контрастного вещества позволяет оценить степень ее кровоснабжения. Кроме того, КТ в большей степени удовлетворяет требованиям послеоперационной диагностики, и наличие дооперационных КТ-снимков желательно.
Селективная АГ позволяет оценить степень вовлечения в процесс магистральных сосудов, а также васкуляризацию опухоли. С появлением магнитно-резонансной АГ и спиральной КТ роль селективной АГ снижается. Однако при обильно кровоснабженных менингиомах, в первую очередь базальных, в ходе АГ-исследования возможно осуществление эмболизации сосудов опухоли, что значительно уменьшает интраоперационную кровопотерю. Таким образом показания для селективной АГ должны устанавливаться в каждом конкретном случае.
Гиперинтенсивность по отношению к серому веществу МР-сигнала от опухоли на нативных (без контрастного усиления) Т2-взвешенных изображениях и в режиме протонной плотности указывает на высокое содержание воды в ткани менингиомы, т.е. на ее мягкую консистенцию или/и значительную васкуляризацию. Сопоставление МРТ с КТ (нативными и с контрастным усилением) или с данными АГ позволяет с достаточно высокой точностью судить о плотности опухоли, что имеет значение для планирования хирургического доступа.
Другие нейровизуализационные методики (гамма-энцефалография, включая однофотонную эмиссионную КТ, ПЭТ) в диагностике менингиом практического значения не имеют.
Особенности предоперационной подготовки
При наличии перитуморозного отека мозга, независимо от клинической выраженности внутричерепной гипертензии, больным в течение 2–4 дней перед операцией назначается дексаметазон, обычно 8–24 мг (в зависимости от выраженности отека) парентерально в первой половине дня. При выраженной внутричерепной гипертензии иногда назначают неосмотические диуретики, их доза не должна быть высокой (например, не более 40 мг фуросемида внутрь или 20 мг парентерально в сутки). Осмотические диуретики, кроме критических ситуаций, применять не следует. Категорически не рекомендуется ограничивать прием жидкости. Подбор схемы противосудорожной терапии желательно закончить до операции. Профилактическое назначение противосудорожных препаратов при отсутствии припадков в анамнезе не оправдано. При выявлении коагулопатии проводится ее своевременная коррекция.
В случае быстрого ухудшения состояния больного с менингиомой до операции, особенно при развитии нарушений сознания и витальных функций, экстренное (тотальное или частичное) удаление опухоли часто не улучшает прогноз (в связи с развивающимися в таких ситуациях нарушениями кровообращения в стволе мозга). Естественно, многое зависит от особенностей конкретного случая, но в общем можно рекомендовать вначале стабилизировать витальные функции, провести интенсивный курс противоотечной терапии, при показаниях установить вентрикулярный дренаж, и лишь после этого принимать решение об операции удаления опухоли.
Общие принципы хирургического лечения менингиом
В современной нейрохирургии утвердилось мнение о том, что операция не должна приводить к развитию у больного дополнительного стойкого неврологического дефицита. Иными словами, объем удаления опухоли определяется ожидаемым функциональным результатом, и радикальное удаление менингиомы не должно быть самоцелью. С другой стороны, через 15 лет после неполного удаления рецидивируют не менее 50% менингиом, что ведет к снижению показателей качества и продолжительности жизни больных.
Для формализации степени радикальности операций при менингиомах используется несколько модифицированная шкала Симпсона:
— тип 1 — макроскопически полное удаление опухоли с иссечением ТМО в месте исходного роста и резекцией всей пораженной кости;
— тип 2 — макроскопически полное удаление с коагуляцией ТМО в месте исходного роста;
— тип 3 — макроскопически полное удаление без иссечения или коагуляции ТМО в месте исходного роста и/или без резекции всей пораженной кости;
— тип 4 — частичное удаление опухоли;
— тип 5 — биопсия или декомпрессия.
В последнее время к 3 типу иногда стали относить операции, заканчивающиеся оставлением в ране небольших фрагментов опухоли, связанных с функционально значимыми структурами.
Операции выполняются в условиях комбинированной общей анестезии с использованием кровосберегающих методик. Головной конец операционного стола должен быть приподнят, поскольку расположение зоны операции выше уровня предсердий существенно уменьшает венозное кровотечение, также следует избегать сдавления вен шеи при сгибании головы.
Хирургический доступ должен обеспечивать максимальную визуализацию опухоли с минимальной травмой мозга. Транскортикальный подход применяется только при интравентрикулярных менингиомах, во всех остальных ситуациях (кроме редких исключений) доступ к опухоли осуществляется экстрацеребрально. Для облегчения подхода к базальным менингиомам в начале операции целесообразно установить люмбальный дренаж.
При всех конвекситальных, части парасагиттальных и базальных менингиом адекватная трепанация обеспечивает визуализацию всего или большей части места исходного роста опухоли. При этом становится возможной коагуляция подходящих к опухоли сосудов ТМО, что облегчает дальнейший ход операции.
Разрез ТМО определяется используемым доступом. При конвекситальных менингиомах он может быть циркулярным, в остальных случаях — линейным или лоскутным.
После вскрытия ТМО и обнаружения интракраниального узла опухоли производится коагуляция сосудов капсулы и интракапсулярное* удаление менингиомы доступным способом (отсосом, опухолевыми пинцетами и кусачками, диатермической петлей, ультразвуковым аспиратором, лазером, плазменным выпариванием, высокочастотным дезинтегратором и т.д.). При базальных менингиомах, могущих обрастать магистральные сосуды и нервы, фрагменты опухоли обычно коагулируются у матрикса, выделяются со всех сторон под контролем зрения и только после этого удаляются. Даже при обильно кровоснабженных менингиомах не следует пытаться в начале операции при помощи коагуляции отделить всю опухоль от места прикрепления к ТМО, поскольку такое отделение сложно и травматично. Также следует иметь в виду, что почти все обильно васкуляризированные менингиомы получают кровоснабжение из системы не только наружной, но и внутренней сонной артерии, и достичь полного “обескровливания” менингиомы отделением ее от матрикса не удается. Поэтому более эффективны приемы контроля кровотечения из ткани менингиомы (помимо предоперационной эмболизации либо коагуляции сосудов ТМО со стороны наружного ее листка) — либо тщательная биполярная коагуляция сосудов капсулы и удаляемых фрагментов опухоли, либо — при опухолях достаточно мягкой консистенции — быстрое интракпсулярное удаление в условиях кровотечения с последующим гемостазом. Следует иметь в виду, что современные технические устройства (лазер, ультразвуковой аспиратор и т.п.) не обеспечивают существенного снижения кровоточивости менингиомы, и оптимальным способом гемостаза остается биполярная коагуляция. Сосудистые клипсы в хирургии менингиом обычно не используются.
* Термин “интракапсулярное удаление” нередко применяется и к менингиомам без капсулы, при этом подразумевается удаление внутренних отделов опухоли
За исключением небольших конвекситальных опухолей, удалять менингиому узлом не рекомендуется.
После интракапсулярного удаления основного (обычно свыше 50–60%) объема опухоли производится мобилизация ее капсулы (или, при отсутствии таковой, периферических отделов менингиомы) путем коагуляции и пересечения патологических сосудов и арахноидальных спаек между мозгом и опухолью. При выраженном перитуморозном отеке и/или при отсутствии четкой границы между опухолью и мозгом прилежащий к менингиоме слой отечного мозгового вещества толщиной 1–2 мм обычно представляет собой бесструктурную полужидкую массу, не имеющую функционального значения и часто содержащую комплексы опухолевых клеток; эта измененная мозговая ткань может быть аспирирована отсосом или смещена тупфером.
Сосуды и нервы выделяются при помощи микроинструментария, все спайки предпочтительно пересекать ножницами под контролем зрения. Мобилизованные участки капсулы менингиомы иссекаются.
После удаления всей опухоли по возможности полностью иссекается или коагулируется место исходного роста менингиомы.
При наличии участков опухоли, тесно спаянных с функционально важными структурами, нерадикальное удаление менингиомы становится неизбежным. Остатки опухоли обычно коагулируются (правда, такая коагуляция не оказывает существенного влияния на вероятность продолженного роста менингиомы).
После осуществления тщательного гемостаза производится зашивание ТМО, при наличии дефекта оболочки — его пластическое закрытие. При наличии конвекситального костного дефекта осуществляется его одномоментная пластика.
В послеоперационном периоде медикаментозная терапия проводится по общим принципам. Целесообразно назначение дексаметазона по 8–24 мг/сут парентерально с отменой к 5–7 дню после операции, при наличии припадков в анамнезе — продолжение противосудорожной терапии. В большинстве случаев осуществляется ранняя активизация больных с выпиской из стационара на 7–9 сутки.
В последующем при доброкачественных менингиомах рекомендуется проведение контрольной МРТ или КТ через 2–3 мес, затем через год после операции, при отсутствии признаков опухоли (или прогрессирования ее остатков) — еще через год, затем раз в 2 года.
При атипических менингиомах контрольная МРТ или КТ производится через 2 мес, затем через 4 мес, затем (при отсутствии признаков роста опухоли) — раз в 6 мес до 2 лет после операции, раз в год до 5 лет после операции и потом раз в 2 года.
Достоверно (и независимо друг от друга) на вероятность рецидива менингиомы влияют:
1) ее гистологическая злокачественность;
2) радикальность операции;
3) была ли операция первичной или производилась по поводу рецидива;
4) лучевая терапия в послеоперационном периоде.
Роль остальных факторов изучается.
Дистанционная гамма-терапия в СОД около 60 Гр по 90% изодозе, подводимой к очагу без краевого захвата фракциями по 2 Гр 5 дней в неделю, обеспечивает 5-летний контроль (отсутствие прогрессирования) радикально не удаленной доброкачественной менингиомы в 85–95% случаев и 10-летний — в 80–85%. Однако во многих случаях и без облучения остатки опухоли могут не прогрессировать в течение длительного времени и даже (изредка) подвергаться обратному развитию, поэтому дистанционная лучевая терапия после первой операции удаления доброкачественной менингиомы не назначается. Показания к лучевой терапии:
1) короткий (менее 1 года) период между операциями одной степени радикальности;
2) третья операция той же или меньшей степени радикальности в течение 5 лет после первой;
3) выявляемое в динамике (на МРТ или КТ) прогрессирование неоперабельной опухоли.
Диагноз атипической менингиомы сам по себе не является показанием к лучевой терапии.
Большие перспективы связаны с использованием в лечении доброкачественных менингиом радиохирургических методов (гамма-нож, линейный ускоритель, пучок протонов и других тяжелых частиц).
Сегодня радиохирургия стала альтернативой прямому хирургическому вмешательству при лечении труднодоступных менингиом. При опухолях небольшого размера радиохирургия обеспечивает лучшие функциональные результаты при не меньшей эффективности и практически нулевой летальности. В ряде случаев перед радиохирургическим лечением требуется прямое вмешательство с целью уменьшения объема радикально неоперабельной менингиомы и придания ее остаткам более “удобной” для радиохирургии формы. Однако следует помнить, что при операбельных менингиомах методом выбора остается прямое хирургическое вмешательство.
В редких случаях инкурабельных, с применением вышеописанных способов, менингиом назначается симптоматическое лечение, включающее, в первую очередь, глюкокортикостероиды. При наличии перитуморозного отека мозга эффект обычных (8–24 мг/сут дексаметазона парентерально) доз глюкокортикостероидов бывает существенным, особенно в первые месяцы лечения.
Клиническая эффективность антипрогестиновых препаратов (в частности тамоксифена) и мифепристона оказалась низкой при серьезных побочных эффектах. Изучается возможность применения антагонистов ионов кальция. Достоверно эффективных схем химиотерапии на сегодня не существует.
Прогноз
В настоящее время 5-летняя выживаемость оперируемых больных составляет около 92%. Вероятность рецидива доброкачественной менингиомы в течение 15 лет после операции колеблется от 4% после полного (тип 1 по Симпсону) до 80% после неполного (тип 4 по Симпсону) удаления опухоли, в среднем составляет около 20%. Послеоперационная летальность — от 0 до 5% в зависимости от локализации менингиомы.
Конвекситальные менингиомы
К конвекситальным относят менингиомы, исходящие из ТМО наружной поверхности мозга, не связанные с верхним сагиттальным синусом и его боковыми лакунами (рис. 1). Они составляют 23% внутричерепных менингиом и делятся по анатомическим областям на лобные, теменные, височные и затылочные. Изредка встречаются внутрикостные (интраоссальные, оссальные) и эктопические менингиомы.
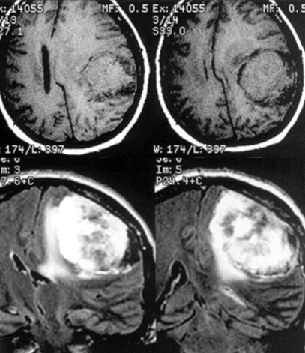
Рисунок 1. Конвекситальная менингиома левой теменной области. МРТ, Т1-взвешенные изображения до (вверху) и после (внизу) контрастного усиления. Несмотря на большие размеры, опухоль не имеет отношения к верхнему сагиттальному синусу
Клиническая картина определяется локализацией и размерами менингиомы, первыми проявлениями часто бывают парциальные (фокальные) эпилептические припадки. Внутричерепная гипертензия развивается редко, обычно при опухолях большого размера или с выраженным перитуморозным отеком.
Основные методы объективной диагностики — МРТ и КТ.
Целью операции является радикальное удаление менингиомы (тип 1 по Симпсону). Разрез кожи должен обеспечивать возможность выполнения трепанации, превышающей размеры опухоли не менее чем на 1 см во всех направлениях. Кожный лоскут предпочтительно отсепаровывать отдельно от надкостнично-подапоневротического, последний может быть использован для пластики всегда пораженной конвекситальной ТМО. При опухолевом поражении надкостницы последняя иссекается.
Трепанация выполняется краниотомом или пилой Джигли. При наличии гиперостоза возможна его резекция по частям (костными кусачками, бором), но оптимальной техникой является формирование и откидывание включающего гиперостоз лоскута в пределах непораженной кости. Гиперостоз должен быть после этого удален либо девитализирован.
После коагуляции сосудов ТМО производится циркулярный ее разрез в пределах непораженной части. Затем — коагуляция и рассечение арахноидальной оболочки по периферии видимой части менингиомы, коагуляция, рассечение капсулы и интракапсулярное удаление опухоли. После этого — мобилизация и постепенное иссечение капсулы менингиомы. Конвекситальные менингиомы небольшого размера могут быть удалены узлом.
В конце операции осуществляется пластика дефекта конвекситальной ТМО (обычно лоскутом надкостницы, реже лоскутом фасции височной мышцы или широкой фасции бедра, возможно применение синтетических трансплантатов). Все костные дефекты закрывают — либо собственной костью, либо синтетическим трансплантатом (чаще — полиметилметакрилатом). Мягкие ткани и кожа зашиваются, под кожным лоскутом обычно оставляется на сутки выведенный через контраппертуру активный дренаж.
В послеоперационном периоде с 1 суток больным разрешают ходить, выписка из стационара производится обычно на 5–7 сутки.
Парасагиттальные менингиомы (ПСМ)
К парасагиттальным относятся менингиомы, связанные с верхним сагиттальным синусом (ВСС) и большим серповидным отростком (БСО) (рис. 2). Менингиомы ВСС встречаются чаще и составляют около 75% ПСМ. В западной литературе менингиомы БСО традиционно выделяются в отдельную группу.
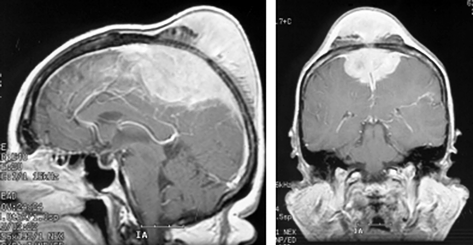
Рисунок 2. Парасагиттальная менингиома средней трети верхнего сагиттального синуса, с большим гиперостозом и интракраниальным узлом (МРТ, Т1-взвешенные изображения, с контрастным усилением). Синус полностью проращен опухолью
ПСМ составляют около 30% внутричерепных менингиом и делятся на опухоли передней, средней и задней третей ВСС и(или) БСО. Передняя треть ВСС с соответствующим сектором БСО расположена между петушиным гребнем и коронарным швом, средняя — между коронарным и ламбдовидным швами и задняя — между ламбдовидным швом и стоком синусов, расположенным обычно на уровне наружной бугристости затылочной кости. Менингиомы стока синусов иногда выделяются в отдельную группу. Примерно в 50% наблюдений ПСМ бывают двусторонними.
Менингиомы передней трети ВСС и БСО
Составляют около 30% ПСМ. Помимо симптомов поражения лобных долей и нарушений обоняния, характеризуются выраженной внутричерепной гипертензией. Поражающие основание передней черепной ямки ольфакторные менингиомы составляют отдельную группу и здесь не рассматриваются. Особая выраженность гипертензионного синдрома при менингиомах передней трети ВСС, БСО и риноольфакторных верифицирована на большом клиническом материале (p<0,001), но патогенез этой зависимости пока неясен.
Менингиомы средней трети ВСС и БСО
Составляют около 55% ПСМ. Наиболее характерные симптомы — парциальные (фокальные) судорожные или сенсорные припадки, начинающиеся обычно с ноги и наблюдающиеся у 80–90% больных, а также парезы конечностей и/или нарушения чувствительности; у 20% больных наблюдаются нарушения функции тазовых органов (вплоть до недержания мочи). Внутричерепная гипертензия нехарактерна, наблюдается либо при глубинно расположенных опухолях БСО, либо при ПСМ гигантского размера и с перитуморозным отеком.
Менингиомы задней трети ВСС и БСО
Составляют около 15% ПСМ. Наиболее характерные симптомы — головные боли и дефекты полей зрения. Признаки внутричерепной гипертензии появляются в поздних стадиях заболевания, когда опухоль распространяется в вырезку намета мозжечка и вызывает блокаду ликворных путей.
Диагностика ПСМ. Основные (помимо клинического) методы — МРТ, КТ и в ряде случаев селективная АГ. Прямая синусография в настоящее время не используется.
Основное внимание в комплексе предоперационной диагностики ПСМ уделяется состоянию ВСС. Он может быть проходим, либо частично или полностью блокирован менингиомой. Никаких достоверных клинических признаков окклюзии ВСС менингиомой не существует.
Полная проходимость ВСС устанавливается как по косвенным (отсутствие признаков распространения опухоли в синус, по данным МРТ или КТ), так и по прямым признакам (визуализация ВСС на всем протяжении, по данным МРТ или селективной АГ).
Достоверным признаком частичной блокады ВСС является выявление (при МРТ, КТ с фронтальными срезами или спиральной) врастания опухоли в просвет проходимого синуса. Сужение просвета ВСС в зоне опухоли, по данным только МРТ или селективной АГ, менее информативно, т.к. может быть быть вариантом анатомического строения синуса (когда его естественное сужение совпадает с локализацией опухоли), указывать на сдавление ВСС экстрасинусным узлом менингиомы и, наконец, свидетельствовать о врастании опухоли в просвет ВСС.
Признаками полной блокады ВСС могут быть отсутствие визуализации просвета ВСС в опухоли, по данным КТ и МРТ, и отсутствие кровотока по ВСС в зоне опухоли, по данным МРТ или селективной АГ. К косвенным признакам окклюзии ВСС относят: отсутствие на ангиограммах впадающих в его пораженную часть корковых вен; наличие “аркадных” вен, дренирующих кровь в обход пораженной части ВСС; гипертрофию нижнего сагиттального синуса и анастомотической вены Тролара (при ПСМ, расположенных кпереди от нее). Однако всегда следует иметь в виду, что отсутствие проходимости ВСС, по данным предоперационных исследований, может свидетельствовать как об истиной его окклюзии, так и о функциональном, временном (на момент исследования) замедлении кровотока в зоне опухоли (и в норме скорость тока крови по ВСС может периодически снижаться до 0), поэтому решение о манипуляциях на ВСС может приниматься только на основании интраоперационной диагностики.
Особенности хирургии ПСМ. Оптимальным видом разреза кожи авторы считают полукружный основанием ко лбу (или к затылку — при ПСМ задней трети ВСС и БСО), могут использоваться S-образный и линейный (по средней линии) разрезы. Не следует формировать подковообразные лоскуты.
Трепанация во всех случаях ПСМ должна обеспечивать обнажение ВСС, т.е. быть двусторонней. Костный лоскут перед откидыванием должен быть полностью мобилизован (подвижен), размеры трепанационного окна должны превышать размеры опухоли на 1 см. Возможно формирование одного костного лоскута, но самой безопасной техникой является выполнение односторонней костно-пластической трепанации с последующей резекцией кости над ВСС. При расположении гиперостоза над ВСС лучше (безопаснее) резецировать пораженную кость кусачками или бором.
Даже при отсутствии повреждения наружного листка ТМО в парасагиттальной области после откидывания костного лоскута всегда возникает кровотечение из входивших в кость венозных выпускников и пахионовых грануляций, расположенных в области верхней стенки ВСС и боковых лакун. При ПСМ это кровотечение может быть весьма интенсивным в связи с венозной гипертензией. Гемостаз необходимо осуществлять без коагуляции (тампонадой, оксицеллюлозой, гемостатической губкой, фибрин-тромбиновыми композициями, мышцей, ушиванием дефектов).
Небольшие дефекты стенки ВСС могут быть закрыты фибрин-тромбиновыми пластинами. При более существенном повреждении стенки ВСС производится ушивание дефекта без сужения просвета синуса, при необходимости осуществляют пластику дефекта лоскутом ТМО или надкостницы. Для швов на ВСС лучше использовать атравматические монофиламентные нити 5/0–6/0 (как характеризующиеся минимальной тромбогенностью). Следует любыми способами стараться избежать перевязки проходимого ВСС в средней и задней третях, поскольку это может привести к тяжелой инвалидизации или даже смерти больного.
При ПСМ, поражающих ВСС, после откидывания костного лоскута и осуществления гемостаза производится предварительная оценка состояния ВСС (визуально, пальпаторно, при возможности с помощью ультрасонографии и доплерографии). Разрез ТМО производится полукружный, основанием к ВСС. Особое внимание следует обратить на сохранение целостности парасагиттальных вен. В случае включения функционально значимых вен в опухоль часто приходится оставлять неудаленными связанные с венами небольшие фрагменты опухолевой ткани. Вначале производят интракапсулярное удаление опухоли, затем — мобилизацию и иссечение ее капсулы. После удаления всей экстрасинусной части опухоли производится окончательная оценка состояния кровотока по ВСС, в сомнительных случаях, помимо ультрасонографии и/или доплерографии, можно рекомендовать пункцию синуса иглой или надрез его стенки.
При полной блокаде ВСС производится его резекция. Безопаснее вначале рассечь ВСС в центре опухолевого блока и продолжать постепенное иссечение его кпереди и кзади до появления венозного кровотечения. В инфильтрированную часть ВСС у переднего и заднего полюсов опухолевого блока обычно впадают имеющие компенсаторное значение вены, выключение которых может вести к тяжелой инвалидизации больного. Поэтому при получении венозного кровотечения из культи ВСС целесообразно осуществить гемостаз путем прошивания синуса и произвести коагуляцию инфильтрированных стенок.
При частичной блокаде ВСС возможна резекция пораженных стенок с удалением внутрисинусной части опухоли, с последующим ушиванием небольших дефектов или пластикой стенки синуса лоскутом из ТМО или надкостницы. В большей части случаев проще и безопаснее ограничиться коагуляцией пораженных стенок ВСС. Тотальная (т.е. всех 3 стенок) пластика ВСС — сложная и опасная операция, для широкой практики не рекомендуется.
Менингиомы БСО составляют около 25% ПСМ. Обычно не выходят на поверхность коры. Доступ к опухоли осуществляется через межполушарную щель, лобные вены могут быть пересечены, роландовы и расположенные кзади от них — мобилизованы (поскольку на протяжении 1–5 см перед впадением в ВСС идут параллельно ему). При менингиомах передней трети БСО существует опасность повреждения передней мозговой артерии, часто проходящей по задненижней поверхности капсулы опухоли и иногда даже включенной в ее строму. Соответственно, удаление этой части опухоли должно осуществляться на завершающих этапах операции и с особой осторожностью. Применение микрохирургической техники и ультразвукового аспиратора позволяет успешно удалить опухоль при минимальной (1–2 см) тракции медиальной коры. Непременное условие — максимально полное интракапсулярное удаление менингиомы на начальных этапах операции, это значительно снижает травматичность операции. Проращенный опухолью БСО резецируют в пределах здоровых тканей.
В послеоперационном периоде, помимо обычного лечения, со 2 суток больным назначают от 75 до 125 мг ацетилсалициловой кислоты в растворе внутрь раз в сутки на 1–2 мес, после реконструктивных вмешательств на ВСС и/или венах вместо нее назначают низкомолекулярный гепарин на 5–7 дней и варфарин на 1–2 мес. Наблюдающееся достаточно часто умеренное скопление ликвора под кожным лоскутом проходит без специального лечения к 1–2 мес после операции.
Менингиомы передней черепной ямки
К менингиомам передней черепной ямки относятся: менингиомы ольфакторной ямки, площадки основной кости, бугорка турецкого седла. Они составляют около 20% всех внутричерепных менингиом. Это разделение относительно, поскольку при распространенных менингиомах передней черепной ямки могут вовлекаться все 3 указанные области.
Основные методы диагностики менингиом передней черепной ямки — МРТ и КТ, каротидная АГ.
Менингиомы ольфакторной ямки (рис. 3)
Развиваются в области продырявленной пластинки, петушиного гребня и крыши решетчатой кости, часто распространяются кзади на площадку основной кости.
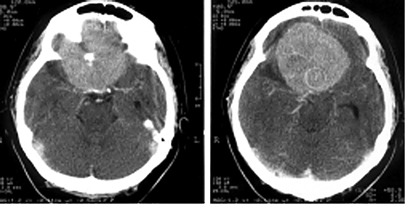
Рисунок 3. Менингиома ольфакторной ямки (КТ с контрастным усилением)
Они могут располагаться симметрично относительно средней линии или распространяться преимущественно в одну сторону, часто сочетаются с гиперостозом. Эти новообразования характеризуются длительным бессимптомным периодом. В некоторых случаях опухоли гигантских размеров проявляются лишь умеренной лобной психопатологической симптоматикой, нарушениями обоняния и застойными дисками зрительных нервов. Опухоль может распространяться экстракраниально в решетчатую пазуху, медиальные отделы глазниц, носоглотку.
Удаление менингиом ольфакторной ямки осуществляется чаще из субфронтального доступа, одностороннего (со стороны преимущественной локализации опухоли) или двустороннего. Двухлоскутный субфронтальный доступ применяется при распространении процесса в решетчатую пазуху, носоглотку. В некоторых случаях эффективным оказывается доступ через гипертрофированную лобную пазуху.
При планировании операции по поводу менингиом ольфакторной ямки важно учитывать, что кровоснабжение опухоли осуществляется из ветвей этмоидальных, средней оболочечной и глазной артерий. Опухоли больших размеров кровоснабжаются и из ветвей передних мозговых артерий, в этом случае ветви и основные стволы передних мозговых артерий могут быть включены в капсулу (и изредка — даже в строму) опухоли. Задненижний полюс опухоли может сдавливать зрительные нервы и хиазму.
Особенности хирургической техники. Перед трепанацией отсепаровывается лоскут надкостницы с сохранением его питания в надбровной области, он используется для закрытия лобной пазухи. Слизистая оболочка удаляется только из входящей в состав костного лоскута части лобной пазухи (во избежание развития мукоцеле). Вскрытая лобная пазуха временно прикрывается влажным ватником.
ТМО вскрывается линейно у нижнего края костного дефекта, параллельно ему. При двустороннем доступе ВСС прошивается 2 швами и пересекается между ними у петушиного гребня, хотя во многих случаях даже двусторонние опухоли удается удалить из одностороннего доступа (после рассечения БСО). Доступ к опухоли осуществляется путем смещения лобной доли вверх и латерально, при отсутствии аносмии обонятельный нерв следует сохранить. Затем коагулируют капсулу переднего полюса менингиомы и удаляют базальную и центральную части опухоли. По мере уменьшения объема опухоли и коагуляции места ее исходного роста производится отделение капсулы от базальных отделов лобных долей. Задний полюс опухоли отделяется от передних мозговых артерий и их ветвей, при этом кровоснабжающие опухоль ветви коагулируются на капсуле (как можно дальше от ствола передней мозговой артерии) и пересекаются. При опухоли большой распространенности от ее заднего полюса приходится отделять хиазму и супраклиноидные отделы внутренних сонных артерий.
При удалении двусторонних менингиом из одностороннего доступа после резекции опухоли на стороне подхода иссекается проращенная опухолью часть БСО и удаляется узел опухоли на противоположной стороне.
ТМО в месте исходного роста опухоли обычно тщательно коагулируется. Определенную сложность представляет остановка кровотечения из выходящих из кости этмоидальных артерий. Это кровотечение легче останавливается при помощи бесконтактной монополярной коагуляции или тампонадой воском. Для профилактики ликвореи через продырявленную пластинку область коагуляции или резекции ТМО должна быть закрыта лоскутом надкостницы, фиксированным фибрин-тромбиновым клеем.
Сложен вопрос, что делать с гиперостозом, в случае удаления которого вскрывается решетчатая пазуха, а иногда и свод носоглотки. Можно предложить следующий алгоритм.
При наличии гиперостоза существенного размера, часто с мягкотканным узлом опухоли в решетчатой пазухе, целесообразно радикальное удаление опухоли с первичной пластикой дефекта основания черепа.
При небольшом гиперостозе, особенно у больных пожилого и старческого возраста, удаление гиперостоза обычно нецелесообразно. В этих случаях рекомендуется производить КТ в динамике и при продолжении роста опухоли решать вопрос о ее удалении.
Менингиомы площадки основной кости (рис. 4)
Развиваются кзади от “петушиного гребня”. В клинике превалируют зрительные нарушения, вызванные сдавлением зрительных нервов. Оптимальный хирургический доступ к ним — односторонний субфронтальный. Техника удаления этих опухолей практически не отличается от описанной выше. Сложности возникают при врастании опухоли в зрительные каналы, в этих ситуациях радикальное удаление инфильтрированной ТМО не представляется возможным, производится декомпрессия каналов зрительных нервов с удалением доступной части опухоли.
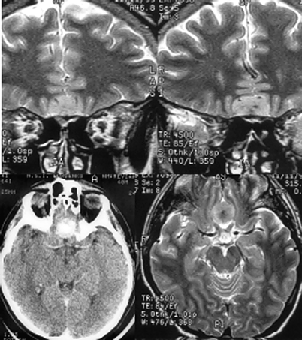
Рисунок 4. Менингиома площадки основной кости. МРТ, Т2-взвешенные изображения, КТ (слева внизу) с контрастным усилением
Менингиомы бугорка турецкого седла
Исходят из ТМО бугорка турецкого седла, хиазмальной борозды (рис. 5). Они имеют тенденцию к распространению кзади — ретрохиазмально, кпереди — на площадку основной кости. В эту же группу обычно включают менингиомы диафрагмы турецкого седла, встречающиеся редко и характеризующиеся отсутствием гиперостоза.
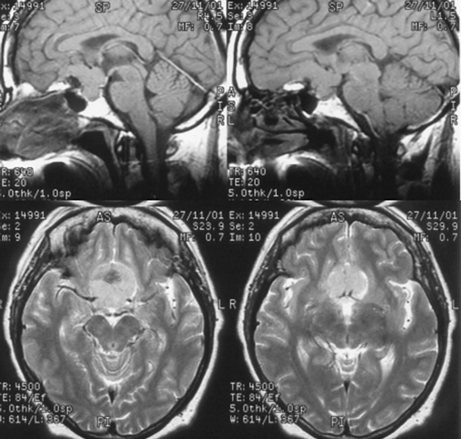
Рисунок 5. Менингиома бугорка турецкого седла. МРТ, Т1 (вверху) и Т2 (внизу) — взвешенные изображения
Клиническая симптоматика представлена хиазмальным синдромом, включающим первичную атрофию зрительных нервов с битемпоральными дефектами полей зрения.
Для удаления менингиом бугорка турецкого седла чаще всего применяется односторонняя лобная или лобно-височная трепанация справа с латеральным субфронтальным подходом. При распространенных процессах может быть использован двусторонний субфронтальный доступ.
Основные этапы удаления опухоли — уменьшение ее объема с коагуляцией питающих сосудов в области бугорка турецкого седла, отделение опухоли от передних мозговых и передней соединительной артерий, зрительных нервов, сонных артерий. В отдельных случаях опухоль окутывает переднюю мозговую, переднюю соединительную или сонные артерии. Стебель гипофиза, как правило, бывает смещен кзади и распластан на задней поверхности опухоли, но отграничен от нее арахноидальной оболочкой. Опухоль может распространяться в зрительные каналы, сдавливая зрительные нервы, в этих случаях производится микрохирургическая декомпрессия каналов зрительных нервов с удалением интраканальной части менингиомы.
При больших распространенных менингиомах передней черепной ямки (от “петушинного гребня” до диафрагмы турецкого седла), включающих клинические признаки всех 3 вышеописанных групп, обычно применяются двусторонний субфронтальный или двухлоскутный субфронтальный доступ по Derome (или его модификации).
Менингиомы средней черепной ямки
В группу менингиом средней черепной ямки обычно включают менингиомы крыльев основной кости, менингиомы кавернозного синуса, менингиомы зрительного нерва и распространенные инфильтративные менингиомы средней черепной ямки. Они составляют около 15% всех внутричерепных менингиом.
Объединяет эти группы менингиом сходство хирургических доступов и принципов удаления.
Менингиомы крыльев основной кости
По преимущественной локализации и характеру роста менингиомы крыльев основной кости делят на менингиомы латеральных отделов крыльев основной кости, менингиомы средних отделов крыльев основной кости, менингиомы медиальных отделов крыльев основной кости (переднего наклоненного отростка) и гиперостотические инфильтративные менингиомы крыльев основной кости.
Менингиомы латеральных отделов крыльев основной кости имеют исходным местом роста ТМО области птериона. Как правило, имеются инфильтрация и гиперостоз наружных отделов крыльев с распространением узла опухоли в сильвиеву щель (рис. 6).
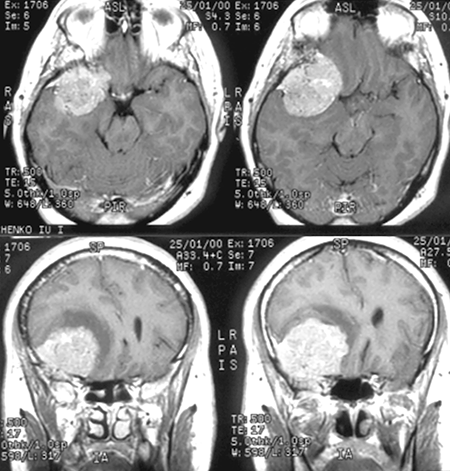
Рисунок 6. Менингиома наружных отделов крыльев основной кости, больших размеров(МРТ, Т1-взвешенные изображения, с контрастным усилением)
Менингиомы средних отделов крыльев основной кости исходят из ТМО крыльев основной кости в области верхней глазничной щели (рис. 7). Внутренняя сонная и средняя мозговая артерии смещаются опухолью, однако ветви средней мозговой артерии могут быть включены в капсулу новообразования.
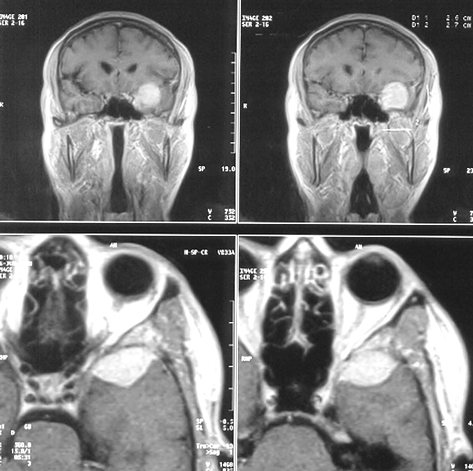
Рисунок 7. Менингиома средних отделов крыльев основной кости (МРТ, Т1-взвешенные изображения)
Менингиомы медиальных отделов крыльев основной кости (переднего наклоненного отростка) часто обрастают внутреннюю сонную артерию (рис. 8), внедряются в канал зрительного нерва, распространяются на диафрагму турецкого седла. Удаление их представляет сложную задачу, в отдельных случаях радикальное удаление таких опухолей неосуществимо. Применение системы интраоперационной нейронавигации позволяет локализовать включенную в опухоль внутреннююю сонную артерию и снижает риск ее ранения.
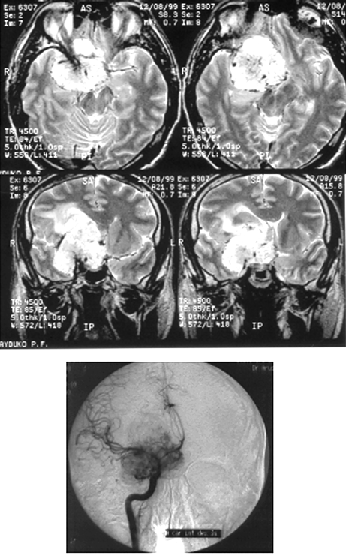
Рисунок 8. Менингиома медиальных отделов крыльев основной кости (вверху — МРТ, Т2-взвешенные изображения; внизу — правосторонняя селективная каротидная АГ, артериальная фаза. Стрелкой показано сужение просвета внутренней сонной артерии)
Гиперостотические инфильтративные менингиомы крыльев основной кости представлены, как правило, гиперостозом крыла основной кости различной степени выраженности и мягкотканными компонентами по обе стороны от гиперостоза (рис. 9).
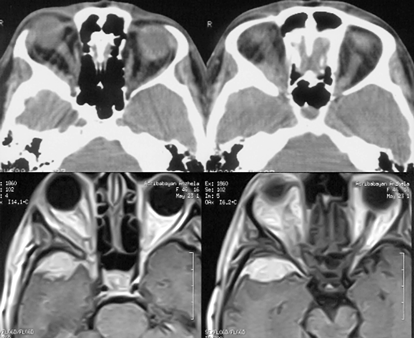
Рисунок 9. Гиперостотическая менингиома крыльев основной кости справа с формированием мягкотканного компонента в глазнице, средней черепной и подвисочной ямках. КТ (вверху) и МРТ (внизу), с контрастным усилением)
Гиперостоз более чем в половине наблюдений распространяется на стенки зрительного канала. Он может вовлекать решетчатую, скуловую, верхнечелюстную кости, чешую височной и лобной костей. Инфильтративная гиперостотическая часть может сочетаться с интрадуральным узлом опухоли. Опухоль часто врастает в верхнюю глазничную щель и передние отделы кавернозного синуса, что ограничивает радикальность операции.
Менингиомы зрительного нерва
Менингиомы зрительного нерва могут исходить из внутриглазничной и внутриканальной частей оболочки зрительного нерва. Они могут быть узловыми или плоскостными инфильтративными. Чаще опухоль имеет инфильтративный характер роста и через зрительный канал распространяется интракраниально, сочетаясь с гиперостозом стенок зрительного канала и верхней глазничной щели (рис. 10).
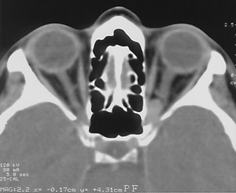
Рисунок 10. Менингиома зрительного нерва (КТ с контрастным усилением)
Основные принципы лечения менингиом средней черепной ямки. Как и в остальных случаях, самый эффективный способ лечения менингиом средней черепной ямки — их радикальное удаление. Однако сложность анатомических взаимоотношений в указанной области часто делает полное удаление опухоли невозможным.
Основным доступом к менингиомам средней черепной ямки является птериональный с дополнительной резекцией наружных отделов крыльев основной кости и его модификации. При гиперостотических менингиомах крыльев основной кости для удаления опухоли достаточно формирования орбитозигоматического лоскута с последующей резекцией гиперостоза. После удаления гиперостотически измененной кости иссекаются инфильтрированная опухолью ТМО, на внутренней поверхности которой часто имеется плоскостной узел менингиомы, и надкостница глазницы.
Менингиомы кавернозного синуса
Местом исходного роста т.н. первичных, или истинных менингиом кавернозного синуса являются его стенки, чаще боковая (рис. 11). При вторичных менингиомах кавернозного синуса место исходного роста — ТМО, покрывающая прилежащие к синусу структуры (рис. 12). Как правило, это менингиомы петрокливальной области, медиальных отделов крыльев основной кости, средней черепной ямки.
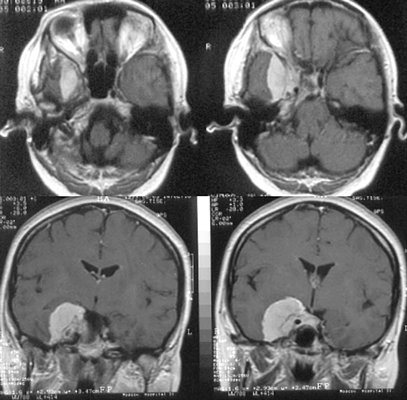
Рисунок 11. Менингиома кавернозного синуса. МРТ с контрастным усилением, Т1-взвешенные изображения
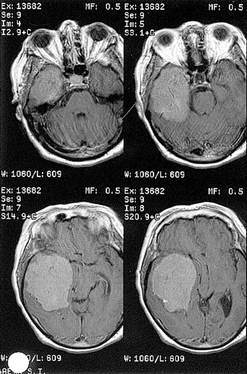
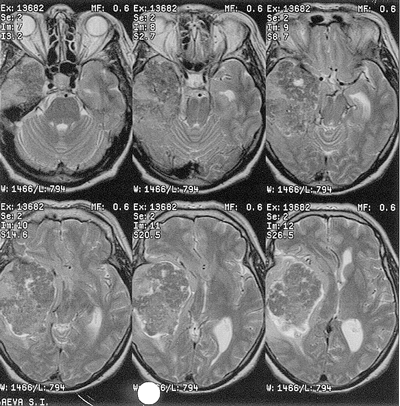
Рисунок 12. Менингиома кавернозного синуса, вторичная. МРТ, Т1 (вверху) и Т2-взвешенные (внизу) изображения
Симптоматика менингиом кавернозного синуса включает в себя глазодвигательные нарушения, симптомы поражения тройничного нерва, расстройства зрительной функции.
Характер роста менингиом кавернозного синуса определяется при помощи КТ и МРТ. При планировании хирургического вмешательства необходимы данные АГ, устанавливающие расположение и степень вовлечения в патологический процесс внутренней сонной артерии и ее ветвей.
В настоящий момент наиболее обоснована следующая тактика лечения больных с менингиомами кавернозного синуса:
— при небольших менингиомах, локализующихся в пределах кавернозного синуса и проявляющихся умеренной, непрогрессирующей симптоматикой, может быть рекомендовано динамическое наблюдение за больным либо радиохирургическое лечение;
— при распространении опухоли за пределы кавернозного синуса показано хирургическое лечение — удаление опухоли. Операция производится с использованием птерионального доступа с или без резекции скуловой дуги, орбитозигоматического, подвисочного, пресигмовидного доступов. При вовлечении черепных нервов и внутренней сонной артерии в строму опухоли рекомендовано частичное удаление опухоли с последующим облучением неудаленной ее части.
Менингиомы задней черепной ямки
Составляют около 7% внутричерепных менингиом. Выделяют менингиомы конвекситальной поверхности полушария мозжечка, намета мозжечка, задней поверхности пирамиды височной кости, ската и большого затылочного отверстия.
Клиническая картина зависит от локализации опухоли и включает симптомы поражения черепных нервов (70% больных), мозжечка (75%), ствола мозга (35%) и внутричерепной гипертензии (70%). Менингиомы задней черепной ямки реже сопровождаются перитуморозным отеком, поэтому глюкокортикостероиды могут не влиять на выраженность внутричерепной гипертензии.
Хирургический доступ определяется локализацией опухоли. Для подхода к менингиомам задней поверхности пирамиды височной кости обычно используется субокципитальный ретросигмовидный, реже пресигмовидный, субтемпоральный транстенториальный и транспирамидные доступы. Для удаления менингиом краниовертебрального перехода применяются срединный и боковой затылочный доступы.
Менингиомы конвекситальной поверхности мозжечка удаляются по принципам хирургии конвекситальных менингиом, опухоли намета мозжечка — аналогично парасагиттальным менингиомам. При проходимом и достаточно развитом (по данным МРТ или селективной АГ) противоположном поперечном синусе для повышения радикальности операции возможна резекция частично блокированного опухолью поперечного синуса.
Черепные нервы у входа в соответствующие отверстия основания черепа часто включаются в строму опухоли, что делает их сохранение при радикальном удалении менингиомы сложным или невозможным. Помимо черепных нервов, опухоль может обрастать основную артерию и ее ветви, а иногда и инфильтрировать поверхность ствола мозга. В связи с этим, во избежание стойкой инвалидизации больных, менингиомы задней поверхности пирамиды височной кости и ската обычно удаляются субтотально.
В послеоперационном периоде могут наблюдаться нарушения функции каудальных нервов, требующие лечения в условиях специализированного отделения реанимации. Поэтому операции удаления менингиом основания задней черепной ямки следует производить в хорошо оборудованных нейрохирургических центрах.
Менингиомы редких локализаций
В эту группу входят внутрижелудочковые, а также другие, не связанные с ТМО, менингиомы. Внутрижелудочковые менингиомы встречаются примерно в 1% случаев. Самой частой локализацией являются боковые желудочки (особенно область треугольника), как казуистика встречаются менингиомы III и IV желудочков.
Клиническая картина менингиом боковых желудочков характеризуется длительным малосимптомным периодом, затем появляются признаки внутричерепной гипертензии и окклюзионные симптомы. Выраженность симптомов может зависеть от положения головы больного.
Основные методы объективной диагностики — МРТ и КТ.
Хирургический доступ определяется локализацией опухоли в пределах желудочковой системы: менингиомы передних отделов боковых желудочков удаляют транскортикальным доступом через передний рог; при опухоли области треугольника предпочтительнее доступ через экономный разрез коры в теменной или височной области.
Опухоли мозговых оболочек неменинготелиального происхождения (фиброма, остеома, хондрома, липома, фиброзная гистиоцитома, сóлидная гемангиобластома, меланоцитома, диффузный меланоз)
Составляют менее 2% опухолей мозговых оболочек. Дифференциальный диагноз с менингиомой на дооперационном этапе очень труден (за исключением липомы, имеющей характерные МРТ-признаки).
Первичная фиброма (D32.0), остеома (D16.4) и хондрома (D16.4) мозговых оболочек являются казуистикой, обычно опухоль распространяется на ТМО вторично из костей черепа. В любом случае лечение хирургическое, после полного удаления опухоль практически никогда не рецидивирует.
Фиброзная гистиоцитома — группа опухолей, характеризующихся одновременно фибробластической и гистиоцитарной дифференцировкой клеток. Микроскопическая картина вариабельна, в связи с чем существует целый ряд альтернативных названий, из которых самые известные — ксантогранулома, ювенильная ксантогранулома, фиброксантома, склерозирующая гемангиома, при локализации в коже — дерматофиброма, субэпидермальный фиброз. Доброкачественная опухоль. Лечение хирургическое, производится удаление опухоли и нескольких миллиметров прилежащей кости. Частота рецидивов — 5–10%.
Гемангиобластомы (D18.0) обычно локализуются в мозжечке и представляют собой небольшой опухолевый узел с кистой. Могут быть проявлением болезни Гиппеля — Линдау.
Сóлидная гемангиобластома мозговых оболочек встречается редко. Характерен выраженный отек окружающей ткани мозга при обычно небольших размерах опухолевого узла. Опухоль обычно обильно кровоснабжена и покрыта сетью артериовенозных сосудов, дренаж осуществляется в ближайший венозный синус ТМО. Удаление сóлидной гемангиобластомы производится по принципам хирургии артериовенозных мальформаций — вначале коагулируются все питающие опухоль артериальные сосуды, затем — дренирующие вены, и только после этого удаляется опухолевый узел. Попытка интракапсулярного удаления сóлидной гемангиобластомы до выключения артериальных афферентов может привести к фатальному кровотечению.
Липома (D32.0) часто проявляется эпилептическими припадками, симптомы выпадения выражены мягко или отсутствуют. Бывает тесно спаяна с прилежащими структурами (корой мозга, сосудами, нервами), что делает радикальное удаление липомы травматичным и неоправданным, поскольку при условии контроля массы тела остатки новообразования в размерах не увеличиваются.
Диффузный меланоз (D32.0) мозговых оболочек встречается крайне редко, диагностируется случайно (при операциях по поводу другой нейрохирургической патологии). Радикального лечения не существует. Считается фактором, предрасполагающим к развитию меланомы мозговых оболочек.
Описание проверено экспертом
Оцените статью:
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан еженедельный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).





