Ожирение - эпидемия XXI века
Д.м.н., проф. Аметов А.С., заведующий кафедрой эндокринологии и диабетологии РМАПО Минздравсоцразвития РФ
Начало XXI века ознаменовалось внезапным осознанием того факта, что ожирение стало для человечества действительно серьезной проблемой. Все возрастающее число новых случаев сахарного диабета типа 2 (СД типа 2), часто развивающегося в молодом возрасте и связанного с тяжелыми осложнениями и смертностью от сердечно-сосудистой патологии, стало оказывать влияние на сознание общественности и государства. Так как мы признали важность ожирения, изменился и наш взгляд на жировую ткань. Больше никто не рассматривает ее как ткань, которая только запасает жир. Теперь жировая ткань — это главный «виновник» многих аспектов инсулинрезистентности. Но почему происходит так, что ткань, единственной целью которой мы признавали только накопление жира, вдруг приводит, при определенных обстоятельствах, к появлению инсулинрезистентного синдрома с повышенной тромботической и воспалительной активностью?
Возможно, ответ лежит в понимании метаболизма животных, зимующих посредством спячки. Это достаточно разнородная группа, включающая бурых медведей, золотистых земляных белок, летучих мышей и лягушек, испытывает заметные фенотипические изменения в процессе зимней спячки, которая, как предполагается, повышает устойчивость организма к гипотермии, ишемии, бактериальной инфекции и атрофии мышц. Животные, зимующие подобным образом, готовятся к зиме при помощи запасания жира в имеющихся жировых клетках. Доказано, что непосредственно перед спячкой усиливается периферическая резистентность к инсулину, снижается утилизация глюкозы тканями организма, повышается резистентность к действию лептина и прокоагуляционная активность. В течение зимней спячки млекопитающие теряют 10% массы тела, и после нее они просыпаются худыми и здоровыми. Подобное сезонное изменение фенотипа, характеризующееся периодически развивающейся резистентностью к инсулину и набором веса, рассматривается исключительно с точки зрения приобретения животными ряда преимуществ, не последним из которых является увеличение продолжительности жизни.
В противоположность этому человек построил свой образ жизни на постоянном потреблении пищи с постепенным увеличением массы тела из года в год. Мы как будто готовимся к зимней спячке, но никогда не зимуем подобным образом. Возможно, реакция, которая защищает организм на короткое время, потом становится причиной длительной инсулинрезистентности и связанного с ней риска развития сердечно-сосудистой патологии. Этот постоянный и неослабевающий с годами процесс, в конечном счете, приводит к истощению β-клеток и явной форме сахарного диабета.
Специалисты в области диабета активно изучают, возможно, главную причину развития этого заболевания, которая может «скрываться» в адипоцитах. В этой связи следует отметить, что когда мы более подробно изучим роль адипоцитов в развитии ожирения и поймем этапы транскрипции, регулирующие эти процессы, тогда возможно появятся связанные с определенными мишенями новые лекарственные препараты, которые смогут помочь нам в лечении этого очень распространенного заболевания.
В настоящее время на нашей планете насчитывается около 300 млн больных, страдающих ожирением, что составляет 7% всего взрослого населения. Эксперты ВОЗ предполагают практически двукратное увеличение количества лиц с ожирением к 2025 г., что по сравнению с данными за 2000 г. составляет 45–50% взрослого населения США, 30–40% — Австралии, Великобритании и более 20% населения Бразилии. В связи с этим ожирение было признано ВОЗ новой неинфекционной «эпидемией» нашего времени.
Ожирение является полиэтиологическим хроническим рецидивирующим заболеванием, характеризующимся избыточным отложением жировой ткани в организме.
Установлено, что 97 млн человек из взрослого населения США имеют избыточную массу тела или ожирение. Проведенное в 1988–1994 гг. национальное исследование здоровья и питания (NHANES 21) выявило, что 32% взрослого населения США в возрасте 20–74 лет имеют избыточную массу тела, а распространенность ожирения возросла с 14,5 до 22,5%.
Для оценки степени ожирения используется следующая градация индекса массы тела (ИМТ) (вес(кг)/рост(м)2). Избыточной массе тела соответствует показатель 25,0–29,9 кг/м2; ожирению I степени — 30,0–34,9 кг/м2; II степени — 35,0–39,9 кг/м2 и III степени — выше 40,0 кг/м2.
Этиология ожирения многообразна. В различной степени на массу тела и распределение жировой ткани в организме влияют как внешние (характер питания, уровень физической активности), так и психологические, наследственные, а также медицинские факторы. Некоторыми исследователями подтверждено, что к ожирению приводит сочетание генетических факторови факторов внешней среды.
Важной составляющей патогенеза ожирения является собственно «жировая ткань». При изучении топографии жировой ткани удалось разделить ее на висцеральную и подкожную. В ряде исследований было показано значение распределения жира в развитии осложнений, связанных с ожирением.
Так, А. Kissebah и соавт. выявили зависимость развития инсулинрезистентности и дислипидемии у женщин с верхним типом ожирения. Авторы впервые предположили метаболическую взаимосвязь между абдоминальным ожирением и метаболическими нарушениями. Последующие работы только подтвердили развитие метаболических нарушений при абдоминально-висцеральном типе ожирения. Избыточное накопление жировой ткани в висцеральной области связано с развитием гиперинсулинемии и как следствие — инсулинрезистентностью, нарушением углеводного обмена, гипертриглицеридемией, повышением уровня ЛПНП и снижением ЛПВП. Эти связанные с висцеральным ожирением метаболические нарушения фактически и составляют синдром инсулинрезистентности или метаболический синдром.
Многочисленные проспективные исследования убедительно показали четкую связь между увеличением массы тела и увеличением риска развития целого ряда заболеваний. Так, риск заболеть СД типа 2 увеличивается в 2 раза при ожирении I степени, в 5 раз — при ожирении II степени и более чем в 10 раз — при ожирении III–IV степени. Кроме того, хорошо известно, что более 80% пациентов с СД типа 2 имеют ожирение различной степени.
Необходимо особо подчеркнуть, что избыточная масса тела часто ведет к увеличению риска возникновения целого ряда сердечно-сосудистых заболеваний и в настоящее время определена как независимый и наиболее значимый фактор риска по сравнению с такими факторами, как повышение АД или курение.
Вклад ожирения в развитие сердечно-сосудистых заболеваний представляется комплексным, и очевидным подтверждением этого является установленная прямая зависимость между избыточной массой тела и повышением частоты развития не только ИБС, но и других сердечно-сосудистых заболеваний.
Более того, ожирение ассоциируется с развитием нарушений липидного обмена (гиперхолестеринемией, гипертриглицеридемией как натощак, так и после еды, снижением уровня ЛПВП и повышением содержания ЛПНП, аполипопротеинов В в сыворотке крови). При ожирении также отмечают снижение активности различных как тканевых, так и плазменных липопротеиновых липаз.
Известно, что на фоне ожирения (как в сочетании с СД типа 2, так и без него) повышены уровни фибриногена, VII фактора свертываемости крови, плазминогена и ингибитора активатора плазминогена-1.
Ожирение приводит к ускоренному прогрессированию заболеваний суставов, а также целого ряда заболеваний, сопровождающихся гипоксией (апноэ во время сна, дыхательная недостаточность), в результате чего у пациентов развивается синдром гипервентиляции.
Другими опасными состояниями, развивающимися на фоне ожирения, являются бесплодие, камни в желчном пузыре, боли в спине и ряд злокачественных процессов, которые чаще развиваются в эндометрии, предстательной железе, молочных железах и колоректальной области. Таким образом, установлена зависимость между ожирением и онкологическими заболеваниями.
Необходимо отметить, что белая жировая ткань (БЖТ) является основной тканью, сохраняющей энергию у человека. И в случае, когда энергия необходима, она не берется из циркулирующего «топлива» или запасов углеводов, а мобилизуется из БЖТ через процесс липолиза и расщепления триглицеридов до глицерина и неэстерифицированных жирных кислот.
Коричневая жировая ткань (КЖТ) больше «специализируется» на производстве тепла, нежели на организации запасов «горючего». КЖТ состоит из многоступенчатых жировых капелек и большого количества митохондрий. КЖТ иннервируют симпатические нервы, что обеспечивает прямую стимуляцию термогенеза через β3-адренорецепторы. Процесс производства тепла защищает от холода и обеспечивает регуляцию баланса энергии.
Ожирение у человека в основном характеризуется гипертрофией жировых клеток. Однако у лиц с тяжелой, выраженной формой ожирения дополнительно увеличено количество жировых клеток вследствие привлечения «спящих» преадипоцитов, которых достаточно много во всех жировых депо.
В последнее время накоплено немало доказательств того, что жировые клетки, кроме роли наиболее важного резервуара энергии, выполняют ряд эндокринных и ауто/паракринных функций. Так, в настоящее время установлено, что продуктами секреции адипоцитов являются эстрогены, ангиотензиноген, простагландины, α-фактор некроза опухоли (ФНО-α), другие цитокины (интерлейкин-6), лептин, инсулиноподобный фактор роста 1 и связывающие белки, ингибитор активатора плазминогена 1.
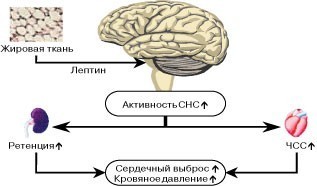
В этом перечне необходимо выделить лептин, который, по мнению многих ученых, является «молекулой десятилетия». В настоящее время считается, что лептин — это гормон, осуществляющий информационную связь между гипоталамусом и БЖТ. Первоначально существовала точка зрения, согласно которой ожирение наступает на фоне дефицита лептина. Однако в настоящее время выделены формы ожирения с нормальным уровнем лептина и даже с повышенным. Относительно недавно было установлено, что лептин связываясь с рецепторами в гипоталамусе, таламусе и других отделах головного мозга вызывает снижение аппетита, уменьшение потребления пищи и повышение использования жиров в энергетическом обмене.
Существует мнение, что основные действия лептина заключаются в:
- повышении печеночного гликогенолиза и захвата глюкозы скелетными мышцами;
- повышении скорости липолиза и уменьшении содержания триглицеридов в БЖТ;
- усилении термогенеза и стимуляции ЦНС;
- снижении содержания триглицеридов в печени, в скелетных мышцах и поджелудочной железе при отсутствии повышения уровня неэстерифицированных жирных кислот в плазме.
По современным представлениям о патогенезе ожирения, лептин подает сигнал в гипоталамус через активацию специфических лептиновых рецепторов, подавляет синтез нейропептида Y, продуцируемого нейронами дугообразного ядра, что приводит к снижению аппетита, повышению тонуса симпатической нервной системы и расхода энергии, а также изменению обмена веществ в периферических органах и тканях.
При достижении определенной концентрации лептина в сыворотке (25–30 нг/мл) дальнейшее ее повышение не сопровождается параллельным увеличением концентрации лептина в ткани мозга и спинно-мозговой жидкости. Этот феномен может играть определенную роль в развитии резистентности к лептину и ожирения. Необходимо отметить, что уровень лептина в сыворотке повышается при увеличении массы жировой ткани, причем его продукция в подкожной жировой клетчатке выше, чем в висцеральных жировых депо. В большинстве случаев при ожирении отмечается высокий уровень эндогенного лептина, что указывает на наличие резистентности к этому гормону, но совсем не означает абсолютной резистентности к экзогенному лептину. Пока неизвестно, можно ли преодолеть резистентность к лептину и снизить массу тела с помощью высоких доз этого гормона.
В связи с вышеизложенным необходимо отметить, что роль лептина в патогенезе нуждается в дальнейшем изучении.
ФНО-α и лептин являются одними из факторов, с помощью которых жировая ткань информирует гипоталамус о состоянии жировых запасов организма и, кроме того, ФНО-α может оказывать прямое действие на уровень преобразования энергии в жировой ткани при ожирении. То есть при ожирении нарушается физиологическая роль ФНО-α как сигнала, контролирующего потребление пищи.
ФНО-α был открыт в 1985 г. как соединение, вызывающее геморрагический некроз опухолей, но в дальнейшем было показано, что он вовлекается в регуляцию различных метаболических процессов, не связанных с некрозом опухолей. ФНО-α синтезируется многими типами клеток, в том числе моноцитами, макрофагами и адипоцитами. Увеличенные адипоциты секретируют повышенное количество ФНО-α, который в свою очередь нарушает взаимодействие инсулина с рецептором, а также влияет на внутриклеточные транспортеры глюкозы (GLUT-4) как в адипоцитах, так и в мышечной ткани, усиливая таким образом инсулинрезистентность.
Спектр биологического действия ФНО-α достаточно широк:
- уменьшение чувствительности к инсулину на уровне рецепторов (торможение тирозинкиназной активности);
- снижение экспрессии внутриклеточных транспортеров глюкозы GLUT-4;
- стимуляция секреции лептина;
- влияние на липидный обмен, высвобождение свободных жирных кислот (СЖК).
Кроме того, было установлено, что у пациентов с избыточной массой тела, имеется прямая связь между содержанием ФНО-α, содержанием жира в организме и уровнем инсулина крови натощак.
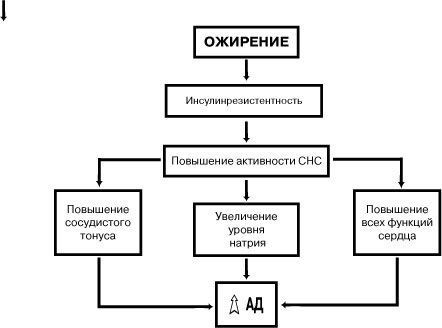
Особо следует подчеркнуть, что ожирение сопровождается нарушением действия инсулина на уровне периферических тканей — инсулинрезистентностью, которая в свою очередь обусловливает повышение уровней инсулина, кортизола, гормона роста в крови и изменение секреции половых гормонов, а также нарушение липидного профиля и снижение липопротеинлипазной активности.
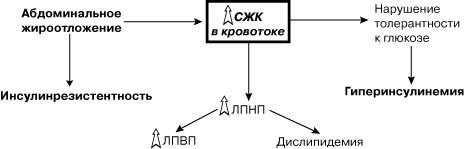
В связи с этим инсулинрезистентность, развивающуюся на фоне ожирения, часто связывают с развитием СД типа 2, артериальной гипертонией и дислипидемией. Было высказано предположение, что развитие инсулинрезистентности ассоциируется с генетической предрасположенностью и характером жироотложения. Именно абдоминальное жироотложение ответственно за развитие дислипидемий и инсулинрезистентности независимо от выраженности самого ожирения. Аккумуляция преимущественно висцерального жира достоверно коррелирует с выраженной гиперинсулинемией, высокой частотой нарушения толерантности к глюкозе, развитием атерогенных сдвигов в плазме крови, в то время как лица с низким накоплением висцеральной жировой ткани характеризуются практически нормальным метаболизмом. Почему именно висцеральное накопление жира так опасно — до конца неясно. Однако уже установлено, что в зависимости от места расположения жировая ткань характеризуется различной липолитической активностью и метаболическими последствиями. Висцеральная жировая ткань обладает значительно более высокой базальной и индуцируемой катехоламинами липолитической активностью, в результате чего высвобождается большое количество СЖК, подвергающихся усиленному, «предпочтительному» окислению, что ведет к нарушению нормального окисления глюкозы и действия инсулина на уровне периферических тканей. Повышенный уровень СЖК снижает способность печени связывать инсулин и это усиливает имеющуюся гиперинсулинемию. Способность к окислению всех липопротеидов, за исключением ЛПВП, также значительно повышается.
Клеточные механизмы инсулинрезистентности, приводящие к развитию СД типа 2, могут быть различны в разных тканях. Так, к примеру, снижение числа инсулиновых рецепторов обнаруживается в адипоцитах и, значительно в меньшей степени, в мышечных клетках. Связывание инсулина с рецептором клетки запускает цепь механизмов, усиливающих утилизацию глюкозы тканями. После связывания инсулина с рецептором происходит активация тирозин-киназы рецептора, что стимулирует аутофосфорилирование рецептора и каскад дальнейших биохимических реакций, включая транслокацию белков-транспортеров глюкозы из цитоплазмы к мембране клетки и активацию ферментных систем, обеспечивающих окисление и запасание глюкозы в тканях.
При постоянном разрушении и видоизменении жира верхней половины тела большое количество СЖК проходит через печень, вследствие чего часть из них формирует избыток липидов, а часть действует (каким путем — еще неизвестно) на печеночный распад инсулина. При обычных условиях более 80% инсулина, секретируемого поджелудочной железой, разрушается и используется печенью для своих нужд. Однако присутствие повышенного количества СЖК в портальной системе нарушает печеночное разрушение инсулина, позволяя ему проникать в общий кровоток и повышать уровень инсулина на периферии. В связи с этим особый интерес представляют современные данные о роли гиперинсулинемии в патогенезе артериальной гипертензии при ожирении в сочетании с СД типа 2. Ожирение является состоянием, сопровождающимся инсулинрезистентностью и способствующим реализации основных механизмов повышения АД: стимуляция симпатической нервной системы, усиление почечной реабсорбции натрия, прямое действие инсулина на архитектонику стенки сосудов.
Основные действия инсулина на сосудистую стенку:
- стимуляция образования и подавление регрессии липидной бляшки;
- пролиферация гладкомышечных клеток;
- стимуляция синтеза соединительной ткани;
- увеличение синтеза холестерина и повышение активности рецепторов к холестерину ЛПНП;
- стимуляция ростовых факторов.
В условиях гиперинсулинемии усиливается пролиферация гладкомышечных клеток сосудов, повышается активность рецепторов к холестерину ЛПНП, увеличивается синтез эндогенного холестерина и триглицеридов, что является одним из основных факторов в развитии атеросклеротического процесса в стенке сосудов. Стимулирующий эффект инсулина на синтез липидов гладкомышечными клетками сосудов связан с активацией липолиза, глюкозо-6-фосфат дегидрогеназы и 3-гидроксицил-КоА дегидрогеназы.
Другой механизм, через который инсулин может вызывать артериальную гипертензию, связан со стимулирующим действием на симпатическую нервную систему. В течение последних лет была доказана связь между потреблением пищи, инсулином и активностью симпатической нервной системы. При уменьшении концентрации инсулина в плазме, снижается метаболизм глюкозы в нейронах головного мозга и, как следствие, происходит снижение активации симпатических центров стволовой части мозга. И наоборот, активация симпатической нервной системы усиливается в ответ на повышенное содержание инсулина плазмы при избыточном потреблении пищи. Поэтому, стимулируя симпатическую нервную систему, инсулин включается в регулирование энергетического обмена. На клеточном уровне, инсулинрезистентность отвечает за сохранение триглицеридов в жировой ткани и гликогена в скелетных мышцах. Инсулинрезистентность и связанная с ней гиперинсулинемия, стимулирует симпатическую нервную систему, увеличивая обмен веществ и восстанавливая энергетический баланс. Но хроническая гиперинсулинемия и симпатическая стимуляция сопровождаются увеличением реабсорбции натрия, сужением сосудов, увеличением сердечного выброса и тем самым развитием гипертензии.
Помимо артериальной гипертензии, ожирение, особенно его абдоминальная форма, может привести к изменениям в строении и функции сердца. Инсулин способствует развитию ригидности сосудистой стенки и уменьшает просвет артериол и увеличивает ОПСС. Повышение сосудистого сопротивления в сочетании с увеличением сердечного выброса ведет к развитию гипертрофии левого желудочка и диастолической дисфункции. Если утолщение стенки желудочка идет не синхронно с его дилатацией, то развивается и систолическая дисфункция, что, в свою очередь, приводит к т.н. «кардиомиопатии ожирения» и застойной сердечной недостаточности. При сопутствующей артериальной гипертензии происходит перегрузка левого желудочка с возникновением концентрической гипертрофии левого желудочка. Гипертрофия левого желудочка является также важным фактором риска внезапной смерти и других сердечно-сосудистых осложнений и высокой смертности.
Основные выводы и рекомендации по лечению ожирения:
1. Избыточная масса тела и ожирение являются серьезной медицинской проблемой, требующей соответствующей эффективной коррекции с привлечением специалистов различного профиля.
2. Потеря от 5 до 10% исходной массы тела уменьшает риск возникновения заболеваний, связанных с ожирением. Целью лечения должна быть умеренная потеря веса, сохраняющаяся на длительный срок с применением лечебных мероприятий, которые были бы подобраны индивидуально каждому пациенту после тщательной оценки всех сопутствующих патологических состояний.
3. Должны быть разработаны конкретные цели лечения для каждого пациента с определением энергетического дефицита, который может быть достигнут уменьшением потребления пищи и увеличением физической активности.
4. Начальная стратегия по снижению веса и его дальнейшему поддержанию является сочетанием рационального питания, физической активности и изменения образа жизни. Все это должно соблюдаться постоянно.
5. Необходимо разработать индивидуальную программу по управлению весом, которая включает четко разработанные рекомендации по рациональному питанию, физическим упражнениям и стратегию долгосрочного изменения образа жизни.
6. Использование лекарственных препаратов против ожирения должно быть рекомендовано взрослым пациентам с наличием ожирения (ИМТ=30 кг/м2 или больше), или пациентам с избыточной массой тела и наличием сопутствующей патологии, требующей снижения веса, в случаях неэффективности программ нефармакологического лечения и при отсутствии противопоказаний к назначению лекарственного препарата.
7. При назначении лекарственных препаратов против ожирения, необходимо учитывать их возможные побочные действия.
8. Все пациенты, страдающие ожирением и принимающие лекарственные препараты, должны регулярно осматриваться врачом.
9. Быстрый набор веса является частым явлением в случаях краткосрочного приема лекарственных препаратов против ожирения (12 недель и меньше).
10. Длительность применения лекарственных препаратов против ожирения не должна превышать период времени, рекомендованный инструкцией по применению.
11. В случаях эффективного снижения веса необходимо корригировать дозу других лекарственных препаратов, которые может принимать пациент. Например, доза сахароснижающих препаратов может быть снижена, т.к. чувствительность к инсулину при снижении массы тела повышается.
Несомненно, важную роль в лечении ожирения занимают нефармакологические методы лечения, и в этой связи следует помнить три основных правила для снижения веса:
1. Ограничить потребление высококалорийных («вредных») продуктов:
а) содержащих много жира или легкоусвояемых углеводов (растительное и сливочное масло, маргарин, майонез, орехи, семечки, оливки, жирные рыба, мясо и колбаса, птица, копчености, консервы — особенно в масле, сливки, сметана, жирные сорта сыра (>30%) и другие молочные продукты);
б) сахара и сахаросодержащих сладостей (калорийность средняя, но насыщающая способность и растяжение желудка слабые), сухофруктов;
в) алкогольных напитков.
2. Наполовину от привычного уменьшить потребление продуктов средней калорийности («пригодные продукты»), если на гипокалорийном, низкожировом питании вес снижается недостаточно или имеется СД типа 2:
а) богатых крахмалом и клетчаткой (картофель, все сорта хлеба, каши, макаронные изделия, бобовые, фрукты и ягоды — кроме сухофруктов и оливок);
б) богатых белками (нежирная рыба, нежирное мясо, нежирная вареная колбаса, молочные продукты пониженной жирности).
3. Увеличить потребление низкокалорийных продуктов («полезные продукты», содержат много воды, наполняют желудок, но не прибавляют вес) — минеральной воды, кофе и чая без сахара, всех видов зелени и овощей (кроме картофеля и бобовых).
В плане медикаментозного лечения заслуживают внимания два препарата, имеющие различный механизм действия.
Орлистат — сильный и специфический ингибитор желудочно-кишечной липазы. Действует в просвете желудка и тонкого кишечника, образует ковалентную связь с активным сериновым участком желудочной и панкреатической липаз. Инактивированный фермент при этом теряет способность расщеплять жиры пищи, поступающие в форме триглицеридов до всасывающихся моноглицеридов и свободных жирных кислот. Поскольку нерасщепленные триглицериды не всасываются, возникающее вследствие этого уменьшение поступления калорий в организм приводит к уменьшению массы тела. Таким образом, терапевтическое действие препарата осуществляется без всасывания в системный кровоток. Действие орлистата сопровождается увеличением концентрации жира в каловых массах уже через 24–48 ч после приема. После отмены препарата содержание жира в кале обычно возвращается к исходному уровню через 48–72 ч. После приема внутрь 360 мг орлистата неизмененный препарат не определяется в плазме, т.е. его концентрация не достигает 5 нг/мл. Выявить неизмененный орлистат в плазме после приема терапевтических доз удавалось лишь спорадически, при этом его концентрации были крайне малы (<10 нг/мл). Признаки кумуляции отсутствовали. В клинических исследованиях побочные эффекты возникали со стороны желудочно-кишечного тракта и были обусловлены фармакологическим действием препарата, препятствующим всасыванию жиров пищи. Их выраженность и продолжительность напрямую зависели от приверженности больных к лечению и соблюдения ими рекомендаций по ограничению жиров в рационе питания.
В случаях СД типа 2 в сочетании с ожирением снижение веса является крайне важным фактором, обусловливающим возможность достижения быстрой компенсации диабета и удержания эффекта. Однако, учитывая наличие гиперинсулинемии, нужно иметь в виду сложность снижения веса у этой категории пациентов.
Как показали результаты многочисленных исследований, применение орлистата приводит к снижению показателя инсулинрезистентности на 42% от исходного, в то время как у пациентов только на диетотерапии этот показатель в среднем повышается на 6%. По данным литературы, снижение степени инсулинрезистентности связано, прежде всего, с уменьшением жировой массы тела.
Сибутрамин — ингибитор обратного захвата серотонина и норадреналина. Препарат снижает аппетит, количество потребляемой пищи, повышает чувство насыщения.
Анализ результатов пяти клинических исследований эффективности сибутрамина, в которых участвовали больные с ожирением и метаболическим синдромом, показал, что этот препарат через 12 мес от начала приема существенно уменьшал проявления метаболического синдрома у 58% больных. Было отмечено, что наряду с нормализацией уровня липидов и снижением массы тела, у пациентов, принимавших сибутрамин, имело место уменьшение окружности талии более, чем на 10,5 см. Последний факт указывает на уменьшение именно висцерального ожирения, что имеет особое значение и для больных СД типа 2, т.к. свидетельствует о снижении липотоксичности.
В данной статье рассмотрены лишь некоторые аспекты, связанные с эпидемией нашего времени — ожирением. Это состояние действительно является крайне опасным для здоровья, требующим медицинского вмешательства и постоянного контроля, т.к. сопряжено с развитием целого ряда заболеваний. Вне всякого сомнения, только объединение усилий ученых самых различных специальностей, интенсификация исследований, связанных в первую очередь с окончательным определением роли жировой ткани в организме человека, позволят разрабатывать адекватные меры лечения и профилактики этого заболевания.




